1 . 铍是原子能、火箭、导弹、航空以及冶金工业中不可缺少的宝贵材料。以绿柱石[Be3Al2(SiO3)6]为原料制备两性金属铍的工艺如图:

回答下列问题:
(1)绿柱石写成氧化物的形式为___________ 。
(2)750℃烧结时,Na3FeF6仅与绿柱石中BeO作用生成易溶于水的Na2BeF4,滤渣的主要成分是Fe2O3和___________ 。
(3)“水浸”时“产物压碎磨细”的目的是___________ ,为检验“过滤1”的滤液中是否含有Na+,可选用的方法是___________ (填方法名称)。
(4)“沉氟”的化学方程式为___________ 。
(5)镍坩埚作阴极、石墨作阳极,350~400℃电解NaCl-BeCl2熔融混合物得到金属铍,阳极反应式为___________ ;不能用该电解槽电解熔融氯化铍制金属铍的原因可能是___________ 。

回答下列问题:
(1)绿柱石写成氧化物的形式为
(2)750℃烧结时,Na3FeF6仅与绿柱石中BeO作用生成易溶于水的Na2BeF4,滤渣的主要成分是Fe2O3和
(3)“水浸”时“产物压碎磨细”的目的是
(4)“沉氟”的化学方程式为
(5)镍坩埚作阴极、石墨作阳极,350~400℃电解NaCl-BeCl2熔融混合物得到金属铍,阳极反应式为
您最近一年使用:0次
2 . 工业上用菱锰矿(MnCO3)[含FeCO3、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
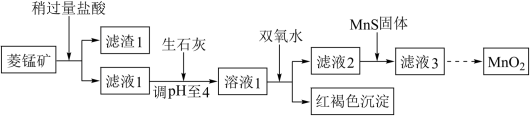
已知:1.Ksp(CuS)=1.27×10-36,Ksp(MnS)=4.65×10-14
2.生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1 mol/L
(1)基态Mn原子价层电子的轨道表示式为___________
(2)含杂质的菱锰矿使用前需将其粉碎,主要目的是___________ 。
(3)向溶液1中加入双氧水时,反应的离子方程式是___________ 。
(4)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,用沉淀溶解平衡 。解释加入难溶电解质MnS的作用___________ 。
(5)制备MnO2的另一种方法是电解法。用惰性电极电解MnCl2溶液可以制得MnO2
①生成MnO2的电极反应式是___________ 。
②若直接电解MnCl2溶液,生成MnO2的电极上同时会产生少量气体。用电极反应式解释产生此气体的原因___________ 。

已知:1.Ksp(CuS)=1.27×10-36,Ksp(MnS)=4.65×10-14
2.生成氢氧化物沉淀的pH
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
(1)基态Mn原子价层电子的轨道表示式为
(2)含杂质的菱锰矿使用前需将其粉碎,主要目的是
(3)向溶液1中加入双氧水时,反应的离子方程式是
(4)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,用
(5)制备MnO2的另一种方法是电解法。用惰性电极电解MnCl2溶液可以制得MnO2
①生成MnO2的电极反应式是
②若直接电解MnCl2溶液,生成MnO2的电极上同时会产生少量气体。用电极反应式解释产生此气体的原因
您最近一年使用:0次
名校
解题方法
3 . Burns和Dainton研究发现 与
与 合成
合成 的反应机理如下:①
的反应机理如下:① 快;②
快;② 快;③
快;③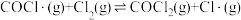 慢。其中反应②存在
慢。其中反应②存在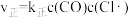 、
、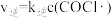 。下列说法不正确的是
。下列说法不正确的是
 与
与 合成
合成 的反应机理如下:①
的反应机理如下:① 快;②
快;② 快;③
快;③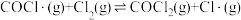 慢。其中反应②存在
慢。其中反应②存在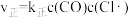 、
、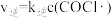 。下列说法不正确的是
。下列说法不正确的是| A.反应①的活化能小于反应③的活化能 |
B.反应②的平衡常数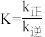 |
C.要提高合成 的速率,关键是提高反应③的速率 的速率,关键是提高反应③的速率 |
D.选择合适的催化剂能加快该反应的速率,并提高 的平衡产率 的平衡产率 |
您最近一年使用:0次
2021-12-04更新
|
287次组卷
|
2卷引用:吉林省长春市东北师大附中2021-2022学年高二上学期阶段测试化学试题
名校
解题方法
4 . 室温下按如图所示的装置进行实验(实验过程中反应体系温度保持不变),5 s内消耗锌0.01 mol。下列说法正确的是


| A.可用长颈漏斗替换分液漏斗 |
B.5 s内: |
C.5 s内: |
| D.若药品足量,再消耗0.65g Zn的时间超过5 s |
您最近一年使用:0次
解题方法
5 .  可作为水溶液中
可作为水溶液中 歧化反应的催化剂:
歧化反应的催化剂: 。实验小组探究浓度、催化剂、溶液酸性对
。实验小组探究浓度、催化剂、溶液酸性对 歧化反应速率的影响,分别在盛有反应物的试管中加入2 mL相应试剂,密闭放置观察现象。(已知:
歧化反应速率的影响,分别在盛有反应物的试管中加入2 mL相应试剂,密闭放置观察现象。(已知: 易溶解在KI溶液中)
易溶解在KI溶液中)
回答下列问题
(1)实验②、③的目的是_______ 。
(2)实验①、⑤说明 单独存在时不具有催化作用,实验①、③说明
单独存在时不具有催化作用,实验①、③说明_______ ,④是③的对比实验,则a=_______ ,可得出的结论是_______ 。
(3)查阅资料知 催化
催化 歧化反应过程分为两步,写出反应ⅱ的离子方程式。
歧化反应过程分为两步,写出反应ⅱ的离子方程式。
ⅰ.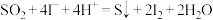
ⅱ._______
(4)实验表明, 的歧化反应速率⑥>③,则
的歧化反应速率⑥>③,则 催化
催化 歧化反应过程中
歧化反应过程中_______ (填“ⅰ”或“ⅱ”)步反应速率更快,试分析实验⑥中 的歧化反应速率快于实验③的原因
的歧化反应速率快于实验③的原因_______ 。
 可作为水溶液中
可作为水溶液中 歧化反应的催化剂:
歧化反应的催化剂: 。实验小组探究浓度、催化剂、溶液酸性对
。实验小组探究浓度、催化剂、溶液酸性对 歧化反应速率的影响,分别在盛有反应物的试管中加入2 mL相应试剂,密闭放置观察现象。(已知:
歧化反应速率的影响,分别在盛有反应物的试管中加入2 mL相应试剂,密闭放置观察现象。(已知: 易溶解在KI溶液中)
易溶解在KI溶液中)| 实验编号 | 反应物 | 试剂组成 | 实验现象 |
| ① | 18mL  饱和溶液 饱和溶液 | 无明显现象 | |
| ② | 18mL  稀溶液 稀溶液 | 0.4 KI KI | 出现浑浊较③慢 |
| ③ | 18mL  饱和溶液 饱和溶液 | 0.4 KI KI | 一段时间出现浑浊 |
| ④ | 18mL  饱和溶液 饱和溶液 | a KI、0.2 KI、0.2  | 出现浑浊较③快 |
| ⑤ | 18mL  饱和溶液 饱和溶液 | 0.2  | 无明显现象 |
| ⑥ | 18mL  饱和溶液 饱和溶液 | 0.2 KI、0.0002mol KI、0.0002mol  | 出现浑浊较③快 |
(1)实验②、③的目的是
(2)实验①、⑤说明
 单独存在时不具有催化作用,实验①、③说明
单独存在时不具有催化作用,实验①、③说明(3)查阅资料知
 催化
催化 歧化反应过程分为两步,写出反应ⅱ的离子方程式。
歧化反应过程分为两步,写出反应ⅱ的离子方程式。ⅰ.
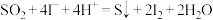
ⅱ.
(4)实验表明,
 的歧化反应速率⑥>③,则
的歧化反应速率⑥>③,则 催化
催化 歧化反应过程中
歧化反应过程中 的歧化反应速率快于实验③的原因
的歧化反应速率快于实验③的原因
您最近一年使用:0次
2021高三·全国·专题练习
6 . 可逆反应2SO2(g)+O2(g)  2SO3(g)是工业上制取H2SO4的重要反应。
2SO3(g)是工业上制取H2SO4的重要反应。
(1)在恒压条件下,该反应分组实验的有关条件如下表:
已知Ⅰ、Ⅱ两组实验过程中,SO3气体的体积分数φ(SO3)随时间t的变化曲线如图所示。
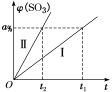
①Ⅱ组与Ⅰ相比不同的条件是___________ ;
②将Ⅰ组实验中温度变为800 ℃,则φ(SO3)达到a%所需时间___________ t1(填“小于”“大于”或“等于”)。
(2)向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小排列的是___________。
甲:在500 ℃时,10 mol SO2和10 mol O2反应
乙:在500 ℃时,用V2O5作催化剂,10 mol SO2和10 mol O2反应
丙:在450 ℃时,8 mol SO2和5 mol O2反应
丁:在500 ℃时,8 mol SO2和5 mol O2反应
 2SO3(g)是工业上制取H2SO4的重要反应。
2SO3(g)是工业上制取H2SO4的重要反应。(1)在恒压条件下,该反应分组实验的有关条件如下表:
| 反应条件 | 温度 | 容器容积 | 起始n(SO2) | 起始n(O2) | 其他条件 |
| Ⅰ组 | 500 ℃ | 1 L | 1 mol | 2 mol | 无 |
| Ⅱ组 | 500 ℃ | 1 L | 1 mol | 2 mol |

①Ⅱ组与Ⅰ相比不同的条件是
②将Ⅰ组实验中温度变为800 ℃,则φ(SO3)达到a%所需时间
(2)向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按反应速率由大到小排列的是___________。
甲:在500 ℃时,10 mol SO2和10 mol O2反应
乙:在500 ℃时,用V2O5作催化剂,10 mol SO2和10 mol O2反应
丙:在450 ℃时,8 mol SO2和5 mol O2反应
丁:在500 ℃时,8 mol SO2和5 mol O2反应
| A.甲、乙、丙、丁 | B.乙、甲、丙、丁 |
| C.乙、甲、丁、丙 | D.丁、丙、乙、甲 |
您最近一年使用:0次
名校
解题方法
7 . 实验室中模拟合成氨反应: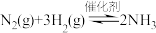 在恒容密闭容器中,初始投入量相等的条件下,得到三组实验数据如表所示:
在恒容密闭容器中,初始投入量相等的条件下,得到三组实验数据如表所示:
下列有关说法不正确的是
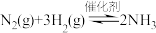 在恒容密闭容器中,初始投入量相等的条件下,得到三组实验数据如表所示:
在恒容密闭容器中,初始投入量相等的条件下,得到三组实验数据如表所示:| 实验序号 | 温度( ) ) |  浓度( 浓度( ) ) | ||||||
 |  |  |  |  |  |  | ||
| 1 | 300 | 2.00 | 1.70 | 1.50 | 1.36 | 1.25 | 1.20 | 1.20 |
| 2 | 300 | 2.00 | 1.50 | 1.28 | 1.20 | 1.20 | 1.20 | 1.20 |
| 3 | 200 | 2.00 | 1.60 | 1.39 | 1.29 | 1.27 | 1.27 | 1.27 |
| A.当容器内的压强不再改变时,说明该可逆反应已达到化学平衡状态 |
B.实验2中,前 内以 内以 的浓度变化表示的化学反应速率为 的浓度变化表示的化学反应速率为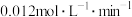 |
| C.比较实验1和2,说明实验2使用了更高效的催化剂 |
D.实验3中, 时向容器中充入一定量 时向容器中充入一定量 ,则正反应速率 ,则正反应速率 不变 不变 |
您最近一年使用:0次
2021-09-03更新
|
3953次组卷
|
12卷引用:浙江省“精诚联盟”2021-2022学年高二上学期返校考试化学试题
浙江省“精诚联盟”2021-2022学年高二上学期返校考试化学试题(已下线)第2章 化学反应速率与化学平衡(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)(已下线)第二单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)章末培优2 专题2 化学反应速率与化学平衡-2021-2022学年高二化学课后培优练(苏教教版2019选择性必修1)(已下线)2022年浙江省6月高考真题变式题11-20浙江省金华市江南中学等两校2022-2023学年高二上学期12月阶段测试化学试题重庆市万州第二高级中学2022-2023学年高二上学期12月线上考试化学试题福建省泉州市第六中学2022-2023学年高二上学期期中考化学试题江西省新余市第一中学2022-2023高二上学期期末考试化学试题(已下线)【知识图鉴】单元讲练测选择性必修1第2单元03巩固练吉林省长春外国语学校2022-2023学年高二上学期期末考试化学试卷四川省眉山市仁寿县2023-2024学年高二上学期1月期末联考化学试题
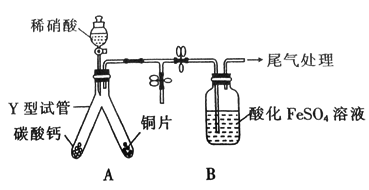
8 . 为探究铜与稀硝酸反应的产物及影响反应速率的主要因素,进行如下实验。实验一探究铜和稀硝酸反应的产物。实验装置如图,气密性已检查。
已知: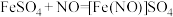 ,该反应较缓慢,待生成一定量
,该反应较缓慢,待生成一定量 时突显明显棕色。
时突显明显棕色。
(1)实验开始时先将 形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是
形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是_______ 。
(2)铜片和稀硝酸反应的化学方程式为_______ 。
(3)本实验 生成的气体中,若有
生成的气体中,若有 ,
, 的实验现象为
的实验现象为_______ ;
实验二:探究铜和稀硝酸反应速率先慢后快的原因
经过实验一,测得硝酸的浓度 ,只有
,只有 生成。当铜片与
生成。当铜片与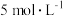 硝酸反应时,开始时反应非常缓慢,一段时间后反应速率明显加快。为探究此反应的反应速率先慢后快的原因,进行如下探究:
硝酸反应时,开始时反应非常缓慢,一段时间后反应速率明显加快。为探究此反应的反应速率先慢后快的原因,进行如下探究:
探究一:研究反应过程的温度变化对反应速率的影响,实验所得曲线和现象记录如图表。
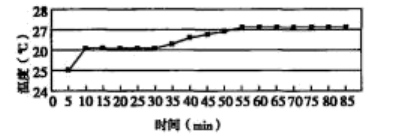
(4)从上述图表分析可得到的结论是_______ 。
探究二:研究化学反应产物对反应速率的影响
设计了如表实验,利用图中装置测定溶液突显明显棕色的时间。
(5)请将表中实验1的实验条件填写完整①_______ ②_______ ③_______
(6)通过实验发现实验1、2、3的反应速率并无明显变化,为达到实验目的还需要继续进行的实验是_______ 。

已知:
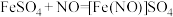 ,该反应较缓慢,待生成一定量
,该反应较缓慢,待生成一定量 时突显明显棕色。
时突显明显棕色。(1)实验开始时先将
 形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是
形试管向盛有碳酸钙的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是(2)铜片和稀硝酸反应的化学方程式为
(3)本实验
 生成的气体中,若有
生成的气体中,若有 ,
, 的实验现象为
的实验现象为实验二:探究铜和稀硝酸反应速率先慢后快的原因
经过实验一,测得硝酸的浓度
 ,只有
,只有 生成。当铜片与
生成。当铜片与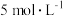 硝酸反应时,开始时反应非常缓慢,一段时间后反应速率明显加快。为探究此反应的反应速率先慢后快的原因,进行如下探究:
硝酸反应时,开始时反应非常缓慢,一段时间后反应速率明显加快。为探究此反应的反应速率先慢后快的原因,进行如下探究:探究一:研究反应过程的温度变化对反应速率的影响,实验所得曲线和现象记录如图表。
时间/ | 现象 |
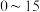 | 铜表面出现气泡,但速度很慢 |
| 25 | 溶液有很浅的蓝色,气泡生成速度加快 |
| 30 | 气泡生成速度较快,均匀冒出 |
| 45 | 洗气瓶中可见少量淡棕色的物质 |
| 50 | 溶液中蓝色明显变深,洗气瓶中突显明显棕色 |

(4)从上述图表分析可得到的结论是
探究二:研究化学反应产物对反应速率的影响
设计了如表实验,利用图中装置测定溶液突显明显棕色的时间。
| 序号 | 温度 | 铜片/ | 硝酸/ | 硝酸铜/ |
| 1 |  | ① | ② | ③ |
| 2 |  | 5 | 20 | 0.5 |
| 3 |  | 5 | 20 | 1.0 |
(6)通过实验发现实验1、2、3的反应速率并无明显变化,为达到实验目的还需要继续进行的实验是
您最近一年使用:0次
9 . 亚硝酰硫酸(NOSO4H)主要用于分散染料重氮反应中取代亚硝酸钠,从而降低成本,提高产品质量。实验室用如图装置(夹持装置略)制备少量NOSO4H,并测定产品的纯度。已知:NOSO4H遇水分解,但溶于浓硫酸而不分解。
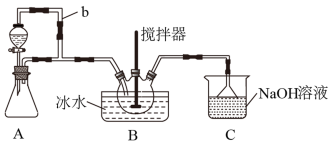
(1)装置A制取SO2,则A中反应的化学方程式为_______ ,导管b的作用是_______
(2)SO2与装置B中盛有的浓硫酸和浓硝酸的混合液在维持体系温度不得高于20℃的条件下,反应制得NOSO4H。反应过程中,亚硝酰硫酸和硝酸的物质的量随时间的变化如图所示。
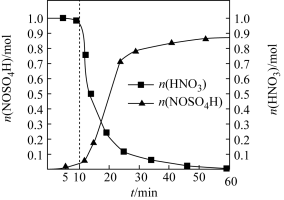
①装置B中发生反应的化学反应方程式为_______ 。
②反应进行到10min后,反应速度明显加快,其可能的原因是_______ 。
(3)装置C的主要作用是_______ 。
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是_______ 。
(5)测定亚硝酰硫酸NOSO4H的纯度:准确称取1.500g产品放入250mL的碘量瓶中,加入0.1000mol·L−1、60.00mL的KMnO4标准溶液和10.00mL25%H2SO4溶液,然后摇匀。用0.2500mol·L−1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.0mL。已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4;2MnO +5C2O
+5C2O +16H+=2Mn2++10CO2↑+8H2O。达到滴定终点时的现象为
+16H+=2Mn2++10CO2↑+8H2O。达到滴定终点时的现象为_______ ,亚硝酰硫酸的纯度为_______ (精确到0.1%)。

(1)装置A制取SO2,则A中反应的化学方程式为
(2)SO2与装置B中盛有的浓硫酸和浓硝酸的混合液在维持体系温度不得高于20℃的条件下,反应制得NOSO4H。反应过程中,亚硝酰硫酸和硝酸的物质的量随时间的变化如图所示。

①装置B中发生反应的化学反应方程式为
②反应进行到10min后,反应速度明显加快,其可能的原因是
(3)装置C的主要作用是
(4)该实验装置存在可能导致NOSO4H产量降低的缺陷是
(5)测定亚硝酰硫酸NOSO4H的纯度:准确称取1.500g产品放入250mL的碘量瓶中,加入0.1000mol·L−1、60.00mL的KMnO4标准溶液和10.00mL25%H2SO4溶液,然后摇匀。用0.2500mol·L−1草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.0mL。已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4;2MnO
 +5C2O
+5C2O +16H+=2Mn2++10CO2↑+8H2O。达到滴定终点时的现象为
+16H+=2Mn2++10CO2↑+8H2O。达到滴定终点时的现象为
您最近一年使用:0次
名校
10 . 碘在科研与生活中有重要应用。某兴趣小组用 淀粉溶液
淀粉溶液

 等式剂,探究反应条件对化学反应速率的影响。
等式剂,探究反应条件对化学反应速率的影响。
已知: (慢)
(慢)
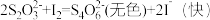
结合表中数据判断下列说法错误的是
 淀粉溶液
淀粉溶液

 等式剂,探究反应条件对化学反应速率的影响。
等式剂,探究反应条件对化学反应速率的影响。已知:
 (慢)
(慢)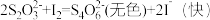
结合表中数据判断下列说法错误的是
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | |
试剂用量/ |  | 10.0 | 5.0 | 2.5 | 10.0 | 10.0 |
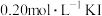 | 10.0 | 10.0 | 10.0 | 5.0 | 2.5 | |
 | 4.0 | 4.0 | 4.0 | 4.0 | 4.0 | |
 淀粉溶液 淀粉溶液 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | |
| 蒸馏水 | 0.0 | a | 7.5 | b | 7.5 | |
显色时间 | 35 | 21 | 123 | 56 | 107 | |
A.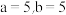 |
B.实验Ⅰ中,用 表示的反应速率为 表示的反应速率为 |
| C.反应液初始浓度越大,反应时间越短,平均反应速率越大 |
D.为确保能观察到蓝色,需满足的关系为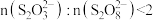 |
您最近一年使用:0次
2021-03-22更新
|
388次组卷
|
3卷引用:河北省石家庄市第二十七中学2021届高三诊断大联考化学试题
河北省石家庄市第二十七中学2021届高三诊断大联考化学试题(已下线)专题21 化学反应速率(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练湖南省邵东市第一中学2023-2024学年高二上学期10月月考化学试题



