名校
解题方法
1 . 含氮物质、含硫物质的过量排放会污染大气或水体,研究氮、硫及其化合物的性质及转化,对降低含氮、含硫物质的污染有着重大的意义。
(1)在一定条件下,浓度为5%的尿素[CO(NH2)2]吸收液可以脱除烟气中的NOx。不同吸收反应温度下,测得NOx的脱除率变化如图所示。
已知信息:尿素的分解温度是160℃。尿素水解:CO(NH2)2+H2O=CO2↑+2NH3↑,在低温水解速度慢。
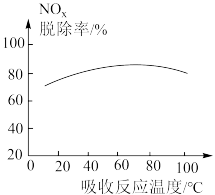
①当温度大于80℃时,NOx的脱除率随温度升高而降低的原因是______ 。
②写出在70~80℃条件下,尿素和烟气中NO2反应的化学方程式为______ 。
(2)ClO2可对烟气中NOx、SO2进行协同脱除,涉及的部分反应如下:
Ⅰ.ClO2+NO=NO2+ClO
Ⅱ.ClO+NO=Cl+NO2
Ⅲ.ClO2+SO2=ClO+SO3
Ⅳ.ClO+SO2=Cl+SO3
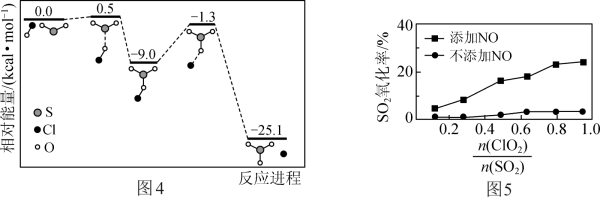
①反应Ⅳ的历程如图4所示。该历程中最大活化能E正=_____ kcal·mol-1。
②保持其他条件不变,分别在不添加NO、添加NO两种情况下,控制模拟烟气中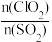 不同并反应相同时间,测得SO2氧化率随
不同并反应相同时间,测得SO2氧化率随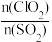 变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是
变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是______ 。添加NO时,SO2氧化率比不添加NO时高,其原因可能是______ 。
(1)在一定条件下,浓度为5%的尿素[CO(NH2)2]吸收液可以脱除烟气中的NOx。不同吸收反应温度下,测得NOx的脱除率变化如图所示。
已知信息:尿素的分解温度是160℃。尿素水解:CO(NH2)2+H2O=CO2↑+2NH3↑,在低温水解速度慢。

①当温度大于80℃时,NOx的脱除率随温度升高而降低的原因是
②写出在70~80℃条件下,尿素和烟气中NO2反应的化学方程式为
(2)ClO2可对烟气中NOx、SO2进行协同脱除,涉及的部分反应如下:
Ⅰ.ClO2+NO=NO2+ClO
Ⅱ.ClO+NO=Cl+NO2
Ⅲ.ClO2+SO2=ClO+SO3
Ⅳ.ClO+SO2=Cl+SO3
①反应Ⅳ的历程如图4所示。该历程中最大活化能E正=
②保持其他条件不变,分别在不添加NO、添加NO两种情况下,控制模拟烟气中
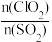 不同并反应相同时间,测得SO2氧化率随
不同并反应相同时间,测得SO2氧化率随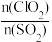 变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是
变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是
您最近半年使用:0次
2 . 铍是原子能、火箭、导弹、航空以及冶金工业中不可缺少的宝贵材料。以绿柱石[Be3Al2(SiO3)6]为原料制备两性金属铍的工艺如图:

回答下列问题:
(1)绿柱石写成氧化物的形式为___________ 。
(2)750℃烧结时,Na3FeF6仅与绿柱石中BeO作用生成易溶于水的Na2BeF4,滤渣的主要成分是Fe2O3和___________ 。
(3)“水浸”时“产物压碎磨细”的目的是___________ ,为检验“过滤1”的滤液中是否含有Na+,可选用的方法是___________ (填方法名称)。
(4)“沉氟”的化学方程式为___________ 。
(5)镍坩埚作阴极、石墨作阳极,350~400℃电解NaCl-BeCl2熔融混合物得到金属铍,阳极反应式为___________ ;不能用该电解槽电解熔融氯化铍制金属铍的原因可能是___________ 。

回答下列问题:
(1)绿柱石写成氧化物的形式为
(2)750℃烧结时,Na3FeF6仅与绿柱石中BeO作用生成易溶于水的Na2BeF4,滤渣的主要成分是Fe2O3和
(3)“水浸”时“产物压碎磨细”的目的是
(4)“沉氟”的化学方程式为
(5)镍坩埚作阴极、石墨作阳极,350~400℃电解NaCl-BeCl2熔融混合物得到金属铍,阳极反应式为
您最近半年使用:0次
名校
3 . 下列事实或做法与化学反应速率无关的是
| A.灌制香肠时,添加红曲红 | B.餐后立即喝水不利于健康 |
| C.常用冰箱保存食物 | D.食品加工时,往往添加抗氧化剂 |
您最近半年使用:0次
2022-12-05更新
|
288次组卷
|
3卷引用:陕西省咸阳市实验中学2021-2022学年高二上学期第二次月考化学试题
名校
4 . 下列过程中,化学反应速率减小对人类无益的是
| A.金属的腐蚀 | B.食物的腐败 | C.塑料的老化 | D.氨的合成 |
您最近半年使用:0次
2022-10-16更新
|
700次组卷
|
24卷引用:(人教版2019)必修第二册 第六章 化学反应与能量 第二节 化学反应的速率与限度
(人教版2019)必修第二册 第六章 化学反应与能量 第二节 化学反应的速率与限度甘肃省白银市靖远县第四中学2020-2021学年高一下学期期中考试化学(文)试题黑龙江省鹤岗市第一中学2021-2022学年高二上学期开学考试化学试题黑龙江省佳木斯市第一中学2021-2022 学年高二上学期期中考试化学试题人教2019版选择性必修一第二章 第一节 化学反应速率 课后习题北京市丰台区2021-2022学年高二上学期期中练习化学(B)试题北京市中国农业大学附属中学2021-2022学年高二上学期期中学业水平调研化学试题(已下线)2012-2013学年河北省衡水市第十四中学高二下学期期末考试化学试卷河南省项城三高2017-2018学年高一下学期第二次段考(B卷)化学试题(已下线)2018年9月3日 《每日一题》人教必修4-对化学反应速率的理解【校级联考】福建省闽侯二中五校教学联合体2017-2018学年高二上学期期中考试化学试题云南省玉溪市江川区第二中学2018-2019学年高一下学期开学考试化学试题吉林省吉林市第三中学2018-2019学年高一5月阶段测试化学试题吉林省辽源市田家炳高级中学2019-2020学年高二上学期期中考试化学试题北京师范大学珠海分校附属外国语学校2019-2020学年高一下学期期末考试化学试题辽宁省大连市普兰店第三十八中学2020-2021学年高二上学期第二次考试化学试题黑龙江省哈尔滨市第三中学2022-2023学年高二上学期第二次验收化学试题河南省濮阳市元龙高级中学2021-2022学年高二下学期第一次质量检测化学试题北京市顺义区杨镇第一中学2022-2023学年高二上学期期中检测化学试题天津市南开大学附属中学2022-2023学年高二上学期期中阶段检测化学试题黑龙江省虎林市高级中学2022-2023学年高二上学期期中考试化学试题北京市丰台区2022-2023学年高二上学期期末考试化学试题辽宁省辽东南协作校2023-2024学年高二上学期10月月考化学试题四川省自贡市第一中学校2023-2024学年高二上学期12月月考化学试题
5 . 工业上用菱锰矿(MnCO3)[含FeCO3、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
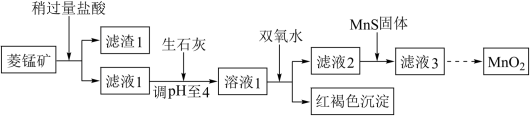
已知:1.Ksp(CuS)=1.27×10-36,Ksp(MnS)=4.65×10-14
2.生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1 mol/L
(1)基态Mn原子价层电子的轨道表示式为___________
(2)含杂质的菱锰矿使用前需将其粉碎,主要目的是___________ 。
(3)向溶液1中加入双氧水时,反应的离子方程式是___________ 。
(4)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,用沉淀溶解平衡 。解释加入难溶电解质MnS的作用___________ 。
(5)制备MnO2的另一种方法是电解法。用惰性电极电解MnCl2溶液可以制得MnO2
①生成MnO2的电极反应式是___________ 。
②若直接电解MnCl2溶液,生成MnO2的电极上同时会产生少量气体。用电极反应式解释产生此气体的原因___________ 。

已知:1.Ksp(CuS)=1.27×10-36,Ksp(MnS)=4.65×10-14
2.生成氢氧化物沉淀的pH
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
(1)基态Mn原子价层电子的轨道表示式为
(2)含杂质的菱锰矿使用前需将其粉碎,主要目的是
(3)向溶液1中加入双氧水时,反应的离子方程式是
(4)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,用
(5)制备MnO2的另一种方法是电解法。用惰性电极电解MnCl2溶液可以制得MnO2
①生成MnO2的电极反应式是
②若直接电解MnCl2溶液,生成MnO2的电极上同时会产生少量气体。用电极反应式解释产生此气体的原因
您最近半年使用:0次
名校
6 . 某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是___ 。
(2)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4四种溶液,可与实验中CuSO4溶液起相似作用的是__ 。
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入六个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:V1=___ ,V6=___ ,V9=___ 。
②反应一段时间后,实验A中的金属呈___ 色,实验E中的金属呈___ 色。
③该同学最后得出的结论为当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:___ 。
(1)硫酸铜溶液可以加快氢气生成速率的原因是
(2)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4四种溶液,可与实验中CuSO4溶液起相似作用的是
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入六个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 | A | B | C | D | E | F |
| 4 mol∙L−1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②反应一段时间后,实验A中的金属呈
③该同学最后得出的结论为当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:
您最近半年使用:0次
名校
解题方法
7 . Burns和Dainton研究发现 与
与 合成
合成 的反应机理如下:①
的反应机理如下:① 快;②
快;② 快;③
快;③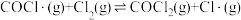 慢。其中反应②存在
慢。其中反应②存在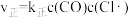 、
、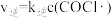 。下列说法不正确的是
。下列说法不正确的是
 与
与 合成
合成 的反应机理如下:①
的反应机理如下:① 快;②
快;② 快;③
快;③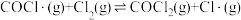 慢。其中反应②存在
慢。其中反应②存在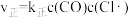 、
、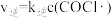 。下列说法不正确的是
。下列说法不正确的是| A.反应①的活化能小于反应③的活化能 |
B.反应②的平衡常数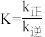 |
C.要提高合成 的速率,关键是提高反应③的速率 的速率,关键是提高反应③的速率 |
D.选择合适的催化剂能加快该反应的速率,并提高 的平衡产率 的平衡产率 |
您最近半年使用:0次
2021-12-04更新
|
283次组卷
|
2卷引用:吉林省长春市东北师大附中2021-2022学年高二上学期阶段测试化学试题
名校
8 . 化学与生产、生活密切相关。下列事实与化学反应速率无关的是
| A.制造蜂窝煤时加入生石灰 | B.家用铁锅、铁铲等餐具保持干燥 |
| C.工业矿石冶炼前先将矿石粉碎 | D.食品、蔬菜贮存在冰箱或冰柜里 |
您最近半年使用:0次
2021-12-03更新
|
500次组卷
|
5卷引用:湖南省嘉禾县第一中学2021-2022学年高二上学期10月月考化学试题
名校
解题方法
9 . 室温下按如图所示的装置进行实验(实验过程中反应体系温度保持不变),5 s内消耗锌0.01 mol。下列说法正确的是


| A.可用长颈漏斗替换分液漏斗 |
B.5 s内: |
C.5 s内: |
| D.若药品足量,再消耗0.65g Zn的时间超过5 s |
您最近半年使用:0次
解题方法
10 .  可作为水溶液中
可作为水溶液中 歧化反应的催化剂:
歧化反应的催化剂: 。实验小组探究浓度、催化剂、溶液酸性对
。实验小组探究浓度、催化剂、溶液酸性对 歧化反应速率的影响,分别在盛有反应物的试管中加入2 mL相应试剂,密闭放置观察现象。(已知:
歧化反应速率的影响,分别在盛有反应物的试管中加入2 mL相应试剂,密闭放置观察现象。(已知: 易溶解在KI溶液中)
易溶解在KI溶液中)
回答下列问题
(1)实验②、③的目的是_______ 。
(2)实验①、⑤说明 单独存在时不具有催化作用,实验①、③说明
单独存在时不具有催化作用,实验①、③说明_______ ,④是③的对比实验,则a=_______ ,可得出的结论是_______ 。
(3)查阅资料知 催化
催化 歧化反应过程分为两步,写出反应ⅱ的离子方程式。
歧化反应过程分为两步,写出反应ⅱ的离子方程式。
ⅰ.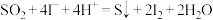
ⅱ._______
(4)实验表明, 的歧化反应速率⑥>③,则
的歧化反应速率⑥>③,则 催化
催化 歧化反应过程中
歧化反应过程中_______ (填“ⅰ”或“ⅱ”)步反应速率更快,试分析实验⑥中 的歧化反应速率快于实验③的原因
的歧化反应速率快于实验③的原因_______ 。
 可作为水溶液中
可作为水溶液中 歧化反应的催化剂:
歧化反应的催化剂: 。实验小组探究浓度、催化剂、溶液酸性对
。实验小组探究浓度、催化剂、溶液酸性对 歧化反应速率的影响,分别在盛有反应物的试管中加入2 mL相应试剂,密闭放置观察现象。(已知:
歧化反应速率的影响,分别在盛有反应物的试管中加入2 mL相应试剂,密闭放置观察现象。(已知: 易溶解在KI溶液中)
易溶解在KI溶液中)| 实验编号 | 反应物 | 试剂组成 | 实验现象 |
| ① | 18mL  饱和溶液 饱和溶液 | 无明显现象 | |
| ② | 18mL  稀溶液 稀溶液 | 0.4 KI KI | 出现浑浊较③慢 |
| ③ | 18mL  饱和溶液 饱和溶液 | 0.4 KI KI | 一段时间出现浑浊 |
| ④ | 18mL  饱和溶液 饱和溶液 | a KI、0.2 KI、0.2  | 出现浑浊较③快 |
| ⑤ | 18mL  饱和溶液 饱和溶液 | 0.2  | 无明显现象 |
| ⑥ | 18mL  饱和溶液 饱和溶液 | 0.2 KI、0.0002mol KI、0.0002mol  | 出现浑浊较③快 |
(1)实验②、③的目的是
(2)实验①、⑤说明
 单独存在时不具有催化作用,实验①、③说明
单独存在时不具有催化作用,实验①、③说明(3)查阅资料知
 催化
催化 歧化反应过程分为两步,写出反应ⅱ的离子方程式。
歧化反应过程分为两步,写出反应ⅱ的离子方程式。ⅰ.
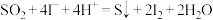
ⅱ.
(4)实验表明,
 的歧化反应速率⑥>③,则
的歧化反应速率⑥>③,则 催化
催化 歧化反应过程中
歧化反应过程中 的歧化反应速率快于实验③的原因
的歧化反应速率快于实验③的原因
您最近半年使用:0次



