1 . 我国锅炉燃煤采用沸腾炉逐渐增多,采用沸腾炉的好处在于
| A.增大煤燃烧时的燃烧热 |
| B.减少炉中杂质气体(如SO2等)的形成 |
| C.使化学反应更容易进行 |
| D.使燃料燃烧充分,从而提高燃料的利用率 |
您最近半年使用:0次
2 . 下列有关合成氨工业的说法,正确的是
A.根据勒夏特列原理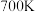 左右比室温更有利于合成氨的反应 左右比室温更有利于合成氨的反应 |
B.由于氨易液化, 在实际生产中可循环使用,所以总体来说合成氨的产率很高 在实际生产中可循环使用,所以总体来说合成氨的产率很高 |
| C.升高温度可以加快反应速率,且有利于化学平衡向合成氨的方向移动 |
D.合成氨采用的压强是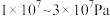 ,因为该压强下铁触媒的活性最高 ,因为该压强下铁触媒的活性最高 |
您最近半年使用:0次
3 . 下列生产生活中需要增大化学反应速率的是
 |  |  |  |
| A.铁桥生锈 | B.牛奶变质 | C.塑料老化 | D.高炉炼铁 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
4 . 化学与生产、生活密切相关。下列事实与化学反应速率无关的是
| A.食品中添加适量的防腐剂 | B.医护人员冷藏存放“新冠”疫苗 |
| C.食盐中添加碘酸钾 | D.工业矿石冶炼前先将矿石粉碎 |
您最近半年使用:0次
2024-01-23更新
|
216次组卷
|
3卷引用:四川省眉山市青神中学校2023-2024学年高二上学期1月期末化学试题
解题方法
5 . 回答下列问题。
Ⅰ.某实验小组用 100mL0.50mol·L-1NaOH 溶液与 60mL0.50mol·L-1 硫酸溶液进行中和热的测定,装置如图1所示。回答下列问题:
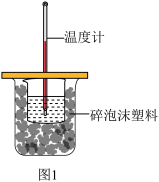
(1)图中装置缺少的仪器是___________ 。
(2)硫酸稍过量的原因是___________ 。
(3)某小组同学实验数据记录如下表,若近似认为 0.50mol•L-1NaOH 溶液与 0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容 c=4.18J•g-1•℃-1,则上述实验测得的中和热△H =___________ (结果保留至小数点后一位)。
(4)上述实验测得中和热的数值小于 57.3kJ·mol-1,产生偏差的原因可能是___________(填字母)。
Ⅱ.甲、乙两位同学探究外界条件对化学反应速率的影响。
【实验原理】反应:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,反应过程中溶液出现乳白色浑浊和有刺激性气味的 气体。
【实验用品】0.1mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液、蒸馏水、试管、烧杯、量筒、胶头滴管等。
实验一:甲同学利用如图装置测定化学反应速率。
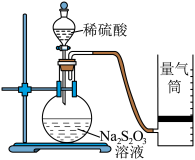
(5)为保证实验的准确性和可靠性,利用该装置进行实验前应先进行的操作是___________ 。除如图所示的实验用品外,还需要的实验仪器 是___________ 。
(6)若在 2min 时收集到 224mL(已折算成标准状况)气体,可计算出在 2min 内的反应速率v(H+)=0.02mol/(L·min),而该速率值比实际值偏小,其原因是_____________________ 。
实验二:乙同学得到各组实验数据如下表。
(7)实验Ⅰ、Ⅱ探究___________ 对化学反应速率的影响,a=___________ ,V=___________ 。
(8)实验Ⅱ、Ⅲ探究温度对化学反应速率的影响。实验表明,实验Ⅲ的反应速率最快,支持这一结论的实验现象是___________ 。
Ⅰ.某实验小组用 100mL0.50mol·L-1NaOH 溶液与 60mL0.50mol·L-1 硫酸溶液进行中和热的测定,装置如图1所示。回答下列问题:

(1)图中装置缺少的仪器是
(2)硫酸稍过量的原因是
(3)某小组同学实验数据记录如下表,若近似认为 0.50mol•L-1NaOH 溶液与 0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容 c=4.18J•g-1•℃-1,则上述实验测得的中和热△H =
| 实验序号 | 起始温度t1/℃ | 终止温度T2/℃ | 平均温度差(t2-t1)/℃ | ||
| HCl | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | _____ |
| 2 | 27.0 | 27.2 | 27.1 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
| A.量取 NaOH 溶液时仰视读数 |
| B.为了使反应充分,向酸溶液中分次加入碱溶液 |
| C.实验装置保温隔热效果差 |
| D.用铜丝代替玻璃搅拌器搅拌 |
Ⅱ.甲、乙两位同学探究外界条件对化学反应速率的影响。
【实验原理】反应:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,反应过程中溶液出现乳白色浑浊和有刺激性气味的 气体。
【实验用品】0.1mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液、蒸馏水、试管、烧杯、量筒、胶头滴管等。
实验一:甲同学利用如图装置测定化学反应速率。

(5)为保证实验的准确性和可靠性,利用该装置进行实验前应先进行的操作是
(6)若在 2min 时收集到 224mL(已折算成标准状况)气体,可计算出在 2min 内的反应速率v(H+)=0.02mol/(L·min),而该速率值比实际值偏小,其原因是
实验二:乙同学得到各组实验数据如下表。
| 实验编号 | Na2S2O3溶液 | H2SO4溶液 | 蒸馏水 | |||
| 浓度/(mol/L) | 体积/mL | 浓度/(mol/L) | 体积/mL | 体积/mL | 温度/℃ | |
| I | 0.1 | 3.0 | 0.1 | 3.0 | V | 20 |
| Ⅱ | 0.1 | 5.0 | 0.1 | 3.0 | 0 | a |
| Ⅲ | 0.1 | 5.0 | 0.1 | 3.0 | 0 | 30 |
(8)实验Ⅱ、Ⅲ探究温度对化学反应速率的影响。实验表明,实验Ⅲ的反应速率最快,支持这一结论的实验现象是
您最近半年使用:0次
6 . 对于由多个基元反应组成的化学反应,其反应的快慢由最慢的一步基元反应决定。(______)
您最近半年使用:0次
名校
解题方法
7 . 含氮物质、含硫物质的过量排放会污染大气或水体,研究氮、硫及其化合物的性质及转化,对降低含氮、含硫物质的污染有着重大的意义。
(1)在一定条件下,浓度为5%的尿素[CO(NH2)2]吸收液可以脱除烟气中的NOx。不同吸收反应温度下,测得NOx的脱除率变化如图所示。
已知信息:尿素的分解温度是160℃。尿素水解:CO(NH2)2+H2O=CO2↑+2NH3↑,在低温水解速度慢。
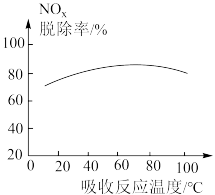
①当温度大于80℃时,NOx的脱除率随温度升高而降低的原因是______ 。
②写出在70~80℃条件下,尿素和烟气中NO2反应的化学方程式为______ 。
(2)ClO2可对烟气中NOx、SO2进行协同脱除,涉及的部分反应如下:
Ⅰ.ClO2+NO=NO2+ClO
Ⅱ.ClO+NO=Cl+NO2
Ⅲ.ClO2+SO2=ClO+SO3
Ⅳ.ClO+SO2=Cl+SO3
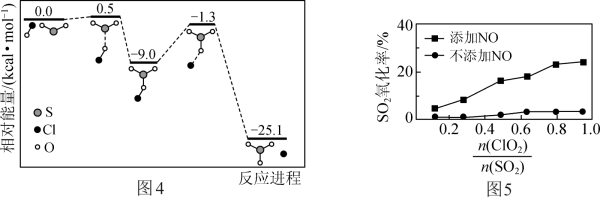
①反应Ⅳ的历程如图4所示。该历程中最大活化能E正=_____ kcal·mol-1。
②保持其他条件不变,分别在不添加NO、添加NO两种情况下,控制模拟烟气中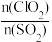 不同并反应相同时间,测得SO2氧化率随
不同并反应相同时间,测得SO2氧化率随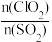 变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是
变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是______ 。添加NO时,SO2氧化率比不添加NO时高,其原因可能是______ 。
(1)在一定条件下,浓度为5%的尿素[CO(NH2)2]吸收液可以脱除烟气中的NOx。不同吸收反应温度下,测得NOx的脱除率变化如图所示。
已知信息:尿素的分解温度是160℃。尿素水解:CO(NH2)2+H2O=CO2↑+2NH3↑,在低温水解速度慢。

①当温度大于80℃时,NOx的脱除率随温度升高而降低的原因是
②写出在70~80℃条件下,尿素和烟气中NO2反应的化学方程式为
(2)ClO2可对烟气中NOx、SO2进行协同脱除,涉及的部分反应如下:
Ⅰ.ClO2+NO=NO2+ClO
Ⅱ.ClO+NO=Cl+NO2
Ⅲ.ClO2+SO2=ClO+SO3
Ⅳ.ClO+SO2=Cl+SO3
①反应Ⅳ的历程如图4所示。该历程中最大活化能E正=
②保持其他条件不变,分别在不添加NO、添加NO两种情况下,控制模拟烟气中
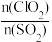 不同并反应相同时间,测得SO2氧化率随
不同并反应相同时间,测得SO2氧化率随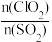 变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是
变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是
您最近半年使用:0次
8 . 下列反应中最快的是
| A.铁生锈 | B.铝热反应 | C.溶洞形成 | D.塑料降解 |
您最近半年使用:0次
名校
9 . 下列过程中,化学反应速率的增大对人类有益的是
| A.金属的腐蚀 | B.食物的腐败 | C.塑料的老化 | D.氨的合成 |
您最近半年使用:0次
2023-04-10更新
|
833次组卷
|
17卷引用:吉林省吉林市普通高中友好学校2022-2023学年高二上学期期末考试化学试题
吉林省吉林市普通高中友好学校2022-2023学年高二上学期期末考试化学试题上海市育才中学2022-2023学年高二下学期(等级考)期中调研化学试题新疆喀什地区巴楚县2023-2024学年高二上学期10月期中考试化学试题甘肃省兰州市教育局第四片区联考2023-2024学年高二上学期期中考试化学试题广西南宁市西乡塘区南宁高新技术产业开发区桂鼎学校2022-2023学年高二上学期11月期中化学试题北京市通州区2023-2024学年高二上学期期中考试化学试题北京市第一六一中学2023-2024学年高二上学期10月月考化学试题黑龙江省哈尔滨师范大学附属中学2023-2024学年高二上学期期末考试化学试题陕西省西安市阎良区关山中学2023-2024学年高二上学期期中考试化学试题黑龙江省哈尔滨师范大学附属中学2023-2024学年高二上学期期末考试 化学试卷内蒙古呼伦贝尔市满洲里远方中学2023-2024学年高二上学期期末考试化学试题浙江省宁波效实中学2022-2023学年高一下学期期中考试化学(选考班)试题四川省广安市岳池县第一中学2022-2023学年高一下学期第二次月考化学试题黑龙江省实验中学2022-2023学年高一下学期期中考试化学(学考)试题陕西省西安市鄠邑区2022-2023学年高一下学期6月期末考试化学试题湖南省岳阳市岳阳楼区2022-2023学年高一下学期期末考试化学试题湖南省邵阳市绥宁县第一中2022-2023学年高一下学期期中考试化学试题
2022高三·全国·专题练习
真题
名校
10 . 某兴趣小组设计实验探究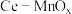 ,催化空气氧化
,催化空气氧化 的效率。回答下列问题:
的效率。回答下列问题:
步骤Ⅰ 制备
在通风橱中用下图装置制备 (加热及夹持装置省略),反应方程式:
(加热及夹持装置省略),反应方程式: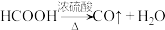

(1)装置A中盛放甲酸的仪器的名称是_______ 。
(2)从B、C、D中选择合适的装置收集 ,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。
,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。______
步骤Ⅱ 检验
将 通入新制银氨溶液中,有黑色沉淀生成。
通入新制银氨溶液中,有黑色沉淀生成。
(3)该反应的化学方程式为_______ 。
步骤Ⅲ 探究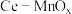 催化空气氧化
催化空气氧化 的效率
的效率
将一定量 与空气混合,得到
与空气混合,得到 体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至
体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至 ,按一定流速通入气体样品。(已知:
,按一定流速通入气体样品。(已知: 是白色固体,易吸水潮解:
是白色固体,易吸水潮解: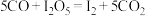 )
)
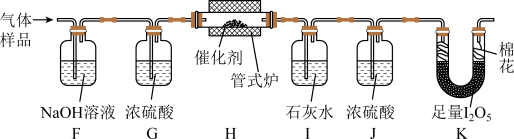
(4)通入 (已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了
(已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了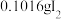 。
。
①能证明 被空气氧化的现象是
被空气氧化的现象是_______ ;
② 被催化氧化的百分率为
被催化氧化的百分率为_______ ;
③若未通入氮气,②的结果将_______ (填“偏大”“偏小”或“无影响”)。
(5)探究气体与催化剂接触时长对催化氧化效率的影响时,采用_______ 方法可以缩短接触时长。
(6)步骤Ⅲ装置存在的不足之处是_______ 。
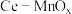 ,催化空气氧化
,催化空气氧化 的效率。回答下列问题:
的效率。回答下列问题:步骤Ⅰ 制备

在通风橱中用下图装置制备
 (加热及夹持装置省略),反应方程式:
(加热及夹持装置省略),反应方程式: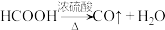

(1)装置A中盛放甲酸的仪器的名称是
(2)从B、C、D中选择合适的装置收集
 ,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。
,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。步骤Ⅱ 检验

将
 通入新制银氨溶液中,有黑色沉淀生成。
通入新制银氨溶液中,有黑色沉淀生成。(3)该反应的化学方程式为
步骤Ⅲ 探究
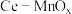 催化空气氧化
催化空气氧化 的效率
的效率将一定量
 与空气混合,得到
与空气混合,得到 体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至
体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至 ,按一定流速通入气体样品。(已知:
,按一定流速通入气体样品。(已知: 是白色固体,易吸水潮解:
是白色固体,易吸水潮解: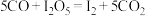 )
)
(4)通入
 (已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了
(已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了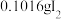 。
。①能证明
 被空气氧化的现象是
被空气氧化的现象是②
 被催化氧化的百分率为
被催化氧化的百分率为③若未通入氮气,②的结果将
(5)探究气体与催化剂接触时长对催化氧化效率的影响时,采用
(6)步骤Ⅲ装置存在的不足之处是
您最近半年使用:0次
2023-02-20更新
|
6396次组卷
|
15卷引用:第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)
(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题16 化学实验综合题-2022年高考真题模拟题分项汇编2022年福建省高考真题化学试题(已下线)2022年福建省高考真题变式题(实验探究题)(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试变式题(实验探究题)(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试举一反三(实验探究题)(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)专题突破卷13 化学实验基础(二)-2024年高考化学一轮复习考点通关卷(新教材新高考)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)山东省新泰市第一中学(弘文部)2023-2024学年高三上学期第二次月考化学试题福建省莆田第一中学2023-2024学年高一上学期期末考试化学试题宁夏回族自治区石嘴山市第三中学2023-2024学年高三上学期期末考试理综试题-高中化学天津市耀华中学2023-2024学年高三下学期开学验收考化学试卷



