名校
解题方法
1 . 我国某科研团队研究了氧化铈( )表面空间受阻路易斯酸碱对(FLPs)和氮(N)掺杂的协同作用,促进了光吸收、
)表面空间受阻路易斯酸碱对(FLPs)和氮(N)掺杂的协同作用,促进了光吸收、 成键活化,提高了光催化还原
成键活化,提高了光催化还原 制
制 的产率和选择性。反应历程如图所示。已知:*代表吸附在催化剂表面的物种,+代表起始或终态物质;自由能与相对能量相当。下列叙述错误的是
的产率和选择性。反应历程如图所示。已知:*代表吸附在催化剂表面的物种,+代表起始或终态物质;自由能与相对能量相当。下列叙述错误的是
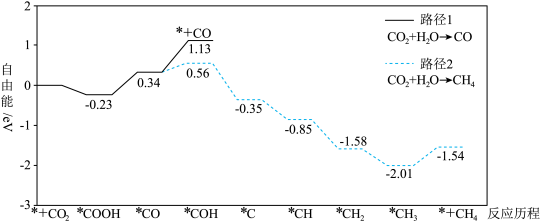
 )表面空间受阻路易斯酸碱对(FLPs)和氮(N)掺杂的协同作用,促进了光吸收、
)表面空间受阻路易斯酸碱对(FLPs)和氮(N)掺杂的协同作用,促进了光吸收、 成键活化,提高了光催化还原
成键活化,提高了光催化还原 制
制 的产率和选择性。反应历程如图所示。已知:*代表吸附在催化剂表面的物种,+代表起始或终态物质;自由能与相对能量相当。下列叙述错误的是
的产率和选择性。反应历程如图所示。已知:*代表吸附在催化剂表面的物种,+代表起始或终态物质;自由能与相对能量相当。下列叙述错误的是
| A.*COH→*C是路径2的决速步 | B.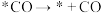 过程中自由能升高 过程中自由能升高 |
C.CO为光催化还原 制 制 的副产物 的副产物 | D.同等条件下,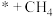 比 比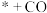 稳定 稳定 |
您最近半年使用:0次
2024-02-05更新
|
104次组卷
|
3卷引用:湖南省张家界市2023-2024学年高三上学期期末联考化学试题
名校
解题方法
2 . 化学与生产、生活密切相关。下列事实与化学反应速率无关的是
| A.食品中添加适量的防腐剂 | B.医护人员冷藏存放“新冠”疫苗 |
| C.食盐中添加碘酸钾 | D.工业矿石冶炼前先将矿石粉碎 |
您最近半年使用:0次
2024-01-23更新
|
216次组卷
|
3卷引用:四川省眉山市青神中学校2023-2024学年高二上学期1月期末化学试题
名校
3 . 下列过程中,化学反应速率的增大对人类有益的是
| A.金属的腐蚀 | B.食物的腐败 | C.塑料的老化 | D.氨的合成 |
您最近半年使用:0次
2023-04-10更新
|
834次组卷
|
17卷引用:吉林省吉林市普通高中友好学校2022-2023学年高二上学期期末考试化学试题
吉林省吉林市普通高中友好学校2022-2023学年高二上学期期末考试化学试题陕西省西安市鄠邑区2022-2023学年高一下学期6月期末考试化学试题湖南省岳阳市岳阳楼区2022-2023学年高一下学期期末考试化学试题黑龙江省哈尔滨师范大学附属中学2023-2024学年高二上学期期末考试化学试题黑龙江省哈尔滨师范大学附属中学2023-2024学年高二上学期期末考试 化学试卷内蒙古呼伦贝尔市满洲里远方中学2023-2024学年高二上学期期末考试化学试题上海市育才中学2022-2023学年高二下学期(等级考)期中调研化学试题浙江省宁波效实中学2022-2023学年高一下学期期中考试化学(选考班)试题四川省广安市岳池县第一中学2022-2023学年高一下学期第二次月考化学试题黑龙江省实验中学2022-2023学年高一下学期期中考试化学(学考)试题新疆喀什地区巴楚县2023-2024学年高二上学期10月期中考试化学试题甘肃省兰州市教育局第四片区联考2023-2024学年高二上学期期中考试化学试题广西南宁市西乡塘区南宁高新技术产业开发区桂鼎学校2022-2023学年高二上学期11月期中化学试题北京市通州区2023-2024学年高二上学期期中考试化学试题北京市第一六一中学2023-2024学年高二上学期10月月考化学试题陕西省西安市阎良区关山中学2023-2024学年高二上学期期中考试化学试题湖南省邵阳市绥宁县第一中2022-2023学年高一下学期期中考试化学试题
真题
名校
4 . 某兴趣小组设计实验探究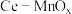 ,催化空气氧化
,催化空气氧化 的效率。回答下列问题:
的效率。回答下列问题:
步骤Ⅰ 制备
在通风橱中用下图装置制备 (加热及夹持装置省略),反应方程式:
(加热及夹持装置省略),反应方程式: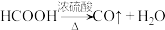

(1)装置A中盛放甲酸的仪器的名称是_______ 。
(2)从B、C、D中选择合适的装置收集 ,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。
,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。______
步骤Ⅱ 检验
将 通入新制银氨溶液中,有黑色沉淀生成。
通入新制银氨溶液中,有黑色沉淀生成。
(3)该反应的化学方程式为_______ 。
步骤Ⅲ 探究 催化空气氧化
催化空气氧化 的效率
的效率
将一定量 与空气混合,得到
与空气混合,得到 体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至
体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至 ,按一定流速通入气体样品。(已知:
,按一定流速通入气体样品。(已知: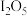 是白色固体,易吸水潮解:
是白色固体,易吸水潮解: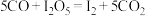 )
)
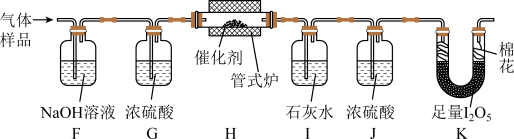
(4)通入 (已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了
(已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了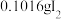 。
。
①能证明 被空气氧化的现象是
被空气氧化的现象是_______ ;
② 被催化氧化的百分率为
被催化氧化的百分率为_______ ;
③若未通入氮气,②的结果将_______ (填“偏大”“偏小”或“无影响”)。
(5)探究气体与催化剂接触时长对催化氧化效率的影响时,采用_______ 方法可以缩短接触时长。
(6)步骤Ⅲ装置存在的不足之处是_______ 。
 ,催化空气氧化
,催化空气氧化 的效率。回答下列问题:
的效率。回答下列问题:步骤Ⅰ 制备

在通风橱中用下图装置制备
 (加热及夹持装置省略),反应方程式:
(加热及夹持装置省略),反应方程式: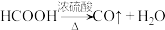

(1)装置A中盛放甲酸的仪器的名称是
(2)从B、C、D中选择合适的装置收集
 ,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。
,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。步骤Ⅱ 检验

将
 通入新制银氨溶液中,有黑色沉淀生成。
通入新制银氨溶液中,有黑色沉淀生成。(3)该反应的化学方程式为
步骤Ⅲ 探究
 催化空气氧化
催化空气氧化 的效率
的效率将一定量
 与空气混合,得到
与空气混合,得到 体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至
体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至 ,按一定流速通入气体样品。(已知:
,按一定流速通入气体样品。(已知: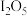 是白色固体,易吸水潮解:
是白色固体,易吸水潮解: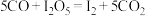 )
)
(4)通入
 (已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了
(已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了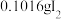 。
。①能证明
 被空气氧化的现象是
被空气氧化的现象是②
 被催化氧化的百分率为
被催化氧化的百分率为③若未通入氮气,②的结果将
(5)探究气体与催化剂接触时长对催化氧化效率的影响时,采用
(6)步骤Ⅲ装置存在的不足之处是
您最近半年使用:0次
2023-02-20更新
|
6405次组卷
|
15卷引用:福建省莆田第一中学2023-2024学年高一上学期期末考试化学试题
福建省莆田第一中学2023-2024学年高一上学期期末考试化学试题宁夏回族自治区石嘴山市第三中学2023-2024学年高三上学期期末考试理综试题-高中化学(已下线)专题16 化学实验综合题-2022年高考真题模拟题分项汇编2022年福建省高考真题化学试题(已下线)2022年福建省高考真题变式题(实验探究题)(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试变式题(实验探究题)(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试举一反三(实验探究题)(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题突破卷13 化学实验基础(二)-2024年高考化学一轮复习考点通关卷(新教材新高考)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)山东省新泰市第一中学(弘文部)2023-2024学年高三上学期第二次月考化学试题天津市耀华中学2023-2024学年高三下学期开学验收考化学试卷
5 . 钛是航空、军工、电力等领域重要的金属材料。一种由钛铁矿[主要成分是钛酸亚铁(FeTiO3),还含有少量 等杂质]制备金属钛同时获得
等杂质]制备金属钛同时获得 的工艺流程如图:
的工艺流程如图:
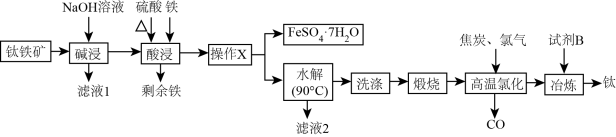
已知:“酸浸”后钛主要以 的形式存在;“水解”后钛以
的形式存在;“水解”后钛以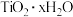 的形式存在。
的形式存在。
回答下列问题:
(1)基态 的最外层电子排布式为
的最外层电子排布式为_______ 。
(2)写出“水解( )”时发生反应的离子方程式:
)”时发生反应的离子方程式:_______ ;验证“洗涤”达到目的的操作为_______ 。
(3)“高温氯化”时发生反应的化学方程式为_______ ;有利于该过程中“气—固—固”接触的措施是_______ (写一种)。某科研小组模拟“高温氯化”反应理论计算结果显示,在 条件下达到平衡时,
条件下达到平衡时, 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于
,但实际生产中反应温度却远高于 ,其原因是
,其原因是_______ (写一种)。
(4)每次取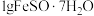 样品,加适量水溶解并加入
样品,加适量水溶解并加入 溶液和
溶液和 溶液,再用
溶液,再用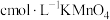 标准溶液滴定至终点,平行滴定3次,平均消耗标准溶液
标准溶液滴定至终点,平行滴定3次,平均消耗标准溶液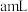 。
。
已知: (黄色)
(黄色)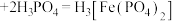 (无色)
(无色)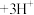 。
。
滴定终点溶液颜色变为_______ ;该样品中 的质量分数为
的质量分数为_______ (填含c,a的表达式)。
 等杂质]制备金属钛同时获得
等杂质]制备金属钛同时获得 的工艺流程如图:
的工艺流程如图:
已知:“酸浸”后钛主要以
 的形式存在;“水解”后钛以
的形式存在;“水解”后钛以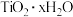 的形式存在。
的形式存在。回答下列问题:
(1)基态
 的最外层电子排布式为
的最外层电子排布式为(2)写出“水解(
 )”时发生反应的离子方程式:
)”时发生反应的离子方程式:(3)“高温氯化”时发生反应的化学方程式为
 条件下达到平衡时,
条件下达到平衡时, 几乎完全转化为
几乎完全转化为 ,但实际生产中反应温度却远高于
,但实际生产中反应温度却远高于 ,其原因是
,其原因是(4)每次取
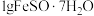 样品,加适量水溶解并加入
样品,加适量水溶解并加入 溶液和
溶液和 溶液,再用
溶液,再用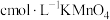 标准溶液滴定至终点,平行滴定3次,平均消耗标准溶液
标准溶液滴定至终点,平行滴定3次,平均消耗标准溶液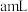 。
。已知:
 (黄色)
(黄色)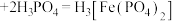 (无色)
(无色)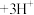 。
。滴定终点溶液颜色变为
 的质量分数为
的质量分数为
您最近半年使用:0次
解题方法
6 . Mn2O3是一种重要的化工产品。以菱锰矿(主要成分为MnCO3,还含有少量Fe3O4、FeO、CoO、Al2O3)为原料制备Mn2O3的工艺流程如下图所示。
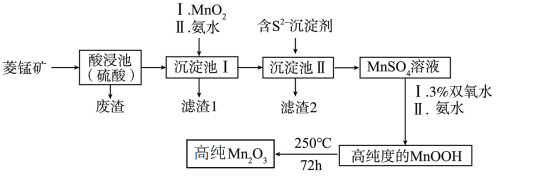
已知:25℃时,相关物质的Ksp见下表。氢氧化氧锰(MnOOH)难溶于水和碱性溶液。
回答下列问题:
(1)为了提高酸浸速率,可采取的措施为_______ (任写2条即可)。
(2)向“沉淀池I”中加入MnO2的作用是_______ ;在“沉淀池I”中,滴加氨水调节溶液的pH,使溶液中铝、铁元素完全沉淀,则理论上pH的最小值为_______ (当溶液中某离子浓度小于1.0×10-5mol·L-1时,可认为该离子沉淀完全)。
(3)“滤渣2”的主要成分是_______ (填化学式)。
(4)请写出MnSO4转化为MnOOH的离子方程式_______ 。
(5)经过滤、洗涤、干燥等步骤可得高纯MnOOH。其中洗涤的具体操作为_______ 。
(6)甲苯(用C7H8表示)是一种挥发性的大气污染物。Mn2O3可用作甲苯热催化氧化消除技术的催化剂。其装置及反应机理如图所示,下列说法中错误的是_______。


已知:25℃时,相关物质的Ksp见下表。氢氧化氧锰(MnOOH)难溶于水和碱性溶液。
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Co(OH)2 |
| Ksp | 1×10-16.3 | 1×10-38.6 | 1×10-32.3 | 1×10-12.7 | 1.09×10-15 |
(1)为了提高酸浸速率,可采取的措施为
(2)向“沉淀池I”中加入MnO2的作用是
(3)“滤渣2”的主要成分是
(4)请写出MnSO4转化为MnOOH的离子方程式
(5)经过滤、洗涤、干燥等步骤可得高纯MnOOH。其中洗涤的具体操作为
(6)甲苯(用C7H8表示)是一种挥发性的大气污染物。Mn2O3可用作甲苯热催化氧化消除技术的催化剂。其装置及反应机理如图所示,下列说法中错误的是_______。

| A.反应Ⅱ的方程式为C7H8+36MnO2=7CO2+4H2O+18Mn2O3 |
| B.反应Ⅰ中Mn元素的化合价升高 |
| C.反应Ⅱ中O-H键的形成会吸收能量 |
| D.Mn2O3作催化剂可降低总反应C7H8(g)+9O2(g)=7CO2(g)+4H2O(g)的焓变 |
您最近半年使用:0次
2023-01-12更新
|
163次组卷
|
2卷引用:湖北省恩施土家族苗族自治州2022-2023学年高三上学期期末考试化学试题
7 . 下列变化中,化学反应速率增大对人类更有益的是
| A.塑料的老化 | B.金属的腐蚀 |
| C.用较浓的白醋除水垢 | D.食物的腐败 |
您最近半年使用:0次
2023-01-05更新
|
183次组卷
|
3卷引用:四川省成都市蓉城高中联盟2022-2023学年高二上学期期末考试化学试题
名校
8 . 下列事实或做法与化学反应速率无关的是
| A.灌制香肠时,添加红曲红 | B.餐后立即喝水不利于健康 |
| C.常用冰箱保存食物 | D.食品加工时,往往添加抗氧化剂 |
您最近半年使用:0次
2022-12-05更新
|
288次组卷
|
3卷引用:陕西省汉中市2021-2022学年高二上学期期末校际联考化学试题
12-13高二下·河北衡水·期末
名校
9 . 下列过程中,化学反应速率减小对人类无益的是
| A.金属的腐蚀 | B.食物的腐败 | C.塑料的老化 | D.氨的合成 |
您最近半年使用:0次
2022-10-16更新
|
699次组卷
|
24卷引用:2012-2013学年河北省衡水市第十四中学高二下学期期末考试化学试卷
(已下线)2012-2013学年河北省衡水市第十四中学高二下学期期末考试化学试卷北京师范大学珠海分校附属外国语学校2019-2020学年高一下学期期末考试化学试题北京市丰台区2022-2023学年高二上学期期末考试化学试题河南省项城三高2017-2018学年高一下学期第二次段考(B卷)化学试题(已下线)2018年9月3日 《每日一题》人教必修4-对化学反应速率的理解【校级联考】福建省闽侯二中五校教学联合体2017-2018学年高二上学期期中考试化学试题云南省玉溪市江川区第二中学2018-2019学年高一下学期开学考试化学试题吉林省吉林市第三中学2018-2019学年高一5月阶段测试化学试题吉林省辽源市田家炳高级中学2019-2020学年高二上学期期中考试化学试题辽宁省大连市普兰店第三十八中学2020-2021学年高二上学期第二次考试化学试题(人教版2019)必修第二册 第六章 化学反应与能量 第二节 化学反应的速率与限度甘肃省白银市靖远县第四中学2020-2021学年高一下学期期中考试化学(文)试题黑龙江省鹤岗市第一中学2021-2022学年高二上学期开学考试化学试题黑龙江省佳木斯市第一中学2021-2022 学年高二上学期期中考试化学试题人教2019版选择性必修一第二章 第一节 化学反应速率 课后习题北京市丰台区2021-2022学年高二上学期期中练习化学(B)试题北京市中国农业大学附属中学2021-2022学年高二上学期期中学业水平调研化学试题黑龙江省哈尔滨市第三中学2022-2023学年高二上学期第二次验收化学试题河南省濮阳市元龙高级中学2021-2022学年高二下学期第一次质量检测化学试题北京市顺义区杨镇第一中学2022-2023学年高二上学期期中检测化学试题天津市南开大学附属中学2022-2023学年高二上学期期中阶段检测化学试题黑龙江省虎林市高级中学2022-2023学年高二上学期期中考试化学试题辽宁省辽东南协作校2023-2024学年高二上学期10月月考化学试题四川省自贡市第一中学校2023-2024学年高二上学期12月月考化学试题
名校
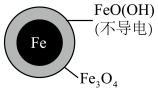
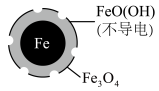
10 . 在pH=4.5时,利用原电池原理,用铁粉将废水中 无害化处理的实验如下表:
无害化处理的实验如下表:
下列说法正确的是
 无害化处理的实验如下表:
无害化处理的实验如下表:| 方案一 | 方案二 | |
| 初始条件 | pH=4.5 | pH=4.5,Fe2+ |
 去除率 去除率 | <50% | 接近100% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 |
|
|
A.该电池中Fe作负极,可被 完全氧化 完全氧化 |
B.正极的电极反应为: |
C.方案二的 去除率高,原因可能是Fe2+破坏了FeO(OH)层 去除率高,原因可能是Fe2+破坏了FeO(OH)层 |
D.改变铁粉粒径大小, 的去除速率不变 的去除速率不变 |
您最近半年使用:0次
2022-07-07更新
|
1461次组卷
|
6卷引用:四川省成都市2021-2022学年高二下学期摸底考试化学试题
四川省成都市2021-2022学年高二下学期摸底考试化学试题四川省成都市树德中学2022-2023学年高一下学期期末考试化学试题(已下线)第14讲 铁的单质、氧化物和氢氧化物(讲义)-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )(已下线)4.1.1 原电池的工作原理-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)河南省洛阳市宜阳县第一高级中学2022-2023学年高二上学期第五次能力达标测试化学试题四川省成都经济技术开发区实验中学校2022-2023学年高二下学期5月月考化学试题