名校
解题方法
1 . 磷灰石的主要成分是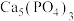 ,用磷灰石制备FePO4的流程如下:
,用磷灰石制备FePO4的流程如下:

下列说法错误的是
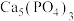 ,用磷灰石制备FePO4的流程如下:
,用磷灰石制备FePO4的流程如下:
下列说法错误的是
| A.用H3PO4溶液、H2SO4溶液分步浸取磷灰石比只用H2SO4溶液好 |
| B.用酸对磷灰石进行酸浸时,可用玻璃棒不断地搅拌使HF快速挥发 |
| C.用加热、矿石粉碎、搅拌、适当提高酸的浓度等方法来提高酸浸的效率 |
| D.加入“FeSO4,H2O2,调节pH”的过程中,加入H2O2的目的是氧化Fe2+ |
您最近一年使用:0次
2 . 三氧化二镍(Ni2O3)是一种灰黑色、无气味、有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料生产NiCl2,继而生产Ni2O3,其工艺流程如下:
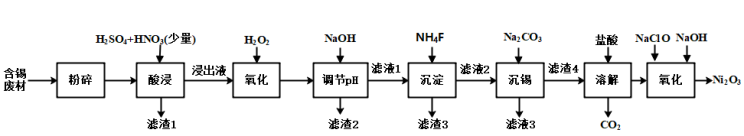
已知:①下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)。
②25℃时,Ksp(NiCO3)= 1×10-6
回答下列问题:
(1)“酸浸”过程中,l mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:_______ 。
(2)“酸浸”后的酸性溶液中加入H2O2的目的是_______ 。
(3)“沉镍”前需加NaOH控制溶液pH的范围为_______ ;“滤渣1”的主要成分有_______ 。
(4)“氧化”时生成Ni2O3的离子方程式为_______ 。
(5)保持其他条件不变,在不同温度下对含镍废料进行“酸浸”,镍的浸出率随时间变化如图。“酸浸”的最佳温度与时间分别为_______ ℃、_______ min。

(6)“沉镍”过程中,若滤液中c(Ni2+)= 2.0 mol/L,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤1×10-5mol/L],则需要加入Na2CO3固体的质量最少为_______ 。(不考虑 水解,计算结果保留两位小数)
水解,计算结果保留两位小数)

已知:①下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)。
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 3.0 | 6.7 |
| 沉淀完全的pH | 3.2 | 9.0 | 4.7 | 9.2 |
回答下列问题:
(1)“酸浸”过程中,l mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:
(2)“酸浸”后的酸性溶液中加入H2O2的目的是
(3)“沉镍”前需加NaOH控制溶液pH的范围为
(4)“氧化”时生成Ni2O3的离子方程式为
(5)保持其他条件不变,在不同温度下对含镍废料进行“酸浸”,镍的浸出率随时间变化如图。“酸浸”的最佳温度与时间分别为

(6)“沉镍”过程中,若滤液中c(Ni2+)= 2.0 mol/L,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤1×10-5mol/L],则需要加入Na2CO3固体的质量最少为
 水解,计算结果保留两位小数)
水解,计算结果保留两位小数)
您最近一年使用:0次
2022-01-22更新
|
158次组卷
|
2卷引用: 山西省太原市2021-2022学年高三上学期期末考试化学试题
名校
解题方法
3 . Burns和Dainton研究发现 与
与 合成
合成 的反应机理如下:①
的反应机理如下:① 快;②
快;② 快;③
快;③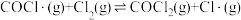 慢。其中反应②存在
慢。其中反应②存在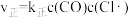 、
、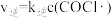 。下列说法不正确的是
。下列说法不正确的是
 与
与 合成
合成 的反应机理如下:①
的反应机理如下:① 快;②
快;② 快;③
快;③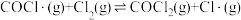 慢。其中反应②存在
慢。其中反应②存在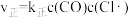 、
、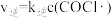 。下列说法不正确的是
。下列说法不正确的是| A.反应①的活化能小于反应③的活化能 |
B.反应②的平衡常数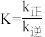 |
C.要提高合成 的速率,关键是提高反应③的速率 的速率,关键是提高反应③的速率 |
D.选择合适的催化剂能加快该反应的速率,并提高 的平衡产率 的平衡产率 |
您最近一年使用:0次
2021-12-04更新
|
287次组卷
|
2卷引用:福建省福州市福建师范大学附属中学2021-2022学年高二上学期期末考试化学试题
名校
4 . 化学与生产、生活密切相关。下列事实与化学反应速率无关的是
| A.制造蜂窝煤时加入生石灰 | B.家用铁锅、铁铲等餐具保持干燥 |
| C.工业矿石冶炼前先将矿石粉碎 | D.食品、蔬菜贮存在冰箱或冰柜里 |
您最近一年使用:0次
2021-12-03更新
|
504次组卷
|
5卷引用:湖南省岳阳市临湘市2021-2022学年高二上学期期末教学质量检测化学试题
名校
解题方法
5 . 实验室中模拟合成氨反应: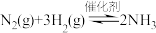 在恒容密闭容器中,初始投入量相等的条件下,得到三组实验数据如表所示:
在恒容密闭容器中,初始投入量相等的条件下,得到三组实验数据如表所示:
下列有关说法不正确的是
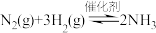 在恒容密闭容器中,初始投入量相等的条件下,得到三组实验数据如表所示:
在恒容密闭容器中,初始投入量相等的条件下,得到三组实验数据如表所示:| 实验序号 | 温度( ) ) |  浓度( 浓度( ) ) | ||||||
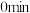 |  |  |  |  | 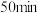 | 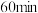 | ||
| 1 | 300 | 2.00 | 1.70 | 1.50 | 1.36 | 1.25 | 1.20 | 1.20 |
| 2 | 300 | 2.00 | 1.50 | 1.28 | 1.20 | 1.20 | 1.20 | 1.20 |
| 3 | 200 | 2.00 | 1.60 | 1.39 | 1.29 | 1.27 | 1.27 | 1.27 |
| A.当容器内的压强不再改变时,说明该可逆反应已达到化学平衡状态 |
B.实验2中,前 内以 内以 的浓度变化表示的化学反应速率为 的浓度变化表示的化学反应速率为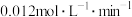 |
| C.比较实验1和2,说明实验2使用了更高效的催化剂 |
D.实验3中, 时向容器中充入一定量 时向容器中充入一定量 ,则正反应速率 ,则正反应速率 不变 不变 |
您最近一年使用:0次
2021-09-03更新
|
3953次组卷
|
12卷引用:江西省新余市第一中学2022-2023高二上学期期末考试化学试题
江西省新余市第一中学2022-2023高二上学期期末考试化学试题吉林省长春外国语学校2022-2023学年高二上学期期末考试化学试卷四川省眉山市仁寿县2023-2024学年高二上学期1月期末联考化学试题浙江省“精诚联盟”2021-2022学年高二上学期返校考试化学试题(已下线)第2章 化学反应速率与化学平衡(能力提升卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)(已下线)第二单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)章末培优2 专题2 化学反应速率与化学平衡-2021-2022学年高二化学课后培优练(苏教教版2019选择性必修1)(已下线)2022年浙江省6月高考真题变式题11-20浙江省金华市江南中学等两校2022-2023学年高二上学期12月阶段测试化学试题重庆市万州第二高级中学2022-2023学年高二上学期12月线上考试化学试题福建省泉州市第六中学2022-2023学年高二上学期期中考化学试题(已下线)【知识图鉴】单元讲练测选择性必修1第2单元03巩固练
解题方法
6 . 亚硫酸钠和碘酸钾在酸性溶液里反应的化学方程式是:Na2SO3+KIO3+H2SO4=Na2SO4+K2SO4+I2+H2O,该反应过程和机理较复杂,一般认为分为以下几步:
① +
+ →
→ +
+ (慢)
(慢)
② +
+ →IO-+
→IO-+ (快)
(快)
③5I-+6H++ →3I2+3H2O(快)
→3I2+3H2O(快)
④I2+ +H2O→2I-+
+H2O→2I-+ +2H2(快)
+2H2(快)
(1)根据上述条件推测,此反应的总的反应速率由___ 步反应决定。
(2)若预先加入淀粉溶液,由题述看必在___ 离子消耗完时,才会使淀粉变蓝的现象产生。
①
 +
+ →
→ +
+ (慢)
(慢)②
 +
+ →IO-+
→IO-+ (快)
(快)③5I-+6H++
 →3I2+3H2O(快)
→3I2+3H2O(快)④I2+
 +H2O→2I-+
+H2O→2I-+ +2H2(快)
+2H2(快)(1)根据上述条件推测,此反应的总的反应速率由
(2)若预先加入淀粉溶液,由题述看必在
您最近一年使用:0次
名校
解题方法
7 . 下列过程中需要加快反应速率的是
| A.钢铁腐蚀 | B.工业炼钢 | C.食物腐烂 | D.塑料老化 |
您最近一年使用:0次
2021-02-08更新
|
121次组卷
|
25卷引用:安徽省滁州市定远县西片三校2017-2018学年高二上学期期末考试化学试题
安徽省滁州市定远县西片三校2017-2018学年高二上学期期末考试化学试题黑龙江省伊春市第二中学2017-2018学年高一下学期期末考试(文)化学试题新疆乌鲁木齐市第二十中学2020-2021学年高二上学期期末考试化学试题(已下线)2010年新疆哈巴河县高级中学高二上学期第一次月考化学试题(已下线)2011-2012年广西北海合浦县教育局教研室高二上学期期中考试化学(理)试卷(已下线)2011-2012年山东济南外国语学校高二下学期期中考试文科化学试卷(已下线)2012-2013学年甘肃永昌一中高二上学期期中考试文科化学试卷(已下线)2013届山东省德州市某中学高三12月月考化学试卷(已下线)2012-2013学年浙江省宁海县正学中学高二下学期第一次阶段性测试化学试卷2014-2015河南省周口中英文学校高一下学期期中考试化学试卷2014-2015学年安徽省淮北师大附属实验中学高一下期中化学试卷2015-2016学年河南省三门峡市陕州中学高二上学期期中测试化学试卷2016-2017学年河北省武邑中学高二上入学考试化学试卷2016-2017学年河北省武邑中学高二上8.28周考化学卷2016-2017学年河北省武邑中学高二上9.21周考化学卷甘肃省武威第十八中学2017-2018学年高二上学期第二次月考化学试题【全国百强校】福建省厦门第一中学2017-2018学年高二下学期期中考试化学试题黑龙江省伊春市第二中学2018-2019学年高二(理)上学期期中考试化学试题湖南省邵东县创新实验学校2018-2019学年高一下学期期中考试化学试题2016-2017学年上海市闵行区七宝中学高二(上)开学化学试卷福建省福州福清市2017-2018学年高二上学期期中考试化学(理)试题吉林省辽源市田家炳高级中学校2020-2021学年高二上学期期中考试化学试题黑龙江省八校2020-2021学年高二上学期摸底考试化学试题云南省玉溪第二中学2020-2021学年高二上学期期中质量检测化学试题陕西省汉滨区五里高级中学2022-2023学年高二上学期期中考试化学试题
名校
8 . 铬合金具有高硬度、耐腐蚀特性,广泛应用于精密仪器制造,由高碳铬铁合金废料粉末制取铬的简单流程如下:
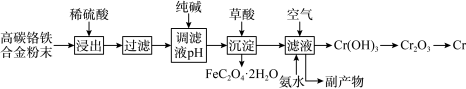
已知:Cr+H2SO4=CrSO4+H2↑。
请回答下列问题:
(1)稀硫酸酸浸过程中,提高“浸出率”的措施有_______ (写一条即可)。
(2)用纯碱调节溶液酸度,若纯碱过量,则可能导致的后果是_______ ,副产物中两种主要物质的化学式为_______ 。
(3)加入草酸发生反应的离子方程式为_______ ;利用铝热反应冶炼铬的化学方程式为_______ 。
(4)向滤液中通入空气,加入氨水后发生反应的化学方程式为_______ 。
(5)已知高碳铬铁废料中铁铬元素质量之比为14∶13,上述流程中铁元素转化为草酸亚铁的利用率为80%。废料中提取金属铬的总转化率为95%,如果得到草酸亚铁晶体(FeC2O4∙2H2O)的质量为18.00t,则可以冶炼铬的质量为_______ t(结果保留1位小数)。

已知:Cr+H2SO4=CrSO4+H2↑。
请回答下列问题:
(1)稀硫酸酸浸过程中,提高“浸出率”的措施有
(2)用纯碱调节溶液酸度,若纯碱过量,则可能导致的后果是
(3)加入草酸发生反应的离子方程式为
(4)向滤液中通入空气,加入氨水后发生反应的化学方程式为
(5)已知高碳铬铁废料中铁铬元素质量之比为14∶13,上述流程中铁元素转化为草酸亚铁的利用率为80%。废料中提取金属铬的总转化率为95%,如果得到草酸亚铁晶体(FeC2O4∙2H2O)的质量为18.00t,则可以冶炼铬的质量为
您最近一年使用:0次
解题方法
9 . 某研究性学习小组向一定量的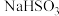 溶液(加入少量淀粉)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝。为进一步研究有关因素对反应速率的影响,探究如下:
溶液(加入少量淀粉)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝。为进一步研究有关因素对反应速率的影响,探究如下:
(1)查阅资料知: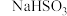 与过量KIO3反应分为两步进行,第一步反应的离子方程式为
与过量KIO3反应分为两步进行,第一步反应的离子方程式为 ,则第二步反应的离子方程式为
,则第二步反应的离子方程式为_______ ;分两步进行的反应,其反应速率主要由慢反应决定,所以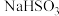 与过量KIO3反应中,慢反应是
与过量KIO3反应中,慢反应是_______ (填“第一步”或“第二步”)反应。
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响记录如表:
实验①②是探究_______ 对反应速率的影响,表中t1_______ (填“>”、“=”或“<”)t2;实验②③是探究温度对反应速率的影响,表中a=_______ ,b=_______ 。
(3)将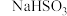 溶液与KIO3溶液在恒温条件下混合用速率检测仪检测出起始阶段反应速率逐渐增大。该小组对其原因提出假设,认为是生成的
溶液与KIO3溶液在恒温条件下混合用速率检测仪检测出起始阶段反应速率逐渐增大。该小组对其原因提出假设,认为是生成的 对反应起催化作用,故设计实验验证,试完成表中的内容。
对反应起催化作用,故设计实验验证,试完成表中的内容。
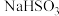 溶液(加入少量淀粉)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝。为进一步研究有关因素对反应速率的影响,探究如下:
溶液(加入少量淀粉)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝。为进一步研究有关因素对反应速率的影响,探究如下:(1)查阅资料知:
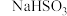 与过量KIO3反应分为两步进行,第一步反应的离子方程式为
与过量KIO3反应分为两步进行,第一步反应的离子方程式为 ,则第二步反应的离子方程式为
,则第二步反应的离子方程式为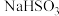 与过量KIO3反应中,慢反应是
与过量KIO3反应中,慢反应是(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响记录如表:
| 编号 | 0.01mol·L-1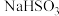 溶液/mL 溶液/mL | 0.01mol·L-1KIO3溶液/mL | H2O/mL | 反应温度/℃ | 液变蓝所用时间t/s |
| ① | 4.0 | 14.0 | 2.0 | 15 | t1 |
| ② | 6.0 | 14.0 | 0 | 15 | t2 |
| ③ | 6.0 | a | b | 25 | t3 |
(3)将
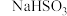 溶液与KIO3溶液在恒温条件下混合用速率检测仪检测出起始阶段反应速率逐渐增大。该小组对其原因提出假设,认为是生成的
溶液与KIO3溶液在恒温条件下混合用速率检测仪检测出起始阶段反应速率逐渐增大。该小组对其原因提出假设,认为是生成的 对反应起催化作用,故设计实验验证,试完成表中的内容。
对反应起催化作用,故设计实验验证,试完成表中的内容。| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
Ⅰ.在烧杯甲中将一定量的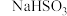 溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲) 溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲)Ⅱ.在烧杯乙中先加入少量 | 若v(甲) 若以(甲) |
您最近一年使用:0次
10 . 硫代硫酸钠与稀硫酸发生反应: (未配平)。在4只小烧杯中分别加入
(未配平)。在4只小烧杯中分别加入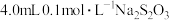 溶液与
溶液与 的稀硫酸。改变下表所示的条件:
的稀硫酸。改变下表所示的条件:
下列说法不正确的是
 (未配平)。在4只小烧杯中分别加入
(未配平)。在4只小烧杯中分别加入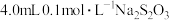 溶液与
溶液与 的稀硫酸。改变下表所示的条件:
的稀硫酸。改变下表所示的条件:| 小烧杯编号 | 小烧杯中新加入的物质 | 温度/℃ |
| i | 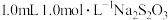 溶液 溶液 | 20 |
| ii | 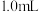 蒸馏水 蒸馏水 | 20 |
| iii | 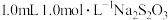 溶液 溶液 | 50 |
| iv | 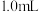 蒸馏水 蒸馏水 | 50 |
| A.i与ii对比可探究浓度对反应速率的影响 |
| B.i与iii对比可探究温度对反应速率的影响 |
C.生成沉淀的速率大小: |
| D.增大浓度、升高温度,反应速率增大 |
您最近一年使用:0次



