名校
解题方法
1 . 工业合成氨对粮食增产、增加人口具重要价值。1913年,Haber-Bosch发明的催化合成氨技术实现了工业化生产:N2(g)+3H2(g)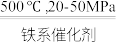 2NH3(g),298K时反应相关数据如表所示:
2NH3(g),298K时反应相关数据如表所示:
已知:化学反应吉布斯自由能变化量ΔG=ΔH -TΔS (通常温度区间,ΔH和ΔS可视为常量),ΔG与压力平衡常数Kp的关系为:lgKp = 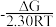 ,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。
,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。
(1)298K时,合成氨反应______ (选填“能”或“不能”)自发进行,理由是___________ 。
(2)实验研究表明,特定条件下,合成氨反应的速率与参与反应的物质浓度的关系式为: ν=kc(N2)·c1.5(H2)·c-1(NH3),下列措施不能提高反应速率的是______ 。
A.适度增加氮气的浓度 B.适度增加氢气的浓度
C.及时将产物氨气分离出反应体系 D.适度提高反应温度
E.在低压下进行反应 F.加入铁催化剂
(3)T℃下,设反应N2(g)+3H2(g) 2NH3(g)的平衡常数为K,反应NH3(g)
2NH3(g)的平衡常数为K,反应NH3(g)
 N2(g)+
N2(g)+  H2(g)的平衡常数为
H2(g)的平衡常数为 ,则K与
,则K与 之间的关系是
之间的关系是________ 。298K时,合成氨反应的压力平衡常数Kp(298K )=______ (保留2位有效数字);向一恒定温度的刚性密闭容器中充入物质的量之比为1:1的N2和H2混合气体,初始压强为30MPa,在不同催化剂作用下反应,相同时间内H2的转化率随温度的变化如图所示,b点v正_____ v逆(填“>”、“<”或“=”)。图中a点混合气体平均相对分子质量为18.75,a点对应温度(T4)下反应的平衡常数Kp=______ (保留两位有效数字,Kp为以分压表示的平衡常数,分压=总压 物质的量分数),由此知T4
物质的量分数),由此知T4______ 298K,(选填“>”、“<”或“=”)。

(4)格哈德·埃特尔证实氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

下列关于合成氨反应的叙述中错误的是________。
(5)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前要经过铜氨溶液处理以除去 CO,反应为:[Cu(NH3)2]2++CO+NH3 [Cu(NH3)3CO]2+ ΔH<0。
[Cu(NH3)3CO]2+ ΔH<0。
①铜氨溶液吸收CO的适宜生产条件是_________ 。
②吸收CO后的铜氨溶液经过适当处理再生,恢复其吸收 CO的能力,可循环使用,铜氨溶液再生的适宜条件是_________ 。
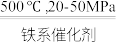 2NH3(g),298K时反应相关数据如表所示:
2NH3(g),298K时反应相关数据如表所示:| ΔH(kJ·mol-1) | -92.2 |
| ΔS(J·K-1·mol-1) | -198.2 |
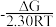 ,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。
,Kp为压力平衡常数;R为气体摩尔常数8.314 J·K-1· mol-1;T为热力学温度,单位:K。(1)298K时,合成氨反应
(2)实验研究表明,特定条件下,合成氨反应的速率与参与反应的物质浓度的关系式为: ν=kc(N2)·c1.5(H2)·c-1(NH3),下列措施不能提高反应速率的是
A.适度增加氮气的浓度 B.适度增加氢气的浓度
C.及时将产物氨气分离出反应体系 D.适度提高反应温度
E.在低压下进行反应 F.加入铁催化剂
(3)T℃下,设反应N2(g)+3H2(g)
 2NH3(g)的平衡常数为K,反应NH3(g)
2NH3(g)的平衡常数为K,反应NH3(g)
 N2(g)+
N2(g)+  H2(g)的平衡常数为
H2(g)的平衡常数为 ,则K与
,则K与 之间的关系是
之间的关系是 物质的量分数),由此知T4
物质的量分数),由此知T4
(4)格哈德·埃特尔证实氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:

下列关于合成氨反应的叙述中错误的是________。
| A.过程表明在化学反应中存在化学键的断裂与形成 |
| B.催化剂能改变化学反应的历程,使反应物化学键更易断裂,活化分子百分比增多 |
| C.过程①③④会放出能量,过程②需吸收能量 |
| D.常温下该反应难以进行,是因为常温下生成物的化学键难以形成 |
(5)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前要经过铜氨溶液处理以除去 CO,反应为:[Cu(NH3)2]2++CO+NH3
 [Cu(NH3)3CO]2+ ΔH<0。
[Cu(NH3)3CO]2+ ΔH<0。①铜氨溶液吸收CO的适宜生产条件是
②吸收CO后的铜氨溶液经过适当处理再生,恢复其吸收 CO的能力,可循环使用,铜氨溶液再生的适宜条件是
您最近半年使用:0次
2 . 在下列过程中,需要加快化学反应速率的是
| A.钢铁腐蚀 | B.工业合成氨 | C.牛奶变质 | D.塑料用品老化 |
您最近半年使用:0次
名校
3 . 下列过程中,化学反应速率的增大对人类有益的是
| A.金属的腐蚀 | B.食物的腐败 | C.塑料的老化 | D.氨的合成 |
您最近半年使用:0次
2023-04-10更新
|
834次组卷
|
17卷引用:上海市育才中学2022-2023学年高二下学期(等级考)期中调研化学试题
上海市育才中学2022-2023学年高二下学期(等级考)期中调研化学试题浙江省宁波效实中学2022-2023学年高一下学期期中考试化学(选考班)试题黑龙江省实验中学2022-2023学年高一下学期期中考试化学(学考)试题新疆喀什地区巴楚县2023-2024学年高二上学期10月期中考试化学试题甘肃省兰州市教育局第四片区联考2023-2024学年高二上学期期中考试化学试题广西南宁市西乡塘区南宁高新技术产业开发区桂鼎学校2022-2023学年高二上学期11月期中化学试题北京市通州区2023-2024学年高二上学期期中考试化学试题陕西省西安市阎良区关山中学2023-2024学年高二上学期期中考试化学试题湖南省邵阳市绥宁县第一中2022-2023学年高一下学期期中考试化学试题吉林省吉林市普通高中友好学校2022-2023学年高二上学期期末考试化学试题四川省广安市岳池县第一中学2022-2023学年高一下学期第二次月考化学试题陕西省西安市鄠邑区2022-2023学年高一下学期6月期末考试化学试题北京市第一六一中学2023-2024学年高二上学期10月月考化学试题湖南省岳阳市岳阳楼区2022-2023学年高一下学期期末考试化学试题黑龙江省哈尔滨师范大学附属中学2023-2024学年高二上学期期末考试化学试题黑龙江省哈尔滨师范大学附属中学2023-2024学年高二上学期期末考试 化学试卷内蒙古呼伦贝尔市满洲里远方中学2023-2024学年高二上学期期末考试化学试题
名校
解题方法
4 . 利用下列实验装置进行的实验或操作不能达到相应目的是
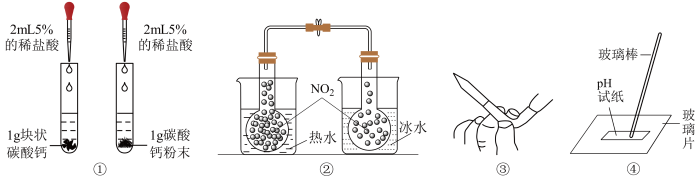

| A.①探究反应物的接触面积对反应速率的影响 |
| B.②探究温度对平衡的影响 |
| C.③除去碱式滴定管中的气泡 |
| D.④测漂白精溶液的pH |
您最近半年使用:0次
2023-02-02更新
|
195次组卷
|
2卷引用:四川省成都石室中学2022—2023学年高二上学期期中考试化学试题
5 . 下列变化中,化学反应速率增大对人类更有益的是
| A.塑料的老化 | B.金属的腐蚀 |
| C.用较浓的白醋除水垢 | D.食物的腐败 |
您最近半年使用:0次
2023-01-05更新
|
183次组卷
|
3卷引用:陕西省西安市鄠邑区2022-2023学年高一下学期期中考试化学试题
6 . 钛和钛合金被认为是21世纪的重要金属材料,广泛用于火箭、飞机制造业等。如图是工业上利用钛铁矿,其主要成分为钛酸亚铁(FeTiO3)制备金属钛的工艺流程。
资料:Ti为固体,化学性质稳定,不溶于稀硫酸、稀盐酸等。
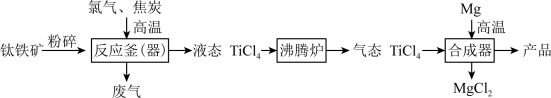
(1)钛酸亚铁(FeTiO3)中钛元素的化合价是___________ 。
(2)钛铁矿在投入反应釜前要先粉碎,其目的是___________ ;反应釜中发生的反应是: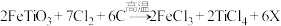 ,X为反应产生的废气,其化学式是
,X为反应产生的废气,其化学式是___________ 。
(3)反应釜中得到TiCl4和FeCl3的混合物在沸腾炉中分离,这是利用了TiCl4与FeCl3的___________ 不同。
(4)写出合成器中反应的化学方程式___________ 。
(5)利用上述方法制取的金属钛中可能会含有少量杂质,该杂质是金属___________ ,由金属钛的性质可知,除去这种杂质可以用___________ (填试剂名称)。
(6)依据“绿色低碳”理念,你认为该流程中存在的不足之处是___________ 。
资料:Ti为固体,化学性质稳定,不溶于稀硫酸、稀盐酸等。

(1)钛酸亚铁(FeTiO3)中钛元素的化合价是
(2)钛铁矿在投入反应釜前要先粉碎,其目的是
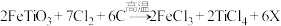 ,X为反应产生的废气,其化学式是
,X为反应产生的废气,其化学式是(3)反应釜中得到TiCl4和FeCl3的混合物在沸腾炉中分离,这是利用了TiCl4与FeCl3的
(4)写出合成器中反应的化学方程式
(5)利用上述方法制取的金属钛中可能会含有少量杂质,该杂质是金属
(6)依据“绿色低碳”理念,你认为该流程中存在的不足之处是
您最近半年使用:0次
名校
解题方法
7 . 黄铁矿的主要成分是FeS2,其中含有一定量的铜、钴等金属。某工厂在传统回收工艺的基础上进一步改进焙烧方式,研究出高效利用硫铁矿资源的工艺如下:
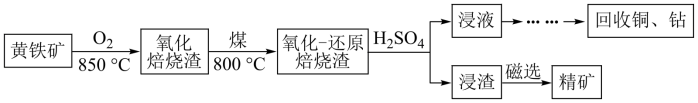
(1)黄铁矿焙烧之前需要粉碎,其目的是:_______
(2)①黄铁矿的氧化焙烧是制硫酸工艺的重要一步,其产物之一是 ,反应的化学方程式为:
,反应的化学方程式为:_______ ;
②制硫酸工艺中涉及反应2SO2+O2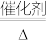 2SO3 ΔH<0,该反应需将温度控制在400-500℃,温度不宜过低的原因是
2SO3 ΔH<0,该反应需将温度控制在400-500℃,温度不宜过低的原因是_______ 。
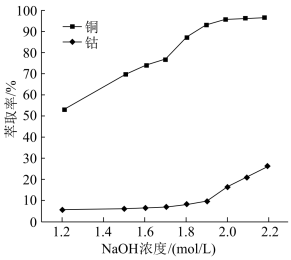
(3)用硫酸浸取后的浸渣能用磁选法分离,则该氧化物为_______ (填化学式);浸液通过加入萃取剂可实现铜和钴的分离,在萃取前加入NaOH溶液乳化可提高分离效率,不同浓度的溶液对萃取率的影响如图,则NaOH溶液最佳的浓度为_______ 。
已知黄铁矿氧化焙烧前后主要元素质量分数如表,为测定铜的浸出率,取50 g焙烧后的烧渣,经处理后测得Cu2+物质的量为5×10-3 mol,则铜离子的浸出率为_______ (结果保留三位有效数字)。

(1)黄铁矿焙烧之前需要粉碎,其目的是:
(2)①黄铁矿的氧化焙烧是制硫酸工艺的重要一步,其产物之一是
 ,反应的化学方程式为:
,反应的化学方程式为:②制硫酸工艺中涉及反应2SO2+O2
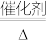 2SO3 ΔH<0,该反应需将温度控制在400-500℃,温度不宜过低的原因是
2SO3 ΔH<0,该反应需将温度控制在400-500℃,温度不宜过低的原因是(3)用硫酸浸取后的浸渣能用磁选法分离,则该氧化物为

已知黄铁矿氧化焙烧前后主要元素质量分数如表,为测定铜的浸出率,取50 g焙烧后的烧渣,经处理后测得Cu2+物质的量为5×10-3 mol,则铜离子的浸出率为
| 项目 | Fe | S | Cu | Co |
| 焙烧前(%) | 40.28 | 42.55 | 0.53 | 0.022 |
| 焙烧后(%) | 53.08 | 0.96 | 0.76 | 0.047 |
您最近半年使用:0次
名校
8 . 少量的Zn与过量的稀硫酸反应制取氢气,一定温度下能加快反应速率又不影响氢气的量,可向其中加入少量的
| A.CuSO4晶体 | B.CH3COONa固体 | C.NaHSO4晶体 | D.Na2SO4溶液 |
您最近半年使用:0次
名校
9 . 下列过程中,化学反应速率减小对人类无益的是
| A.金属的腐蚀 | B.食物的腐败 | C.塑料的老化 | D.氨的合成 |
您最近半年使用:0次
2022-10-16更新
|
700次组卷
|
24卷引用:河南省项城三高2017-2018学年高一下学期第二次段考(B卷)化学试题
河南省项城三高2017-2018学年高一下学期第二次段考(B卷)化学试题【校级联考】福建省闽侯二中五校教学联合体2017-2018学年高二上学期期中考试化学试题吉林省吉林市第三中学2018-2019学年高一5月阶段测试化学试题吉林省辽源市田家炳高级中学2019-2020学年高二上学期期中考试化学试题甘肃省白银市靖远县第四中学2020-2021学年高一下学期期中考试化学(文)试题黑龙江省佳木斯市第一中学2021-2022 学年高二上学期期中考试化学试题北京市丰台区2021-2022学年高二上学期期中练习化学(B)试题北京市中国农业大学附属中学2021-2022学年高二上学期期中学业水平调研化学试题北京市顺义区杨镇第一中学2022-2023学年高二上学期期中检测化学试题天津市南开大学附属中学2022-2023学年高二上学期期中阶段检测化学试题黑龙江省虎林市高级中学2022-2023学年高二上学期期中考试化学试题(已下线)2012-2013学年河北省衡水市第十四中学高二下学期期末考试化学试卷(已下线)2018年9月3日 《每日一题》人教必修4-对化学反应速率的理解云南省玉溪市江川区第二中学2018-2019学年高一下学期开学考试化学试题北京师范大学珠海分校附属外国语学校2019-2020学年高一下学期期末考试化学试题辽宁省大连市普兰店第三十八中学2020-2021学年高二上学期第二次考试化学试题(人教版2019)必修第二册 第六章 化学反应与能量 第二节 化学反应的速率与限度黑龙江省鹤岗市第一中学2021-2022学年高二上学期开学考试化学试题人教2019版选择性必修一第二章 第一节 化学反应速率 课后习题黑龙江省哈尔滨市第三中学2022-2023学年高二上学期第二次验收化学试题河南省濮阳市元龙高级中学2021-2022学年高二下学期第一次质量检测化学试题北京市丰台区2022-2023学年高二上学期期末考试化学试题辽宁省辽东南协作校2023-2024学年高二上学期10月月考化学试题四川省自贡市第一中学校2023-2024学年高二上学期12月月考化学试题
名校
10 . 鱼浮灵是一种化学增氧剂,主要成分为过氧碳酸钠(2Na2CO3·3H2O2),分别在等体积双氧水中加入少量Na2CO3、NaCl和NaOH固体探究鱼浮灵增氧原理,实验结果如图所示。下列说法不正确 的是
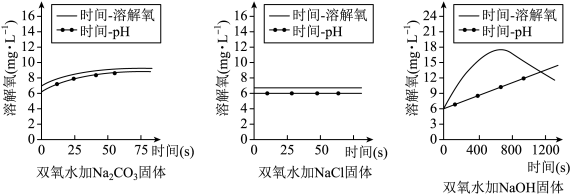

| A.Na2CO3对H2O2的分解有促进作用 | B.加入NaCl后溶液溶解氧变化不明显 |
| C.H2O2分解随pH增大而持续加快 | D.鱼浮灵使用时应根据pH控制投放量 |
您最近半年使用:0次
2022-06-22更新
|
290次组卷
|
5卷引用:浙江省宁波效实中学2021-2022学年高一下学期期中考试化学(选考)试题



