某兴趣小组为探究外界条件对化学反应速率的影响,设计的实验方案如下:
(1)实验时发生反应的化学方程式为___ ;为了顺利观察到KMnO4紫色褪去,起始时需要满足n(H2C2O4):n(KMnO4)≥___ 。
(2)探究反应物浓度对反应速率影响的是实验___ (填编号,下同),探究反应温度对反应速率影响的是实验___ 。
(3)测得实验①中溶液褪色的时间为30s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=___ 。
(4)实验过程中发现:在开始反应的一段时间内,反应速率较小,溶液褪色不明显;但不久反应速率明显增大,溶液很快褪色。导致上述现象的原因可能是___ 。
(5)草酸又称乙二酸,是一种二元弱酸。写出草酸在水中的第一步电离方程式:___ ,该步电离的平衡常数表达式K1=___ 。
| 实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/(mol•L-1) | 体积/mL | 浓度/(mol•L-1) | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.01 | 3.0 | 25 |
| ② | 0.20 | 2.0 | 0.01 | 3.0 | 25 |
| ③ | 0.20 | 2.0 | 0.01 | 3.0 | 50 |
(1)实验时发生反应的化学方程式为
(2)探究反应物浓度对反应速率影响的是实验
(3)测得实验①中溶液褪色的时间为30s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=
(4)实验过程中发现:在开始反应的一段时间内,反应速率较小,溶液褪色不明显;但不久反应速率明显增大,溶液很快褪色。导致上述现象的原因可能是
(5)草酸又称乙二酸,是一种二元弱酸。写出草酸在水中的第一步电离方程式:
更新时间:2020-11-25 16:18:27
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】氨气广泛应用于化肥、制药、合成纤维等领域。工业上可由氢气和氮气合成氨气。若用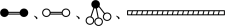 分别表示
分别表示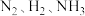 和固体催化剂,则在固体催化剂表面合成氨的过程如下图所示:
和固体催化剂,则在固体催化剂表面合成氨的过程如下图所示:

(1)吸附后,能量状态最高的是
(2)结合上述过程,一定温度下在固体催化剂表面进行
 的分解实验,发现
的分解实验,发现 的分解速率与其浓度的关系如下图所示。从吸附和解吸过程分析。
的分解速率与其浓度的关系如下图所示。从吸附和解吸过程分析。
①
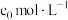 前反应速率增加的原因可能是
前反应速率增加的原因可能是②
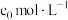 之后反应速率降低的原因可能是
之后反应速率降低的原因可能是(3)催化剂
 中的
中的 是活性组分。在反应器中以一定流速通过混合气
是活性组分。在反应器中以一定流速通过混合气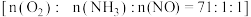 ,在不同温度下进行该催化反应,
,在不同温度下进行该催化反应, 的质量分数对单位时间内NO去除率的影响如下图所示。
的质量分数对单位时间内NO去除率的影响如下图所示。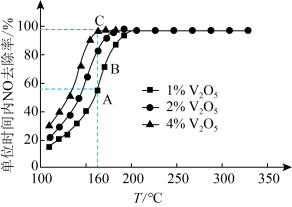
①从起始至对应A、B、C三点的平均反应速率由小到大的顺序为
② 的质量分数对该催化剂活性的影响是
的质量分数对该催化剂活性的影响是
(4)一定温度下,向1 L恒容密闭容器(含催化剂)中投入1 mol
 和1.5 mol NO,发生反应
和1.5 mol NO,发生反应 。达到平衡状态时,NO的转化率为60%,则平衡常数为
。达到平衡状态时,NO的转化率为60%,则平衡常数为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
I.测定化学反应速率,该同学利用如图装置测定化学反应速率。

(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是_______ ;
(2)该反应有黄色固体生成,并且伴有刺激性,能使品红溶液褪色的气体生成。请写出该反应的离子方程式:____ 。
(3)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是__ 。
II.为探讨化学反应速率的影响因素,设计的实验方案如下表。(已知2Na2S2O3+I2=Na2S4O6+2NaI,其中Na2S2O3溶液均足量)
表中Vx=_______ mL,比较t1、t2、t3大小,试推测该实验结论:_______
III.氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.1000mol/L的酸性KMnO4溶液进行滴定,离子方程式:2 +5
+5 +H+=2Mn2++5
+H+=2Mn2++5 +3H2O;回答下列问题:
+3H2O;回答下列问题:
(1)用KMnO4进行滴定时,判断滴定终点的现象是_______ 。
(2)下列操作会导致测定结果偏低的是_______ 。
A. 酸式滴定管水洗后未用待测液润洗
B. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C. 滴定管尖嘴部分有气泡,滴定后消失
D. 观察读数时,滴定前仰视,滴定后俯视
(3)根据下表中测定的实验数据,计算NaHSO3溶液的物质的量浓度(写出计算过程,结果保留4位有效数字)_________ 。
I.测定化学反应速率,该同学利用如图装置测定化学反应速率。

(1)为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是
(2)该反应有黄色固体生成,并且伴有刺激性,能使品红溶液褪色的气体生成。请写出该反应的离子方程式:
(3)若在2min时收集到224mL(已折算成标准状况)气体,可计算出该2min内H+的反应速率,而该测定值比实际值偏小,其原因是
II.为探讨化学反应速率的影响因素,设计的实验方案如下表。(已知2Na2S2O3+I2=Na2S4O6+2NaI,其中Na2S2O3溶液均足量)
| 实验 序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
III.氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.1000mol/L的酸性KMnO4溶液进行滴定,离子方程式:2
 +5
+5 +H+=2Mn2++5
+H+=2Mn2++5 +3H2O;回答下列问题:
+3H2O;回答下列问题:(1)用KMnO4进行滴定时,判断滴定终点的现象是
(2)下列操作会导致测定结果偏低的是
A. 酸式滴定管水洗后未用待测液润洗
B. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C. 滴定管尖嘴部分有气泡,滴定后消失
D. 观察读数时,滴定前仰视,滴定后俯视
(3)根据下表中测定的实验数据,计算NaHSO3溶液的物质的量浓度(写出计算过程,结果保留4位有效数字)
| 实验编号 | 待测NaHSO3溶液的体积/mL | KMnO4溶液的体积/mL |
| 1 | 20.00 | 15.98 |
| 2 | 20.00 | 17.00 |
| 3 | 20.00 | 16.02 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】已知将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。若再加入双氧水,将发生反应H2O2+2H++2I-=2H2O+I2,且生成I2立即与试剂X反应而被消耗。一段时间后,试剂X将被反应生成的I2完全消耗。由于溶液中I-继续被H2O2氧化,生成I2与淀粉作用,溶液立即变蓝。因此,根据试剂X的量、滴入双氧水至溶液变蓝所需时间,即可推算反应H2O2+2H++2I-=2H2O+I2的反应速率。下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
回答下列问题:
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I-=2H2O+I2反应速率的影响。实验2中m=_______ 。
(2)一定温度下,H2O2+2H++2I-=2H2O+I2,反应速率可以表示为:v=k·ca(H2O2)·cb(I-)·c(H+) (k为反应速率常数),则:
①实验4烧杯中溶液开始变蓝的时间t=_______ min。
②根据上表数据可知,b =_______ 。
(3)已知I2与X反应时,两者物质的量之比为1∶2。按上面表格中的X和KI的加入量,加入V(H2O2)>_______ ,才确保看到蓝色。
(4)若要探究温度对H2O2+2H++2I-=2H2O+I2反应速率影响,在实验中温度不宜过高且采用水浴加热,其原因是_______ 。
| 编 号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 溶液开始变蓝时间(min) | ||||
| 0.1 mol/LKI溶液 | H2O | 0.01 mol/LX溶液 | 0.1 mol/L双氧水 | 0.1 mol/L稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 0 | 10.0 | 10.0 | 40.0 | 无 | t |
| 5 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I-=2H2O+I2反应速率的影响。实验2中m=
(2)一定温度下,H2O2+2H++2I-=2H2O+I2,反应速率可以表示为:v=k·ca(H2O2)·cb(I-)·c(H+) (k为反应速率常数),则:
①实验4烧杯中溶液开始变蓝的时间t=
②根据上表数据可知,b =
(3)已知I2与X反应时,两者物质的量之比为1∶2。按上面表格中的X和KI的加入量,加入V(H2O2)>
(4)若要探究温度对H2O2+2H++2I-=2H2O+I2反应速率影响,在实验中温度不宜过高且采用水浴加热,其原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】某探究小组用 HNO3 与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用 HNO3 浓度为 1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为 298 K、308K,每次实验 HNO3 的用量为 25.0 mL、大理石用量为 10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
(2)实验①中 CO2 质量随时间变化的关系见下图:

依据反应方程式 CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O,计算实验①在 70-90 s 范围内 HNO3 的平均反应速率为_______ (忽略溶液体积变化)。
(3)请在答题卡的框图中,画出实验②和③中CO2 质量随时间变化关系的预期结果示意图_______ 。
(4)一定温度下,为了减缓反应速率,但又不影响生成 CO2 的总量,可向反应物中加入适量的_______ 。
A.CH3COONa(s) B.NaOH(s) C.K2SO4(aq) D.(NH4)2SO4(s)
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 大理石规格 | HNO3 浓度/mol·L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究 HNO3 浓度对该反应速率的影响; (Ⅱ)实验①和 (Ⅲ)实验①和 |
| ② | ||||
| ③ | 粗颗粒 | |||
| ④ |

依据反应方程式 CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O,计算实验①在 70-90 s 范围内 HNO3 的平均反应速率为
(3)请在答题卡的框图中,画出实验②和③中CO2 质量随时间变化关系的预期结果示意图
(4)一定温度下,为了减缓反应速率,但又不影响生成 CO2 的总量,可向反应物中加入适量的
A.CH3COONa(s) B.NaOH(s) C.K2SO4(aq) D.(NH4)2SO4(s)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】Ⅰ.汽车尾气中含有NO、CO等有害物质,其中NOx会引起光化学烟雾等环境问题。
NH3-SCR技术是去除NOx最为有效的技术之一:在催化剂条件下,以NH3或尿素将尾气中NOx还原为N2从而降低污染。
(1)汽车燃料中一般不含氮元素,汽缸中生成NO的原因_________________ (用化学方程式表示,该反应为为可逆反应);汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,试分析其原因 _____________________________ 。
(2)①NH3去除尾气中的NOx,当v(NO):v(NO2)=1:1时称为“快速SCR 反应”,该反应化学方程式为______________________________________ ;
②合成NH3所用原料气H2,可用天然气为原料制得,有关反应能量变化如下所示。
CO(g)+ O2(g)=CO2(g) △H1=-282.0 KJ/mol
O2(g)=CO2(g) △H1=-282.0 KJ/mol
H2(g)+ O2(g)=H2O(g) △H2=-241.8 KJ/mol
O2(g)=H2O(g) △H2=-241.8 KJ/mol
CH4(g)+2O2(g)=CO2(g)+ 2H2O(g) △H3=-836.3 KJ/mol
则用CH4(g)和H2O(g)反应制得H2(g)和CO(g)的热化学方程式为___________ 。
(3)通过NOx传感器可监测NOx的含量,其工作原理如图所示,则:
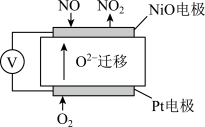
①Pt电极上发生的是______________ 反应(填“氧化”或“还原”);
②NiO电极上的电极反应式为______________________________________ ;
(4)研究发现,将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:2NO(g)+2CO(g)=N2(g)+2CO2(g)。在一定温度下,于2L的恒容密闭容器中充入0.1molNO和0.3molCO发生该反应,测得不同时间容器内的压强(p)与起始压强(p0)的比值(p/p0)如下表。
0~5min内,该反应的平均反应速率V(NO)=___________________ ;
(5)将上述反应的CO2与NH3为原料合成尿素,能够实现节能减排:①2NH3(g)+CO2(g)=NH2CO2NH4(s);②NH2CO2NH4(s) CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
对于上述反应②在密闭容器中将过量NH2CO2NH4固体于300K下分解,平衡时P[H2O(g)]为aPa,若反应温度不变,将体系的体积增加50%,至达新平衡的过程中P[H2O(g)]的取值范围是__________________ (用含a的式子表示)。
NH3-SCR技术是去除NOx最为有效的技术之一:在催化剂条件下,以NH3或尿素将尾气中NOx还原为N2从而降低污染。
(1)汽车燃料中一般不含氮元素,汽缸中生成NO的原因
(2)①NH3去除尾气中的NOx,当v(NO):v(NO2)=1:1时称为“快速SCR 反应”,该反应化学方程式为
②合成NH3所用原料气H2,可用天然气为原料制得,有关反应能量变化如下所示。
CO(g)+
 O2(g)=CO2(g) △H1=-282.0 KJ/mol
O2(g)=CO2(g) △H1=-282.0 KJ/mol H2(g)+
 O2(g)=H2O(g) △H2=-241.8 KJ/mol
O2(g)=H2O(g) △H2=-241.8 KJ/molCH4(g)+2O2(g)=CO2(g)+ 2H2O(g) △H3=-836.3 KJ/mol
则用CH4(g)和H2O(g)反应制得H2(g)和CO(g)的热化学方程式为
(3)通过NOx传感器可监测NOx的含量,其工作原理如图所示,则:

①Pt电极上发生的是
②NiO电极上的电极反应式为
(4)研究发现,将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:2NO(g)+2CO(g)=N2(g)+2CO2(g)。在一定温度下,于2L的恒容密闭容器中充入0.1molNO和0.3molCO发生该反应,测得不同时间容器内的压强(p)与起始压强(p0)的比值(p/p0)如下表。
| 时间/t | 0min | 2min | 5min | 10min | 13min | 15min |
| 比值(p/p0) | 1 | 0.97 | 0.925 | 0.90 | 0.90 | 0.90 |
0~5min内,该反应的平均反应速率V(NO)=
(5)将上述反应的CO2与NH3为原料合成尿素,能够实现节能减排:①2NH3(g)+CO2(g)=NH2CO2NH4(s);②NH2CO2NH4(s)
 CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)对于上述反应②在密闭容器中将过量NH2CO2NH4固体于300K下分解,平衡时P[H2O(g)]为aPa,若反应温度不变,将体系的体积增加50%,至达新平衡的过程中P[H2O(g)]的取值范围是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】I.某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(1)表中V1=____________ mL,V2=____________ mL。
(2)探究温度对化学反应速率影响的实验编号是____________ (填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________ 。
(3)实验①测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=____________ mol•L-1•min-1。
II.将镁带投入盛放在敞口容器中的盐酸里,产生H2的速率与时间的关系可用如图表示。
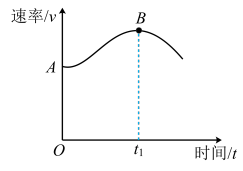
(1)解释图中AB段形成的原因____________ 。
(2)解释图中t1时刻后速率变小的原因____________ 。
| 实验编号 | 0.1mol/L酸性KMnO4溶液的体积/mL | 0.6mol/LH2C2O4溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液褪色所需时间/min |
| ① | 10 | V1 | 35 | 25 | t1 |
| ② | 10 | 10 | 30 | 25 | t2 |
| ③ | 10 | 10 | V2 | 50 | t3 |
(2)探究温度对化学反应速率影响的实验编号是
(3)实验①测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=
II.将镁带投入盛放在敞口容器中的盐酸里,产生H2的速率与时间的关系可用如图表示。

(1)解释图中AB段形成的原因
(2)解释图中t1时刻后速率变小的原因
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计如下系列实验:
①写出硫代硫酸钠与稀硫酸反应的化学方程式:___ 。
②该实验①、②可探究___ 对反应速率的影响,因此V3是___ ;实验①、③可探究___ 对反应速率的影响,因此V5是___ 。
(2)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表所示:
①该反应的化学平衡常数表达式为K=__ 。
②该反应为__ 反应(填“吸热”或“放热”)。
③某温度下,平衡浓度符合下式:c(CO2)∙c(H2)=c(CO)∙c(H2O),试判断此时的温度为__ ℃。
④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2mol/L,c(H2)=1.5mol/L,c(CO)=1mol/L,c(H2O)=3mol/L,则下一时刻,反应向___ (填“正向”或“逆向”)进行。
(3)已知常温时红磷比白磷稳定,比较下列反应中ΔH的大小:ΔH1___ ΔH2。(填“>”或“<”)。
①P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1
②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2
(4)氨气是一种重要的物质,可用于制取化肥和硝酸等。已知H-H键、N-H键、N≡N键的键能分别是436kJ∙mol-1、391kJ∙mol-1、946kJ∙mol-1。写出合成氨的热反应方程式:___ 。
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
②该实验①、②可探究
(2)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表所示:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
②该反应为
③某温度下,平衡浓度符合下式:c(CO2)∙c(H2)=c(CO)∙c(H2O),试判断此时的温度为
④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2mol/L,c(H2)=1.5mol/L,c(CO)=1mol/L,c(H2O)=3mol/L,则下一时刻,反应向
(3)已知常温时红磷比白磷稳定,比较下列反应中ΔH的大小:ΔH1
①P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1
②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2
(4)氨气是一种重要的物质,可用于制取化肥和硝酸等。已知H-H键、N-H键、N≡N键的键能分别是436kJ∙mol-1、391kJ∙mol-1、946kJ∙mol-1。写出合成氨的热反应方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某药片包装上有“把药片溶于水后饮用”的指示。该药片溶水后会出现泡腾现象,是因发生以下反应导致:C6H8O7(柠檬酸)+3NaHCO3=C6H5O7Na3(柠檬酸钠)+3H2O+3CO2↑。现有某学习小组同学利用如图所示实验装置来跟踪和测量该反应速率,室温下测定结果如下表:

(1)实验中使用棉花遮盖锥形瓶口的目的是_______ ;
(2)实验开始时,锥形瓶中的质量减少并不明显,可能的原因是_______ ;
(3)本实验_______ (填“可以”或“不宜”)设计为“测定恒容容器中产物CO2气压变化”来对,反应速率进行跟踪和测量。
(4)跟踪质量损失测速法不适用于涉及氢气生成的反应,原因是_______ ;
(5)其他条件均相同,在室温、50°C(需预测)时分别进行上述实验,在坐标系中绘制V(CO2)-t示意图(不需要描点作图)_______ 。

| 时间t/min | 0 | 1.0 | 2.0 | 3.0 | 4.0 | 5.0 | 6.0 | 7.0 | 8.0 |
| 锥形瓶及当中混合物的总质量/g | 150.0 | 148.50 | 147.50 | 146.95 | 146.60 | 146.41 | 146.33 | 146.30 | 146.30 |

(1)实验中使用棉花遮盖锥形瓶口的目的是
(2)实验开始时,锥形瓶中的质量减少并不明显,可能的原因是
(3)本实验
(4)跟踪质量损失测速法不适用于涉及氢气生成的反应,原因是
(5)其他条件均相同,在室温、50°C(需预测)时分别进行上述实验,在坐标系中绘制V(CO2)-t示意图(不需要描点作图)

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】现代社会的一切活动都离不开能源,为了更好的利用化学反应中的物质和能量变化,需要关注化学反应的快慢和程度。
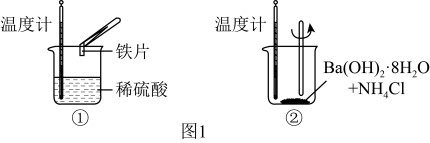
Ⅰ.化学变化过程中均存在物质变化与能量变化,某化学兴趣小组进行如图1所示实验,以验证此结论。请回答下列问题。__________ 生成物成键释放的能量(填“大于”或“小于”);反应②中,反应物的总能量__________ 生成物的总能量(填“大于”或“小于”)。
Ⅱ.某小组利用 溶液和稀硫酸的反应,通过比较反应完全所用时间长短验证不同因素对化学反应速率的影响.实验设计如表所示:
溶液和稀硫酸的反应,通过比较反应完全所用时间长短验证不同因素对化学反应速率的影响.实验设计如表所示:
(2) 和稀硫酸反应的离子方程式为
和稀硫酸反应的离子方程式为__________ 。
(3)用 溶液的浓度变化表示实验b的平均反应速率为
溶液的浓度变化表示实验b的平均反应速率为__________ (忽略混合前后溶液的体积变化)。
(4)通过对比实验a和c,验证稀 的浓度对反应速率的影响。该小组发现实验c存在不科学性,请提出对实验c的改进方案
的浓度对反应速率的影响。该小组发现实验c存在不科学性,请提出对实验c的改进方案__________ 。
Ⅲ.某同学用等质量的锌粉先后与盐酸及相同体积、未知浓度的盐酸反应,记录相关数据,并作出这两个反应过程中放出气体的体积随反应时间的变化曲线图(如图2所示)。__________  (填“>”“=”或“<”),若用
(填“>”“=”或“<”),若用 硫酸代替上述实验中的
硫酸代替上述实验中的 盐酸,二者的反应速率是否相同?理由是
盐酸,二者的反应速率是否相同?理由是__________ 。
(6)为控制反应速率,防止因反应过快而难以测量 体积,且不改变生成
体积,且不改变生成 的量,事先在盐酸中加入等体积的下列溶液以减慢反应速率。下列试剂中,不可行的是__________。
的量,事先在盐酸中加入等体积的下列溶液以减慢反应速率。下列试剂中,不可行的是__________。
Ⅰ.化学变化过程中均存在物质变化与能量变化,某化学兴趣小组进行如图1所示实验,以验证此结论。请回答下列问题。
Ⅱ.某小组利用
 溶液和稀硫酸的反应,通过比较反应完全所用时间长短验证不同因素对化学反应速率的影响.实验设计如表所示:
溶液和稀硫酸的反应,通过比较反应完全所用时间长短验证不同因素对化学反应速率的影响.实验设计如表所示:| 实验编号 | T/K |  溶液 溶液 | 稀 溶液 溶液 | 反应完全所用时间/秒 | ||
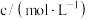 | 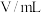 | 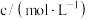 | 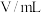 | s | ||
| a | 298 | 0.1 | 10 | 0.2 | 10 | 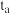 |
| b | 323 | 0.1 | 10 | 0.2 | 10 | 5 |
| c | 298 | 0.1 | 10 | 0.2 | 5 | 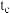 |
(2)
 和稀硫酸反应的离子方程式为
和稀硫酸反应的离子方程式为(3)用
 溶液的浓度变化表示实验b的平均反应速率为
溶液的浓度变化表示实验b的平均反应速率为(4)通过对比实验a和c,验证稀
 的浓度对反应速率的影响。该小组发现实验c存在不科学性,请提出对实验c的改进方案
的浓度对反应速率的影响。该小组发现实验c存在不科学性,请提出对实验c的改进方案Ⅲ.某同学用等质量的锌粉先后与盐酸及相同体积、未知浓度的盐酸反应,记录相关数据,并作出这两个反应过程中放出气体的体积随反应时间的变化曲线图(如图2所示)。
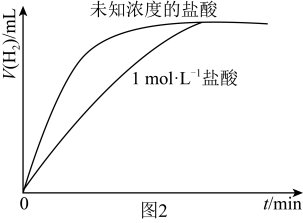
 (填“>”“=”或“<”),若用
(填“>”“=”或“<”),若用 硫酸代替上述实验中的
硫酸代替上述实验中的 盐酸,二者的反应速率是否相同?理由是
盐酸,二者的反应速率是否相同?理由是(6)为控制反应速率,防止因反应过快而难以测量
 体积,且不改变生成
体积,且不改变生成 的量,事先在盐酸中加入等体积的下列溶液以减慢反应速率。下列试剂中,不可行的是__________。
的量,事先在盐酸中加入等体积的下列溶液以减慢反应速率。下列试剂中,不可行的是__________。| A.蒸馏水 | B.KCl溶液 | C. 溶液 溶液 | D. 溶液 溶液 |
您最近一年使用:0次
【推荐1】铍是原子能、火箭、导弹、航空以及冶金工业中不可缺少的宝贵材料。以绿柱石[Be3Al2(SiO3)6]为原料制备两性金属铍的工艺如图:

回答下列问题:
(1)绿柱石写成氧化物的形式为___________ 。
(2)750℃烧结时,Na3FeF6仅与绿柱石中BeO作用生成易溶于水的Na2BeF4,滤渣的主要成分是Fe2O3和___________ 。
(3)“水浸”时“产物压碎磨细”的目的是___________ ,为检验“过滤1”的滤液中是否含有Na+,可选用的方法是___________ (填方法名称)。
(4)“沉氟”的化学方程式为___________ 。
(5)镍坩埚作阴极、石墨作阳极,350~400℃电解NaCl-BeCl2熔融混合物得到金属铍,阳极反应式为___________ ;不能用该电解槽电解熔融氯化铍制金属铍的原因可能是___________ 。

回答下列问题:
(1)绿柱石写成氧化物的形式为
(2)750℃烧结时,Na3FeF6仅与绿柱石中BeO作用生成易溶于水的Na2BeF4,滤渣的主要成分是Fe2O3和
(3)“水浸”时“产物压碎磨细”的目的是
(4)“沉氟”的化学方程式为
(5)镍坩埚作阴极、石墨作阳极,350~400℃电解NaCl-BeCl2熔融混合物得到金属铍,阳极反应式为
您最近一年使用:0次
【推荐2】三氧化二镍(Ni2O3)是一种灰黑色、无气味、有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料生产NiCl2,继而生产Ni2O3,其工艺流程如下:
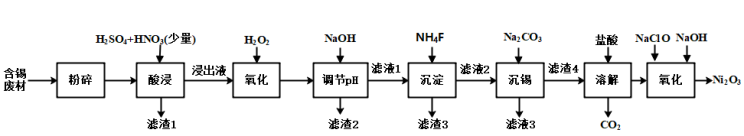
已知:①下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)。
②25℃时,Ksp(NiCO3)= 1×10-6
回答下列问题:
(1)“酸浸”过程中,l mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:_______ 。
(2)“酸浸”后的酸性溶液中加入H2O2的目的是_______ 。
(3)“沉镍”前需加NaOH控制溶液pH的范围为_______ ;“滤渣1”的主要成分有_______ 。
(4)“氧化”时生成Ni2O3的离子方程式为_______ 。
(5)保持其他条件不变,在不同温度下对含镍废料进行“酸浸”,镍的浸出率随时间变化如图。“酸浸”的最佳温度与时间分别为_______ ℃、_______ min。

(6)“沉镍”过程中,若滤液中c(Ni2+)= 2.0 mol/L,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤1×10-5mol/L],则需要加入Na2CO3固体的质量最少为_______ 。(不考虑 水解,计算结果保留两位小数)
水解,计算结果保留两位小数)

已知:①下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)。
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 3.0 | 6.7 |
| 沉淀完全的pH | 3.2 | 9.0 | 4.7 | 9.2 |
回答下列问题:
(1)“酸浸”过程中,l mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式:
(2)“酸浸”后的酸性溶液中加入H2O2的目的是
(3)“沉镍”前需加NaOH控制溶液pH的范围为
(4)“氧化”时生成Ni2O3的离子方程式为
(5)保持其他条件不变,在不同温度下对含镍废料进行“酸浸”,镍的浸出率随时间变化如图。“酸浸”的最佳温度与时间分别为

(6)“沉镍”过程中,若滤液中c(Ni2+)= 2.0 mol/L,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤1×10-5mol/L],则需要加入Na2CO3固体的质量最少为
 水解,计算结果保留两位小数)
水解,计算结果保留两位小数)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某探究小组通过比较酸性KMnO4溶液与H2C2O4溶液反应过程中,溶液紫色消失时间长短的方法,研究浓度、温度对反应速率的影响。
可供选择的实验条件:KMnO4酸性溶液的浓度可选择0.01 mol·L-1、0.1 mol·L-1,H2C2O4溶液的浓度可选择0.1 mol·L-1、0.2 mol·L-1,实验温度可选择298K、323K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液的用量均为2mL。
(1)实验设计:请完成以下实验设计表。
(2)实验记录:实验中需要记录的数据是___________________________________ 。
可供选择的实验条件:KMnO4酸性溶液的浓度可选择0.01 mol·L-1、0.1 mol·L-1,H2C2O4溶液的浓度可选择0.1 mol·L-1、0.2 mol·L-1,实验温度可选择298K、323K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液的用量均为2mL。
(1)实验设计:请完成以下实验设计表。
| 实验编号 | T/K | KMnO4浓度/mol·L-1 | H2C2O4浓度/mol·L-1 | 实验目的 |
| ① | 298 | 0.01 mol·L-1 | 0.1 mol·L-1 | 为以下实验做对照 |
| ② | ||||
| ③ | 探究浓度对反应速率的影响 |
(2)实验记录:实验中需要记录的数据是
您最近一年使用:0次



