名校
1 . 以硼镁泥(主要成分为MgSiO3、Fe2O3及少量Al2O3、FeO和MnO)为原料制备高纯Mg(OH)2的流程如下:
已知:
①常温下此体系中各氢氧化物开始沉淀与沉淀完全时的pH范围如下表所示:
②温度高于340℃时Mg(OH)2开始分解为MgO和H2O。
(1)“浸取”时,为提高镁的浸取率可行的措施为_______ 。
a.将硼镁泥制成浆料b.降低浸取温度c.用盐酸多次浸取
(2)“浸取”时,MgSiO3与盐酸反应的化学方程式为_______ 。
(3)“除铁、铝”时,需调节溶液pH范围为_______ 。
(4)“除Mn2+”时发生反应的离子方程式为_______ ;
过滤3所得滤渣中含有MnO(OH)2和_______ 。
(5)“沉镁”时,反应温度与Mg(OH)2的产率如图所示,当温度超过60℃,随温度再升高,Mg(OH)2产率反而降低,其原因可能是_______ 。


已知:
①常温下此体系中各氢氧化物开始沉淀与沉淀完全时的pH范围如下表所示:
| pH值 | Mg(OH)2 | Mn(OH)2 | MnO(OH)2 | Fe(OH)2 | Al(OH)3 | Fe(OH)3 |
| 开始沉淀时 | 9.3 | 7.1 | 7.8 | 7.6 | 3.7 | 2.3 |
| 沉淀完全时 | 10.8 | 10.8 | 9.8 | 9.6 | 4.7 | 3.7 |
(1)“浸取”时,为提高镁的浸取率可行的措施为
a.将硼镁泥制成浆料b.降低浸取温度c.用盐酸多次浸取
(2)“浸取”时,MgSiO3与盐酸反应的化学方程式为
(3)“除铁、铝”时,需调节溶液pH范围为
(4)“除Mn2+”时发生反应的离子方程式为
过滤3所得滤渣中含有MnO(OH)2和
(5)“沉镁”时,反应温度与Mg(OH)2的产率如图所示,当温度超过60℃,随温度再升高,Mg(OH)2产率反而降低,其原因可能是

您最近半年使用:0次
2017-03-22更新
|
1281次组卷
|
3卷引用:2017届江苏省苏锡常镇四市高三教学情况调研(一)化学试卷
2017届江苏省苏锡常镇四市高三教学情况调研(一)化学试卷江苏省泰州中学2018届高三10月月考化学试题(已下线)考点11 镁、铝及其重要化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
2 . 外界其他条件相同,不同pH条件下,用浓度传感器测得反应2A+B=C+D中产物D的浓度随时间变化的关系如图。则下列有关说法正确的是
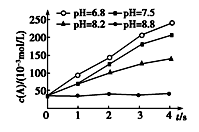

| A.pH=8.8时,升高温度,反应速率不变 |
| B.保持外界条件不变,反应一段时间后,pH越小,D的浓度越大 |
| C.为了实验取样,可以采用调节pH的方法迅速停止反应 |
| D.减小外界压强,反应速率一定减小 |
您最近半年使用:0次
2016-12-09更新
|
182次组卷
|
2卷引用:2015-2016学年河北省衡水二中高二上期中测试化学试卷
11-12高二上·广东广州·期中
3 . 某探究小组通过比较酸性KMnO4溶液与H2C2O4溶液反应过程中,溶液紫色消失时间长短的方法,研究浓度、温度对反应速率的影响。
可供选择的实验条件:KMnO4酸性溶液的浓度可选择0.01 mol·L-1、0.1 mol·L-1,H2C2O4溶液的浓度可选择0.1 mol·L-1、0.2 mol·L-1,实验温度可选择298K、323K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液的用量均为2mL。
(1)实验设计:请完成以下实验设计表。
(2)实验记录:实验中需要记录的数据是___________________________________ 。
可供选择的实验条件:KMnO4酸性溶液的浓度可选择0.01 mol·L-1、0.1 mol·L-1,H2C2O4溶液的浓度可选择0.1 mol·L-1、0.2 mol·L-1,实验温度可选择298K、323K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液的用量均为2mL。
(1)实验设计:请完成以下实验设计表。
| 实验编号 | T/K | KMnO4浓度/mol·L-1 | H2C2O4浓度/mol·L-1 | 实验目的 |
| ① | 298 | 0.01 mol·L-1 | 0.1 mol·L-1 | 为以下实验做对照 |
| ② | ||||
| ③ | 探究浓度对反应速率的影响 |
(2)实验记录:实验中需要记录的数据是
您最近半年使用:0次
2011·河南·一模
解题方法
4 . 控制变量法在化学实验探究中运用较多,它是指在研究和解决问题的过程中,对影响事物变化规律的因素或条件加以人为控制,使其中的一些条件按照特定的要求发生或不发生变化,以便在研究过程中,找到事物变化发展的规律。根据因素和条件的性质,可分为实验变量(自变量)、反应变量(因变量)和无关变量。某研究小组用酸性KMnO4溶液与H2C2O4溶液反应中溶液紫色消失的方法,来研究浓度对化学反应速率的影响。下列实验有关变量控制的操作错误的是
| A.为控制无关变量的影响,将实验温度均确定为25°C、酸性KMnO4溶液与H2C2O4溶液的体积均确定为4mL,不使用催化剂 |
| B.可选择浓度分别为0.05mol/L、0. 01mol/L、0. 001mol/L的KMnO4酸性溶液和浓度均为0.001mol/L的H2C2O4溶液反应,来操纵实验变量,进行对照实验 |
| C.可将单位时间内反应所生成的CO2体积作为实验变量(自变量)进行本实验研究 |
| D.该实验研究中的反应变量(因变量)是溶液紫色褪去所消耗的时间 |
您最近半年使用:0次



