目前,常利用催化技术将汽车尾气中的 和
和 转化成
转化成 和
和 。为研究如何增大该化学反应的速率,某课题组进行了以下实验探究。
。为研究如何增大该化学反应的速率,某课题组进行了以下实验探究。
【提出问题】在其他条件不变的情况下,温度或催化剂的比表面积(单位质量的物质所具有的总面积)如何影响汽车尾气的转化速率?
【查阅资料】使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】
(1)请填写下表中的空白。
(2)写出汽车尾气处理的化学方程式__________ 。
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂的比表面积,该化学反应的速率将___________ (填“增大”“减小”或“无影响”)。

(4)由实验Ⅰ和Ⅲ可得出的结论是______________ 。
 和
和 转化成
转化成 和
和 。为研究如何增大该化学反应的速率,某课题组进行了以下实验探究。
。为研究如何增大该化学反应的速率,某课题组进行了以下实验探究。【提出问题】在其他条件不变的情况下,温度或催化剂的比表面积(单位质量的物质所具有的总面积)如何影响汽车尾气的转化速率?
【查阅资料】使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】
(1)请填写下表中的空白。
| 编号 | 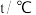 | 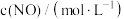 | 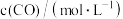 | 催化剂的比表面积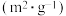 |
| Ⅰ | 280 | 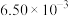 | 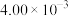 | 80.0 |
| Ⅱ | 120 | |||
| Ⅲ | 360 | 80.0 |
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂的比表面积,该化学反应的速率将

(4)由实验Ⅰ和Ⅲ可得出的结论是
更新时间:2023-07-04 10:40:14
|
相似题推荐
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐1】改变反应条件可以调控化学反应速率。某实验小组探究反应条件对 分解速率的影响。
分解速率的影响。
(1)用双线桥表示下列反应的电子转移的方向和数目___________ 。

(2)某同学探究温度、浓度对反应速率的影响,设计的实验方案如下表:
①表中
___________ ,
___________ 。
②对比实验___________ 和___________ (填序号)可探究浓度对反应速率的影响。
③对比实验___________ 和___________ (填序号)可探究温度对反应速率的影响。
(3)某同学利用土豆(含有过氧化氢酶)探究催化剂对反应速率的影响,设计了图1装置进行实验:

在针筒里放入等质量的生土豆碎或熟土豆碎,再抽取2mL3% 溶液,用传感器测量氧气浓度变化,实验A、B所得数据如图2所示。
溶液,用传感器测量氧气浓度变化,实验A、B所得数据如图2所示。

①实验A中,用氧气浓度变化表示前200s的平均反应速率为___________ 。
②实验B双氧水分解速率比实验A慢,原因是___________ 。
③生活中有许多通过改变外部条件调控化学反应速率的例子,请举出一例。
答案示例:
外部条件:温度。例子:将食物放在冰箱里降低食物变质的速率。
请作答:
外部条件:___________ 。例子:___________ 。
 分解速率的影响。
分解速率的影响。(1)用双线桥表示下列反应的电子转移的方向和数目

(2)某同学探究温度、浓度对反应速率的影响,设计的实验方案如下表:
| 序号 | 温度/℃ | 3% 溶液/mL 溶液/mL |  溶液/mL 溶液/mL | 蒸馏水/mL |
| 1 | 25 | 1 | 2 | 2 |
| 2 | 25 | 2 | 2 | b |
| 3 | 50 | a | 2 | 1 |


②对比实验
③对比实验
(3)某同学利用土豆(含有过氧化氢酶)探究催化剂对反应速率的影响,设计了图1装置进行实验:

在针筒里放入等质量的生土豆碎或熟土豆碎,再抽取2mL3%
 溶液,用传感器测量氧气浓度变化,实验A、B所得数据如图2所示。
溶液,用传感器测量氧气浓度变化,实验A、B所得数据如图2所示。
①实验A中,用氧气浓度变化表示前200s的平均反应速率为
②实验B双氧水分解速率比实验A慢,原因是
③生活中有许多通过改变外部条件调控化学反应速率的例子,请举出一例。
答案示例:
外部条件:温度。例子:将食物放在冰箱里降低食物变质的速率。
请作答:
外部条件:
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐2】某实验小组学习化学反应速率后,联想到H2O2分解制备氧气,设计如下实验方案探究外界条件对反应速率的影响。
(1)实验乙中发生反应的化学方程式为_______ 。
(2)实验甲和实验乙的实验目的是_______ 。实验甲和实验丙的实验目的是_______ 。
(3)这种控制其他条件不变,只改变单一条件的方法叫做_______ 。
(4)实验过程中该同学对实验乙中产生的气体进行收集,并在2 min内6个时间点对注射器内气体进行读数,记录数据如下表。
(在反应环境相同时,可直接用体积变化量与反应时间的比值表示反应速率)
0~20 s的反应速率v1=_______ mL·s-1,100~120 s的反应速率v2=_______ mL·s-1。不考虑实验测量误差,二者速率存在差异的主要原因是_______ 。
| 编号 | 温度℃ | 反应物 | 催化剂 |
| 甲 | 25 | 试管中加入3mL5%H2O2溶液 | 1mL蒸馏水 |
| 乙 | 25 | 试管中加入3mL5%H2O2溶液 | 1mL0.1mol/LFeCl3溶液 |
| 丙 | 40 | 试管中加入3mL5%H2O2溶液 | 1mL蒸馏水 |
(2)实验甲和实验乙的实验目的是
(3)这种控制其他条件不变,只改变单一条件的方法叫做
(4)实验过程中该同学对实验乙中产生的气体进行收集,并在2 min内6个时间点对注射器内气体进行读数,记录数据如下表。
(在反应环境相同时,可直接用体积变化量与反应时间的比值表示反应速率)
| 时间/s | 20 | 40 | 60 | 80 | 90 | 120 | |
| 气体体积/mL | 实验乙 | 15.0 | 29.5 | 43.5 | 56.5 | 69.5 | 81.5 |
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐3】(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验一如下(所取溶液体积均为10 mL):
其他条件不变时:探究温度对化学反应速率的影响,应选择实验____________ (填实验编号);若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究______________ 对化学反应速率的影响。
(2)在一定温度下,若将4a mol H2和2a mol N2放入V L的密闭容器中,5 min后测得N2的转化率为50%,则该段时间用H2表示的反应速率为______________________
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。
(3)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是______________________ 的影响。
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入______________ (填字母序号)。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/ (mol·L-1) | c(H2SO4)/ (mol·L-1) |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
其他条件不变时:探究温度对化学反应速率的影响,应选择实验
(2)在一定温度下,若将4a mol H2和2a mol N2放入V L的密闭容器中,5 min后测得N2的转化率为50%,则该段时间用H2表示的反应速率为
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。
(3)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐1】为比较Fe2+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答下列问题:
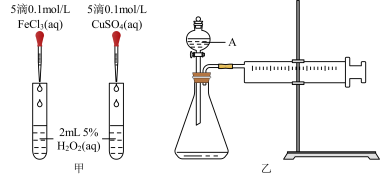
(1)定性分析:如图甲可通过观察___________________________ 定性比较得出结论,有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是______________________ 。
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为______________ ,实验中需要测量的是__________ 。
(3)某同学要利用乙装置测定某H2O2溶液的物质的量浓度。在锥形瓶中加入0.10 mol MnO2粉末后加入50 mL 该H2O2溶液,在标准状况下放出气体的体积和时间的关系如图所示。

①写出H2O2在MnO2作用下发生反应的化学方程式_________________________________ ;
②实验中放出气体的总体积是_______________ mL;
③A、B、C、D各点反应速率快慢的顺序为______ >______ >______ >______ ;
④计算H2O2的初始的物质的量浓度__________________ 。(结果保留2位小数)。

(1)定性分析:如图甲可通过观察
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为
(3)某同学要利用乙装置测定某H2O2溶液的物质的量浓度。在锥形瓶中加入0.10 mol MnO2粉末后加入50 mL 该H2O2溶液,在标准状况下放出气体的体积和时间的关系如图所示。

①写出H2O2在MnO2作用下发生反应的化学方程式
②实验中放出气体的总体积是
③A、B、C、D各点反应速率快慢的顺序为
④计算H2O2的初始的物质的量浓度
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐2】某研究小组设计了如图实验,探究常温下催化剂对过氧化氢分解反应的影响。
(1)实验Ⅰ的作用是_______________________________________________________ 。
(2)实验Ⅲ中反应的化学方程式为___________________________________________ 。
(3)根据实验Ⅰ~Ⅲ中现象的不同,可以得出的结论是
①使用合适的催化剂,可提高过氧化氢分解反应的速率;
②______________________________________________ 。
(4)在一定温度下,10mL 溶液发生催化分解,6min后
溶液发生催化分解,6min后 的浓度减小到
的浓度减小到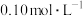 ,以
,以 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为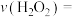
_________  。
。
(1)实验Ⅰ的作用是
(2)实验Ⅲ中反应的化学方程式为
(3)根据实验Ⅰ~Ⅲ中现象的不同,可以得出的结论是
①使用合适的催化剂,可提高过氧化氢分解反应的速率;
②
(4)在一定温度下,10mL
 溶液发生催化分解,6min后
溶液发生催化分解,6min后 的浓度减小到
的浓度减小到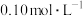 ,以
,以 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为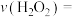
 。
。序号 | Ⅰ | Ⅱ | Ⅲ |
实验操作示意图 |
|
|
|
实验现象 | 有极少量气泡产生 | 产生气泡速率略有加快 | 产生气泡速率明显加快 |
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐3】设计实验测定锌与硫酸反应的速率,按下列实验步骤完成实验:

①按图示安装装置,加入锌粒,然后快速加入40mL1mol/L的硫酸溶液,测量收集10mLH2所用的时间。
②按图示再安装一套装置,加入与前一套装置相同的锌粒,然后再快速加入40mL4mol/L的硫酸溶液,测量收集10mLH2所用的时间。
回答下列问题:
(1)实验所用仪器有:锥形瓶、双孔塞、分液漏斗、直角导气管、50mL注射器、铁架台、________ 。
(2)观察到的现象是:____________________________________ ;
收集10mL气体②所用时间比①所用时间________ 。
(3)所能得出的实验结论是:_________________________________ 。
(4)若在①实验中加入适量MnO2,则:________
A.如果①比②速率慢,则证明MnO2无催化作用
B.如果①比②速率快,则不能证明MnO2有无催化作用
C.如果①比②速率慢,则不能证明MnO2有无催化作用
D.如果①比②速率快,则证明MnO2有催化作用

①按图示安装装置,加入锌粒,然后快速加入40mL1mol/L的硫酸溶液,测量收集10mLH2所用的时间。
②按图示再安装一套装置,加入与前一套装置相同的锌粒,然后再快速加入40mL4mol/L的硫酸溶液,测量收集10mLH2所用的时间。
回答下列问题:
(1)实验所用仪器有:锥形瓶、双孔塞、分液漏斗、直角导气管、50mL注射器、铁架台、
(2)观察到的现象是:
收集10mL气体②所用时间比①所用时间
(3)所能得出的实验结论是:
(4)若在①实验中加入适量MnO2,则:
A.如果①比②速率慢,则证明MnO2无催化作用
B.如果①比②速率快,则不能证明MnO2有无催化作用
C.如果①比②速率慢,则不能证明MnO2有无催化作用
D.如果①比②速率快,则证明MnO2有催化作用
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐1】I、中学常见反应的化学方程式是 (未配平,反应条件略去),其中A、B的物质的量之比为1∶4.请回答:
(未配平,反应条件略去),其中A、B的物质的量之比为1∶4.请回答:
(1)若Y是黄绿色气体,该反应的离子方程式是_________________________ 。
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是___________________ 。
II、(1)硫酸型酸雨样品放置时pH变化的主要原因是(用化学方程式表示)________ 。
(2)如果将刚取样的上述酸雨和自来水(用Cl2杀菌消毒)混合,pH将____ (填“增大”“减小”或“不变”),原因是(用化学方程式表示)_________________________________ 。
(3)你认为减少酸雨产生的途径可采用的措施是_____________ (填序号)。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
 (未配平,反应条件略去),其中A、B的物质的量之比为1∶4.请回答:
(未配平,反应条件略去),其中A、B的物质的量之比为1∶4.请回答:(1)若Y是黄绿色气体,该反应的离子方程式是
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是
II、(1)硫酸型酸雨样品放置时pH变化的主要原因是(用化学方程式表示)
(2)如果将刚取样的上述酸雨和自来水(用Cl2杀菌消毒)混合,pH将
(3)你认为减少酸雨产生的途径可采用的措施是
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐2】Ⅰ.现有混有少量SO2杂质的CO2气体,请选用适当的实验装置,收集纯净干燥的CO2气体。
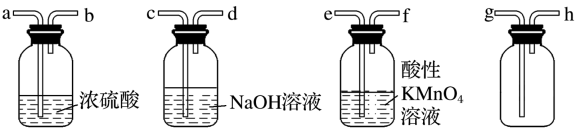
(1)要达到实验目的,按气流从左到右,各接口连接顺序正确的是_______ (填字母)。
(2)下列溶液或用品中:①澄清石灰水;②H2S溶液;③酸性KMnO4溶液;④溴水;⑤Ba(NO3)2溶液;⑥品红溶液;⑦湿润的蓝色石蕊试纸。不能区别SO2和CO2气体的是_______。
Ⅱ. 前几年我国多地发生了严重的雾霾天气,这种天气的形成与汽车尾气排放有关。汽车尾气中常含有CO、NOx等气体,为减轻污染,一般汽车都加装了“催化净化器”,可将汽车尾气中的有毒气体转化为无污染的气体。某化学兴趣小组在实验室模拟汽车尾气处理,设计了下图所示装置(部分夹持装置已略去)。

(3)装置(Ⅲ)的主要作用为_______ 。
(4)停止加热,打开活塞K,放入适量氧气时,装置(Ⅱ)中可观察到的现象是_______ 。
(5)该套装置的不完善之处是_______ 。
(6)汽车尾气中含有CO和NOx,消除它们对大气污染的方法是安装催化转化器,使它们发生反应生成两种无毒的气体,其中一种是单质,该反应的化学方程式为_______ 。
(7)工业上常用纯碱液来吸收NOx,有关反应的化学方程式为2NO2+Na2CO3=NaNO2+NaNO3+CO2、NO2+NO+Na2CO3=2NaNO2+CO2。现有标准状况下a L NO2和b L NO的混合气体恰好被200 mL Na2CO3溶液完全吸收,则a、b应满足的关系为_______ 。Na2CO3溶液的物质的量浓度为_______ mol·L-1。

(1)要达到实验目的,按气流从左到右,各接口连接顺序正确的是
(2)下列溶液或用品中:①澄清石灰水;②H2S溶液;③酸性KMnO4溶液;④溴水;⑤Ba(NO3)2溶液;⑥品红溶液;⑦湿润的蓝色石蕊试纸。不能区别SO2和CO2气体的是_______。
| A.①⑤⑦ | B.①⑤ | C.①⑦ | D.②③④⑤⑥ |
Ⅱ. 前几年我国多地发生了严重的雾霾天气,这种天气的形成与汽车尾气排放有关。汽车尾气中常含有CO、NOx等气体,为减轻污染,一般汽车都加装了“催化净化器”,可将汽车尾气中的有毒气体转化为无污染的气体。某化学兴趣小组在实验室模拟汽车尾气处理,设计了下图所示装置(部分夹持装置已略去)。

(3)装置(Ⅲ)的主要作用为
(4)停止加热,打开活塞K,放入适量氧气时,装置(Ⅱ)中可观察到的现象是
(5)该套装置的不完善之处是
(6)汽车尾气中含有CO和NOx,消除它们对大气污染的方法是安装催化转化器,使它们发生反应生成两种无毒的气体,其中一种是单质,该反应的化学方程式为
(7)工业上常用纯碱液来吸收NOx,有关反应的化学方程式为2NO2+Na2CO3=NaNO2+NaNO3+CO2、NO2+NO+Na2CO3=2NaNO2+CO2。现有标准状况下a L NO2和b L NO的混合气体恰好被200 mL Na2CO3溶液完全吸收,则a、b应满足的关系为
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
【推荐3】由次氯酸钠碱性废水(含有杂质 )处理硫酸工业尾气的流程如下:
)处理硫酸工业尾气的流程如下:
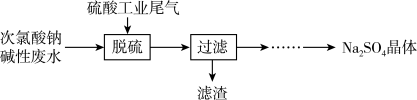
(1)次氯酸钠不稳定,温度较高时会分解生成 ,该反应的化学方程式为:
,该反应的化学方程式为:___________ 。
(2)控制合适的条件有利于提高 的吸收率(脱硫率)。
的吸收率(脱硫率)。
①脱硫时需保持溶液呈碱性,此过程的主要反应之一为: ;另一个为氧化还原反应,请写出该反应的离子方程式:
;另一个为氧化还原反应,请写出该反应的离子方程式:___________ 。
②提高脱硫率的可行措施有___________ (填序号)。
a、加快通入尾气的速率b、吸收塔中喷淋的碱液与气体逆向接触c、提高碱液
③温度控制在 之间,脱硫率较高,原因是
之间,脱硫率较高,原因是___________ 。
(3)脱硫完成后过滤,滤渣的主要成分为___________ (填化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状 ,使燃烧产生的
,使燃烧产生的 转化为稳定的
转化为稳定的 ,写出该反应的化学方程式:
,写出该反应的化学方程式:___________ 。
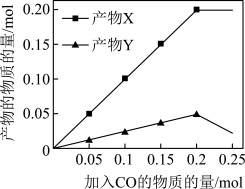
(5)为研究“ 还原
还原 ”的新技术,在反应器中加入
”的新技术,在反应器中加入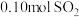 ,改变加入
,改变加入 的物质的量,反应后体系中产物随
的物质的量,反应后体系中产物随 的变化如图所示。其中产物Y的化学式是
的变化如图所示。其中产物Y的化学式是___________ 。
(6)研究表明: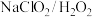 酸性复合吸收剂可同时有效脱硫、脱硝。写出废气中的
酸性复合吸收剂可同时有效脱硫、脱硝。写出废气中的 与
与 反应的离子方程式:
反应的离子方程式:___________ 。
 )处理硫酸工业尾气的流程如下:
)处理硫酸工业尾气的流程如下:
(1)次氯酸钠不稳定,温度较高时会分解生成
 ,该反应的化学方程式为:
,该反应的化学方程式为:(2)控制合适的条件有利于提高
 的吸收率(脱硫率)。
的吸收率(脱硫率)。①脱硫时需保持溶液呈碱性,此过程的主要反应之一为:
 ;另一个为氧化还原反应,请写出该反应的离子方程式:
;另一个为氧化还原反应,请写出该反应的离子方程式:②提高脱硫率的可行措施有
a、加快通入尾气的速率b、吸收塔中喷淋的碱液与气体逆向接触c、提高碱液

③温度控制在
 之间,脱硫率较高,原因是
之间,脱硫率较高,原因是(3)脱硫完成后过滤,滤渣的主要成分为
(4)为实现燃煤脱硫,向煤中加入浆状
 ,使燃烧产生的
,使燃烧产生的 转化为稳定的
转化为稳定的 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(5)为研究“
 还原
还原 ”的新技术,在反应器中加入
”的新技术,在反应器中加入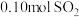 ,改变加入
,改变加入 的物质的量,反应后体系中产物随
的物质的量,反应后体系中产物随 的变化如图所示。其中产物Y的化学式是
的变化如图所示。其中产物Y的化学式是
(6)研究表明:
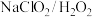 酸性复合吸收剂可同时有效脱硫、脱硝。写出废气中的
酸性复合吸收剂可同时有效脱硫、脱硝。写出废气中的 与
与 反应的离子方程式:
反应的离子方程式:
您最近一年使用:0次






