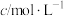(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验一如下(所取溶液体积均为10 mL):
其他条件不变时:探究温度对化学反应速率的影响,应选择实验____________ (填实验编号);若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究______________ 对化学反应速率的影响。
(2)在一定温度下,若将4a mol H2和2a mol N2放入V L的密闭容器中,5 min后测得N2的转化率为50%,则该段时间用H2表示的反应速率为______________________
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。
(3)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是______________________ 的影响。
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入______________ (填字母序号)。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/ (mol·L-1) | c(H2SO4)/ (mol·L-1) |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
其他条件不变时:探究温度对化学反应速率的影响,应选择实验
(2)在一定温度下,若将4a mol H2和2a mol N2放入V L的密闭容器中,5 min后测得N2的转化率为50%,则该段时间用H2表示的反应速率为
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。
(3)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水
更新时间:2016-12-09 08:51:05
|
相似题推荐
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐1】取等体积、等物质的量浓度H2O2溶液分别进行下列实验,研究外界条件对反应速率的影响。
(1)实验1、2研究的是___________ 对H2O2分解速率的影响; 实验3、4研究的是________ 对H2O2分解速率的影响。
(2)实验中可以判断该反应速率快慢的现象是__________ 。
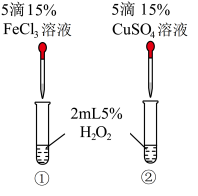
(3)有同学认为,若把实验3中的催化剂改成CuSO4进行下图操作,看到反应速率为①>②,则一定可以说明Fe3+比Cu2+对H2O2分解催化效果好。你认为此同学的结论是否正确?____ (填“正确”或“不正确”),理由是_____ 。
序号 | 条件 | |
温度/℃ | 催化剂 | |
1 | 40 | FeCl3溶液 |
2 | 20 | FeCl3溶液 |
3 | 20 | MnO2 |
4 | 20 | 无 |
(2)实验中可以判断该反应速率快慢的现象是
(3)有同学认为,若把实验3中的催化剂改成CuSO4进行下图操作,看到反应速率为①>②,则一定可以说明Fe3+比Cu2+对H2O2分解催化效果好。你认为此同学的结论是否正确?

您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐2】下表是稀硫酸与金属铁反应的实验数据(忽略反应过程中溶液体积的变化):
回答下列问题:
(1)反应的离子方程式为______ 。
(2)500 s内反应ⅰ中化学反应速率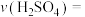
______ 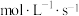 ,生成
,生成 的体积为
的体积为______ (标准状况)L。
(3)由实验ⅰ、ⅲ可得出的结论是______ 。
(4)该实验还能够说明影响反应速率的因素有______ 。
(5)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:______ 。
(6)实验中使用的铁丝为铁、碳合金,将铁丝一端浸入稀硫酸中可以形成原电池,其中铁为______ 极,溶液中 移动方向为
移动方向为______ 。
| 实验 序号 | 金属质 量/g | 金属 状态 | 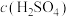 / /(  ) ) |  /mL | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| ⅰ | 1.12 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| ⅱ | 1.12 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| ⅲ | 1.12 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| ⅳ | 1.12 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| ⅴ | 1.12 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
(1)反应的离子方程式为
(2)500 s内反应ⅰ中化学反应速率
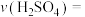
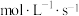 ,生成
,生成 的体积为
的体积为(3)由实验ⅰ、ⅲ可得出的结论是
(4)该实验还能够说明影响反应速率的因素有
(5)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:
(6)实验中使用的铁丝为铁、碳合金,将铁丝一端浸入稀硫酸中可以形成原电池,其中铁为
 移动方向为
移动方向为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐3】影响化学反应速率的因素很多,某校化学实验小组用实验方法探究影响草酸溶液与酸性高锰酸钾溶液反应速率的因素。
实验报告如下表:
(1)草酸溶液与酸性高锰酸钾溶液反应的离子方程式为___________ 。
(2)实验1和实验2研究温度对化学反应速率的影响,则x=___________ ;a___________ 12.5(填“>”“<”或“=”)。
(3)实验1、实验3和实验4研究浓度对化学反应速率的影响,则y=___________ ,z=___________ 。
(4)实验1的化学反应速率:v(MnO )=
)= ___________  ;化学反应速率:实验3
;化学反应速率:实验3___________ (填“大于”、“小于”或“等于”)实验4。
实验报告如下表:
| 实验 体积/mL 试剂 | 1 | 2 | 3 | 4 |
1.0mol/L  /mL /mL | 2 | 2 | 2 | 2 |
1.0 mol/L  /mL /mL | 4 | 4 | 4 |  |
0.2 mol/L  /mL /mL | 8 | 8 |  | 6 |
 /mL /mL |  | 6 | 8 | 10 |
酸性 溶液褐色所需时间/min 溶液褐色所需时间/min | 12.5 | a | 15.2 | 10.8 |
(2)实验1和实验2研究温度对化学反应速率的影响,则x=
(3)实验1、实验3和实验4研究浓度对化学反应速率的影响,则y=
(4)实验1的化学反应速率:v(MnO
 )=
)=  ;化学反应速率:实验3
;化学反应速率:实验3
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
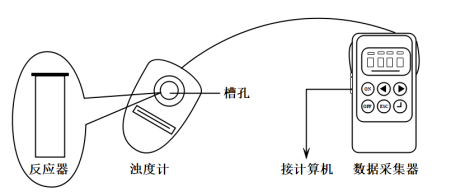
【推荐1】探究一定条件下反应物浓度对硫代硫酸钠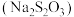 与硫酸反应速率的影响。
与硫酸反应速率的影响。
【查阅资料】a. 易溶于水,能与硫酸发生反应:
易溶于水,能与硫酸发生反应: 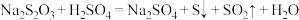
b.浊度计用于测量浑浊度的变化。产生的沉淀越多,浑浊度(单位为NTU)值越大。
【实验过程】
实验数据:
(1)选用浊度计进行测量,原因是 溶液与
溶液与 溶液反应生成了
溶液反应生成了___________ 。
(2)实验③中,x=___________ 。
(3)实验①、②、③的目的是___________ 。
(4)通过比较①、②、③与③、④、⑤两组实验,可推断:反应物浓度的改变对 与硫酸反应的化学反应速率的影响,
与硫酸反应的化学反应速率的影响, 溶液浓度的改变影响更大。该推断的证据是
溶液浓度的改变影响更大。该推断的证据是___________ 。
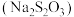 与硫酸反应速率的影响。
与硫酸反应速率的影响。【查阅资料】a.
 易溶于水,能与硫酸发生反应:
易溶于水,能与硫酸发生反应: 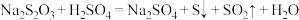
b.浊度计用于测量浑浊度的变化。产生的沉淀越多,浑浊度(单位为NTU)值越大。
【实验过程】

| 实验装置 |  溶液 溶液 |  溶液 溶液 | 蒸馏水 | ||
 |  |  |  |  | |
| ① | 0.1 | 1.5 | 0.1 | 3.5 | 10 |
| ② | 0.1 | 2.5 | 0.1 | 3.5 | 9 |
| ③ | 0.1 | 3.5 | 0.1 | 3.5 | x |
| ④ | 0.1 | 3.5 | 0.1 | 2.5 | 9 |
| ⑤ | 0.1 | 3.5 | 0.1 | 1.5 | 10 |
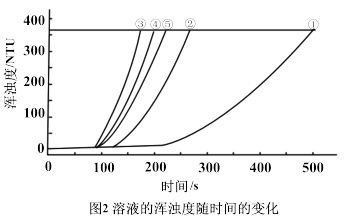
(1)选用浊度计进行测量,原因是
 溶液与
溶液与 溶液反应生成了
溶液反应生成了(2)实验③中,x=
(3)实验①、②、③的目的是
(4)通过比较①、②、③与③、④、⑤两组实验,可推断:反应物浓度的改变对
 与硫酸反应的化学反应速率的影响,
与硫酸反应的化学反应速率的影响, 溶液浓度的改变影响更大。该推断的证据是
溶液浓度的改变影响更大。该推断的证据是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐2】影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。他们利用Cu、Fe、Mg和不同浓度的硫酸溶液(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如表所示:
(1)甲同学的实验目的是_______ 。
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。
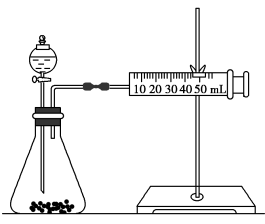
(2)乙同学在实验中应该测定的数据是_______ 。
(3)乙同学完成该实验应选用的实验药品是_______ 。
甲同学研究的实验报告如表所示:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积2mol/L硫酸溶液于三支试管中 ②向三支试管中分别投入大小、形状相同的Cu、Fe、Mg | 反应速率: ,Cu不反应 ,Cu不反应 | 金属的性质越活泼,反应速率越快 |
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。

(2)乙同学在实验中应该测定的数据是
(3)乙同学完成该实验应选用的实验药品是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐3】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
实验一:为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表。
(已知I2+2S2O ==S4O
==S4O +2I- ,其中Na2S2O3溶液均足量,且S2O
+2I- ,其中Na2S2O3溶液均足量,且S2O 与S4O
与S4O 均为无色)
均为无色)
(1)表中Vx=_________ mL,t1、t2、t3的大小关系是___________________
实验二:取5 mL 0.1 mol·L-1的KI溶液于试管中,滴加0.1 mol·L-1 FeCl3溶液2 mL,发生如下反应:2Fe3++2I-=2Fe2+ +I2,为证明该反应存在一定的限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色沉淀(AgI)。
②再取少量反应液,滴加少量CCl4 ,振荡,发现CCl4层显浅紫色。
根据①②的现象,他们得出结论:该反应具有一定的可逆性,在一定条件下会达到反应限度。
(2)指导老师指出上述实验①不合理,其原因是_______________ ; 你的改进方案是________ (简要写出操作、试剂和现象)。
(3)实验②适合检验生成I2较多的情况,还有一种简便的方法可以灵敏地检验是否生成了I2,这种方法所用的试剂是_______________________ 。
实验一:为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表。
(已知I2+2S2O
 ==S4O
==S4O +2I- ,其中Na2S2O3溶液均足量,且S2O
+2I- ,其中Na2S2O3溶液均足量,且S2O 与S4O
与S4O 均为无色)
均为无色)实验序号 | 体积V/mL | 蓝色褪去时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
实验二:取5 mL 0.1 mol·L-1的KI溶液于试管中,滴加0.1 mol·L-1 FeCl3溶液2 mL,发生如下反应:2Fe3++2I-=2Fe2+ +I2,为证明该反应存在一定的限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色沉淀(AgI)。
②再取少量反应液,滴加少量CCl4 ,振荡,发现CCl4层显浅紫色。
根据①②的现象,他们得出结论:该反应具有一定的可逆性,在一定条件下会达到反应限度。
(2)指导老师指出上述实验①不合理,其原因是
(3)实验②适合检验生成I2较多的情况,还有一种简便的方法可以灵敏地检验是否生成了I2,这种方法所用的试剂是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐1】KI溶液在酸性条件下能与氧气反应。现有以下实验记录:
回答下列问题:
(1)该反应的离子方程式为_____________________________ 。
(2)该实验的目的是____________________________________ 。
(3)实验试剂除了1mol· L-1 KI溶液、0.1mol·L-1 H2SO4溶液外,还需要的试剂是______________ ,实验现象为________________________ 。
(4)升高温度时,显色时间变短,主要原因是_____________
A.反应物分子总数增加,有效碰撞的机会增多
B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
C.该化学反应的过程是吸热的
D.该化学反应的过程是放热的
(5)若要进行酸性对反应速率的影响的探究实验,你会采取的措施是__________ 。
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度/℃ | 30 | 40 | 50 | 60 | 70 |
| 显色时间/s | 160 | 80 | 40 | 20 | 10 |
回答下列问题:
(1)该反应的离子方程式为
(2)该实验的目的是
(3)实验试剂除了1mol· L-1 KI溶液、0.1mol·L-1 H2SO4溶液外,还需要的试剂是
(4)升高温度时,显色时间变短,主要原因是
A.反应物分子总数增加,有效碰撞的机会增多
B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
C.该化学反应的过程是吸热的
D.该化学反应的过程是放热的
(5)若要进行酸性对反应速率的影响的探究实验,你会采取的措施是
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐2】运用化学反应原理研究化学反应有重要的意义。请回答下列问题:
(1)工业上利用反应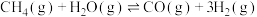 生产
生产 。一定温度下,向2 L恒容密闭容器中充入1.6 mol
。一定温度下,向2 L恒容密闭容器中充入1.6 mol  和2.4 mol
和2.4 mol  发生上述反应,CO(g)的物质的量随时间的变化如图所示:
发生上述反应,CO(g)的物质的量随时间的变化如图所示: =
=______  。
。
②下列不能说明上述反应达到平衡状态的是______ (填字母)。
A.恒温恒容时,容器内的总压强不随时间而变化
B.恒温恒容时,容器内混合气体的密度保持不变
C. 、CO(g)的浓度保持不变
、CO(g)的浓度保持不变
D.断开3mol H-H键的同时断开2 mol O-H键
(2)某研究性学习小组利用 溶液和硫酸的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
溶液和硫酸的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
【实验原理】
已知: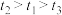 。请回答:
。请回答:
①配制0.1 的
的 溶液100 mL,需要的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管和
溶液100 mL,需要的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管和______ 。
②实验过程使用了“控制变量法”,实验1、2探究的是 溶液浓度对反应速率的影响,则
溶液浓度对反应速率的影响,则 =
=______ ,得到的结论是____________ 。
③实验1、3探究的是温度对反应速率的影响,则 =
=______ ,得到的结论是____________ 。
④甲同学认为,也可通过排水法测量单位时间内产生气体体积的方法,来探究影响该反应速率的因素。你认为甲同学的方案是否可行?______ (填“可行”或“不可行”)理由是____________ 。
(1)工业上利用反应
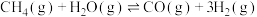 生产
生产 。一定温度下,向2 L恒容密闭容器中充入1.6 mol
。一定温度下,向2 L恒容密闭容器中充入1.6 mol  和2.4 mol
和2.4 mol  发生上述反应,CO(g)的物质的量随时间的变化如图所示:
发生上述反应,CO(g)的物质的量随时间的变化如图所示:
 =
= 。
。②下列不能说明上述反应达到平衡状态的是
A.恒温恒容时,容器内的总压强不随时间而变化
B.恒温恒容时,容器内混合气体的密度保持不变
C.
 、CO(g)的浓度保持不变
、CO(g)的浓度保持不变D.断开3mol H-H键的同时断开2 mol O-H键
(2)某研究性学习小组利用
 溶液和硫酸的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
溶液和硫酸的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:【实验原理】

实验序号 | 实验温度/K | 有关物质 | 溶液变浑浊所需时间/s | ||||
|
|
| |||||
V/mL |
| V/mL |
| V/mL | |||
1 | 298 | 2 | 0.1 | 5 | 0.1 | 0 |
|
2 | 298 | 2 | 0.1 | 4 | 0.1 |
|
|
3 | 313 | 2 | 0.1 |
| 0.1 | 0 |
|
 。请回答:
。请回答:①配制0.1
 的
的 溶液100 mL,需要的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管和
溶液100 mL,需要的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管和②实验过程使用了“控制变量法”,实验1、2探究的是
 溶液浓度对反应速率的影响,则
溶液浓度对反应速率的影响,则 =
=③实验1、3探究的是温度对反应速率的影响,则
 =
=④甲同学认为,也可通过排水法测量单位时间内产生气体体积的方法,来探究影响该反应速率的因素。你认为甲同学的方案是否可行?
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐3】某课外兴趣小组实验探究影响化学反应速率的因素。
(1)硫代硫酸钠( )俗称大苏打、海波,广泛应用于照相定影等领域。某同学利用控制变量法探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如表系列实验:
)俗称大苏打、海波,广泛应用于照相定影等领域。某同学利用控制变量法探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如表系列实验:
①从硫元素的价态分析,硫代硫酸钠( )具有
)具有_______ (填标号)。
A.氧化性 B.还原性 C.氧化性和还原性 D.无法判断
②硫代硫酸钠与稀硫酸反应会生成淡黄色沉淀和刺激性气味气体,写出该反应的化学方程式_______ 。
③该实验1和3可探究_______ 对反应速率的影响,因此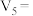
_______ mL。实验1和2可探究温度对反应速率的影响,因此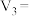
_______ mL。
(2)为更精确地研究浓度对反应速率的影响,小组同学利用压强传感器等数字化实验设备,探究镁与不同浓度硫酸的反应速率,两组实验所用药品如表:
实验结果如图所示:

①实验Ⅰ对应图中曲线_______ (填字母)。
②随着反应的不断进行,化学反应速率减慢,主要原因是_______ 。
③如果用2mL 1.0mol/L HCl代替实验Ⅰ中的硫酸,与实验Ⅱ相比较,二者的反应速率_______ (填“相同”、“不相同”或“无法比较”)。请说明原因_______ 。
(1)硫代硫酸钠(
 )俗称大苏打、海波,广泛应用于照相定影等领域。某同学利用控制变量法探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如表系列实验:
)俗称大苏打、海波,广泛应用于照相定影等领域。某同学利用控制变量法探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如表系列实验:| 实验序号 | 反应温度/℃ |  浓度 浓度 | 稀硫酸 |  | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| 1 | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| 2 | 40 |  | 0.10 |  | 0.50 | 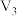 |
| 3 | 20 | 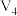 | 0.10 | 4.0 | 0.50 | 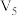 |
 )具有
)具有A.氧化性 B.还原性 C.氧化性和还原性 D.无法判断
②硫代硫酸钠与稀硫酸反应会生成淡黄色沉淀和刺激性气味气体,写出该反应的化学方程式
③该实验1和3可探究
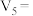
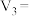
(2)为更精确地研究浓度对反应速率的影响,小组同学利用压强传感器等数字化实验设备,探究镁与不同浓度硫酸的反应速率,两组实验所用药品如表:
| 序号 | 镁条的质量(大小相同)/g | 硫酸 | |
| 物质的量浓度(mol/L) | 体积/mL | ||
| 实验Ⅰ | 10 | 1.0 | 2 |
| 实验Ⅱ | 10 | 0.5 | 2 |

①实验Ⅰ对应图中曲线
②随着反应的不断进行,化学反应速率减慢,主要原因是
③如果用2mL 1.0mol/L HCl代替实验Ⅰ中的硫酸,与实验Ⅱ相比较,二者的反应速率
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐1】某实验探究小组用酸性 溶液与
溶液与 溶液反应过程中溶液紫色消失快慢的方法,研究影响反应速率的因素。实验条件如下:所用酸性
溶液反应过程中溶液紫色消失快慢的方法,研究影响反应速率的因素。实验条件如下:所用酸性 溶液的浓度可选择0.010mol/L、0.001 mol/L,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K。每次实验酸性
溶液的浓度可选择0.010mol/L、0.001 mol/L,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K。每次实验酸性 溶液的用量均为4mL,
溶液的用量均为4mL, 溶液(0.100 mol/L)的用量均为2mL。已知
溶液(0.100 mol/L)的用量均为2mL。已知 。
。
(1)写出反应的离子方程式:___________ 。
(2)已知部分实验数据如下:
实验目的:
a.实验①和②探究___________ 对该反应速率的影响;
b.实验①和③探究___________ 对该反应速率的影响;
c.实验①和④探究催化剂对该反应速率的影响,则实验④选择温度___________ K,催化剂用量___________ g,酸性 溶液的浓度
溶液的浓度___________ mol/L。该反应的催化剂应选择___________ (填写“ “或“
“或“ ”),简述选择的理由:
”),简述选择的理由:___________ 。
 溶液与
溶液与 溶液反应过程中溶液紫色消失快慢的方法,研究影响反应速率的因素。实验条件如下:所用酸性
溶液反应过程中溶液紫色消失快慢的方法,研究影响反应速率的因素。实验条件如下:所用酸性 溶液的浓度可选择0.010mol/L、0.001 mol/L,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K。每次实验酸性
溶液的浓度可选择0.010mol/L、0.001 mol/L,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K。每次实验酸性 溶液的用量均为4mL,
溶液的用量均为4mL, 溶液(0.100 mol/L)的用量均为2mL。已知
溶液(0.100 mol/L)的用量均为2mL。已知 。
。(1)写出反应的离子方程式:
(2)已知部分实验数据如下:
| 实验编号 | T/K | 催化剂的用量/g | 酸性 溶液的浓度/( mol/L) 溶液的浓度/( mol/L) |
| ① | 298 | 0.5 | 0.010 |
| ② | 298 | 0.5 | 0.001 |
| ③ | 323 | 0.5 | 0.010 |
| ④ |
a.实验①和②探究
b.实验①和③探究
c.实验①和④探究催化剂对该反应速率的影响,则实验④选择温度
 溶液的浓度
溶液的浓度 “或“
“或“ ”),简述选择的理由:
”),简述选择的理由:
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐2】(1)将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应:N2(g)+3H2(g)⇌2NH3(g)
①在反应体系中加入催化剂,反应速率______ ,该反应的反应热_______ (填“增大”、“减小”或“不变”)。
②5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率υ(N2)=_________ ,H2的转化率为______ (保留小数点后一位)。
③欲提高②容器中H2的转化率,下列措施可行的是________ 。
A.把气体的体积压缩至1L B.向容器中再充入惰性气体
C.改变反应的催化剂 D.液化生成物分离出氨
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:2N2(g)+6H2O(g)⇌4NH3(g)+3O2(g) ∆H=akJ/mol,进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
此合成反应的a_________ 0。(填“大于”、“小于”或“等于”)
①在反应体系中加入催化剂,反应速率
②5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率υ(N2)=
③欲提高②容器中H2的转化率,下列措施可行的是
A.把气体的体积压缩至1L B.向容器中再充入惰性气体
C.改变反应的催化剂 D.液化生成物分离出氨
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:2N2(g)+6H2O(g)⇌4NH3(g)+3O2(g) ∆H=akJ/mol,进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
此合成反应的a
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐3】(1)根据下列热化学方程式:
①C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
②H2(g)+ O2(g)═H2O(l)△H=-285.8kJ•mol-1
O2(g)═H2O(l)△H=-285.8kJ•mol-1
③CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H=-870.3kJ•mol-1
可以计算出2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为___ 。
(2)已知在101kPa时,CO的燃烧热为283kJ•mol-1。相同条件下,若2molCH4完全燃烧生成液态水,所放出的热量为1molCO完全燃烧放出热量的6.30倍,表示CH4燃烧热的热化学方程式是___ 。
(3)催化剂可以加快化学反应速率的原因___ 。
(4)把一小块镁、铝合金放入6mol•L-1的NaOH溶液中,可以形成微型原电池,则该原电池负极发生的电极反应式为___ 。
①C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
②H2(g)+
 O2(g)═H2O(l)△H=-285.8kJ•mol-1
O2(g)═H2O(l)△H=-285.8kJ•mol-1③CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H=-870.3kJ•mol-1
可以计算出2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为
(2)已知在101kPa时,CO的燃烧热为283kJ•mol-1。相同条件下,若2molCH4完全燃烧生成液态水,所放出的热量为1molCO完全燃烧放出热量的6.30倍,表示CH4燃烧热的热化学方程式是
(3)催化剂可以加快化学反应速率的原因
(4)把一小块镁、铝合金放入6mol•L-1的NaOH溶液中,可以形成微型原电池,则该原电池负极发生的电极反应式为
您最近一年使用:0次