影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。他们利用Cu、Fe、Mg和不同浓度的硫酸溶液(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如表所示:
(1)甲同学的实验目的是_______ 。
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。
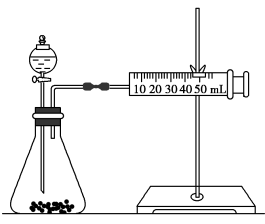
(2)乙同学在实验中应该测定的数据是_______ 。
(3)乙同学完成该实验应选用的实验药品是_______ 。
甲同学研究的实验报告如表所示:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积2mol/L硫酸溶液于三支试管中 ②向三支试管中分别投入大小、形状相同的Cu、Fe、Mg | 反应速率: ,Cu不反应 ,Cu不反应 | 金属的性质越活泼,反应速率越快 |
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。

(2)乙同学在实验中应该测定的数据是
(3)乙同学完成该实验应选用的实验药品是
更新时间:2022-04-25 22:36:05
|
相似题推荐
解答题-原理综合题
|
较易
(0.85)
名校
【推荐1】雾霾已经成为城市发展的障碍。雾霾形成的最主要原因是人为排放,其中汽车尾气污染对雾霾的“贡献”逐年增加。为了减轻大气污染,可在汽车尾气排放处加装“催化净化器”装置。
(1)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.0kJ/mol;C(s)+ O2(g)=CO(g) ΔH2=-110.0kJ/mol;N2(g)+O2(g)=2NO(g) ΔH3=+180.0kJ/mol。通过汽车“催化净化器”的CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的热化学方程式:
O2(g)=CO(g) ΔH2=-110.0kJ/mol;N2(g)+O2(g)=2NO(g) ΔH3=+180.0kJ/mol。通过汽车“催化净化器”的CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的热化学方程式:___ 。
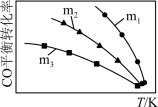
(2)一定条件下进行上述反应,测得CO的平衡转化率与温度、起始投料比m[m=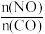 ]的关系如图所示。
]的关系如图所示。
回答下列问题:
①投料比m1、m2、m3中,最大的是___ 。
②随着温度的升高,不同投料比下CO平衡转化率趋于相近的原因是___ 。
(3)为研究气缸中NO的生成,在体积可变的恒压密闭容器中,高温下充入物质的量均为1mol的氮气和氧气,发生反应N2(g)+O2(g) 2NO(g)。
2NO(g)。
①为减小平衡混合气中NO的体积分数,可采取的措施是___ (填“升高温度”或“降低温度”)。
②对于气缸中NO的生成,化学家提出了如下反应历程:第一步O2 2O慢反应,第二步O+N2
2O慢反应,第二步O+N2 NO+N较快平衡,第三步N+O2
NO+N较快平衡,第三步N+O2 NO+O快速平衡。下列说法正确的是
NO+O快速平衡。下列说法正确的是___ (填序号)。.
A.N、O原子均为该反应的催化剂
B.第一步反应不从N2分解开始,是因为N2比O2稳定
C.三步反应中第一步反应活化能最小
D.三步反应的速率都随温度升高而增大
(4)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH1,如图是该反应的能量变化图:
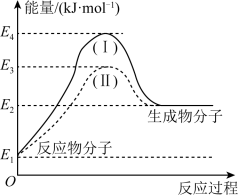
①通过图中信息可判断反应CH3OH(g)+H2O(g)↑=CO2(g)+3H2(g)的ΔH1___ (选填“>”“=”或“<”)0。
②图中途径(II)使用了催化剂。则途径(II)的活化能___ (选填“>”“=”或“<”)途径(I)的活化能。
(1)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.0kJ/mol;C(s)+
 O2(g)=CO(g) ΔH2=-110.0kJ/mol;N2(g)+O2(g)=2NO(g) ΔH3=+180.0kJ/mol。通过汽车“催化净化器”的CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的热化学方程式:
O2(g)=CO(g) ΔH2=-110.0kJ/mol;N2(g)+O2(g)=2NO(g) ΔH3=+180.0kJ/mol。通过汽车“催化净化器”的CO、NO在催化剂和高温作用下可发生可逆反应,转化为参与大气循环的无毒混合气体,写出该反应的热化学方程式:(2)一定条件下进行上述反应,测得CO的平衡转化率与温度、起始投料比m[m=
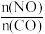 ]的关系如图所示。
]的关系如图所示。
回答下列问题:
①投料比m1、m2、m3中,最大的是
②随着温度的升高,不同投料比下CO平衡转化率趋于相近的原因是
(3)为研究气缸中NO的生成,在体积可变的恒压密闭容器中,高温下充入物质的量均为1mol的氮气和氧气,发生反应N2(g)+O2(g)
 2NO(g)。
2NO(g)。①为减小平衡混合气中NO的体积分数,可采取的措施是
②对于气缸中NO的生成,化学家提出了如下反应历程:第一步O2
 2O慢反应,第二步O+N2
2O慢反应,第二步O+N2 NO+N较快平衡,第三步N+O2
NO+N较快平衡,第三步N+O2 NO+O快速平衡。下列说法正确的是
NO+O快速平衡。下列说法正确的是A.N、O原子均为该反应的催化剂
B.第一步反应不从N2分解开始,是因为N2比O2稳定
C.三步反应中第一步反应活化能最小
D.三步反应的速率都随温度升高而增大
(4)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH1,如图是该反应的能量变化图:

①通过图中信息可判断反应CH3OH(g)+H2O(g)↑=CO2(g)+3H2(g)的ΔH1
②图中途径(II)使用了催化剂。则途径(II)的活化能
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐2】I.为探究H+对MnO2与H2O2反应速率的影响。现取等量MnO2和表中有关物质,在相同温度下进行4组实验,分别记录收集20.0mLO2所需时间。
已知酸性条件下时:MnO2+H2O2+2H+=Mn2++O2↑+2H2O
(1)表中V2=____ mL,V4=_____ mL。
(2)实验测得t2>t3>t4,则可得出的实验结论是____ 。
II.已知反应2NO(g)+2H2(g)=N2(g)+2H2O(g)生成N2的初始速率与NO、H2的初始浓度的关系为v=kcx(NO)cy(H2),k为速率常数。在800℃时测得的相关数据如表所示。
(3)由表中的数据可算出x、k的值:x=_____ ,k=____ 。
(4)若800℃时,初始浓度c(NO)=c(H2)=4.00×10-3mol·L-1,则生成N2的初始速率为_____ mol·L-1·s-1。
| 实验编号 | 1 | 2 | 3 | 4 |
| 10%H2O2的体积/mL | 5.0 | 5.0 | V1 | V2 |
| 20%硫酸的体积/mL | 0 | 0.5 | 1.0 | V3 |
| 水的体积/mL | 15.0 | 14.5 | V4 | 13.5 |
| 所需时间t/s | t1 | t2 | t3 | t4 |
(1)表中V2=
(2)实验测得t2>t3>t4,则可得出的实验结论是
II.已知反应2NO(g)+2H2(g)=N2(g)+2H2O(g)生成N2的初始速率与NO、H2的初始浓度的关系为v=kcx(NO)cy(H2),k为速率常数。在800℃时测得的相关数据如表所示。
| 实验数据 | 初始浓度 | 生成N2的初始速率/mol·L-1·s-1 | |
| c(NO)/mol·L-1 | c(H2)/mol·L-1 | ||
| 1 | 2.00×10-3 | 6.00×10-3 | 1.92×10-3 |
| 2 | 1.00×10-3 | 6.00×10-3 | 4.80×10-4 |
| 3 | 2.00×10-3 | 3.00×10-3 | 9.60×10-4 |
(4)若800℃时,初始浓度c(NO)=c(H2)=4.00×10-3mol·L-1,则生成N2的初始速率为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐3】按照下面表格中的条件进行实验,再根据实验结果来研究影响化学反应速率的因素:
(1)对比编号为_____ 和_____ 的实验,可研究反应物的性质对化学反应速率的影响。
(2)对比编号为_____ 和_____ 的实验,可以研究反应物浓度对反应速率的影响。
(3)对比编号为_____ 和_____ 、或_____ 和_____ 的实验,可以研究温度对化学反应速率的影响。
(4)对比编号为 1 和 2 的两次实验,可以研究_____ 对化学反应速率的影响。
(5)如果改变实验时的气体压强,对这些实验的结果_____ (有、没有)影响。
| 实验序号 | 实验温度(℃) | 反应物 |
| 1 | 10℃ | Mg(条状)+0.1mol/L HCl |
| 2 | 10℃ | Mg(粉状)+0.1mol/L HCl |
| 3 | 10℃ | Mg(粉状)+1mol/L HCl |
| 4 | 10℃ | Zn(粉状)+1mol/L HCl |
| 5 | 20℃ | Mg(粉状)+1mol/L HCl |
| 6 | 20℃ | Mg(条状)+0.1mol/L HCl |
(2)对比编号为
(3)对比编号为
(4)对比编号为 1 和 2 的两次实验,可以研究
(5)如果改变实验时的气体压强,对这些实验的结果
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐1】为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
(1)实验①的目的是________________________________________ ,实验中滴加 溶液的目的是
溶液的目的是______________________________________________ 。
(2)实验②中未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出对上述操作的改进意见是________________________________________________ (用实验中所提供的试剂和仪器)。
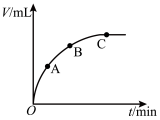
(3)某同学在50mL一定浓度的 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的瞬时反应速率最慢的是
溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的瞬时反应速率最慢的是______________ 。
| 实验编号 | 实验操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL5% 溶液,各滴入2滴1mol/L 溶液,各滴入2滴1mol/L 溶液,待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡,将试管B放入盛有40℃左右热水的烧杯中浸泡 溶液,待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡,将试管B放入盛有40℃左右热水的烧杯中浸泡 | 试管A中不再产生气泡,试管B中产生气泡的量增大 |
| ② | 另取两支试管分别加入5mL5% 溶液和5mL10% 溶液和5mL10% 溶液 溶液 | 两试管中均未明显见到有气泡产生 |
 溶液的目的是
溶液的目的是(2)实验②中未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出对上述操作的改进意见是
(3)某同学在50mL一定浓度的
 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的瞬时反应速率最慢的是
溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的瞬时反应速率最慢的是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
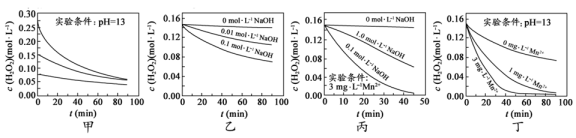
【推荐2】小组同学研究H2O2分解速率的影响因素。查阅资料得到70℃时,不同条件下H2O2浓度随时间的变化图。(其中Mn2+做催化剂)
(1)H2O2分解反应的化学方程式是___________ 。
(2)由甲可知,一定条件下,H2O2的初始浓度越大,反应速率越___________ (填“快”或者“慢”)。
(3) A同学根据图乙得出结论:“其他条件保持不变,溶液碱性越强,H2O2分解速率越大”,此处的“其他条件”具体是指___________ 。
(4)B同学得出结论:“催化剂能加快H2O2分解速率”。 C同学认为该结论有其合理的一面,也有不合理的一面。请结合图象说明:
① 认为该结论合理的依据是___________ ;
② 认为该结论不合理的依据是___________ 。

(1)H2O2分解反应的化学方程式是
(2)由甲可知,一定条件下,H2O2的初始浓度越大,反应速率越
(3) A同学根据图乙得出结论:“其他条件保持不变,溶液碱性越强,H2O2分解速率越大”,此处的“其他条件”具体是指
(4)B同学得出结论:“催化剂能加快H2O2分解速率”。 C同学认为该结论有其合理的一面,也有不合理的一面。请结合图象说明:
① 认为该结论合理的依据是
② 认为该结论不合理的依据是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐3】将浓度均为0.01mol/L的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。
(资料)
该“碘钟实验”的总反应:H2O2+2S2O +2H+=S4O
+2H+=S4O +2H2O
+2H2O
反应分两步进行:
反应A:H2O2+2I-+2H+=I2+2H2O
反应B:……
(1)反应B的离子方程式是____ 。对于总反应,I-的作用相当于____ 。
(2)为证明反应A、B的存在,进行实验I。
a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
试剂X是____ 。
(3)为探究溶液变蓝快慢的影响因素,进行实验II、实验III。(溶液浓度均为0.01mol/L)
溶液从混合时的无色变为蓝色的时间:实验II是30min、实验III是40min。
①实验III中,z的数值是____ 。
②对比实验II、实验III,可得出的实验结论是____ 。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验IV。
(溶液浓度均为0.01mol/L)
实验过程中,溶液始终 无明显颜色变化。
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验Ⅳ未产生颜色变化的原因:____ 。
(资料)
该“碘钟实验”的总反应:H2O2+2S2O
 +2H+=S4O
+2H+=S4O +2H2O
+2H2O反应分两步进行:
反应A:H2O2+2I-+2H+=I2+2H2O
反应B:……
(1)反应B的离子方程式是
(2)为证明反应A、B的存在,进行实验I。
a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
试剂X是
(3)为探究溶液变蓝快慢的影响因素,进行实验II、实验III。(溶液浓度均为0.01mol/L)
| 试剂 序号 用量(mL) | H2O2溶液 | H2SO4溶液 | Na2S2O3溶液 | KI溶液(含淀粉) | H2O |
| 实验II | 5 | 4 | 8 | 3 | 0 |
| 实验III | 5 | 2 | x | y | z |
①实验III中,z的数值是
②对比实验II、实验III,可得出的实验结论是
(4)为探究其他因素对该“碘钟实验”的影响,进行实验IV。
(溶液浓度均为0.01mol/L)
| 试剂 序号 用量(mL) | H2O2溶液 | H2SO4溶液 | Na2S2O3溶液 | KI溶液(含淀粉) | H2O |
| 实验IV | 4 | 4 | 9 | 3 | 0 |
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验Ⅳ未产生颜色变化的原因:
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐1】某实验小组学习化学反应速率后,联想到H2O2分解制备氧气,设计如下实验方案探究外界条件对反应速率的影响。
(1)实验乙中发生反应的化学方程式为_______________ 。
(2)实验甲和实验乙的实验目的是____________ 。实验甲和实验丙的实验目的是___________ 。
(3)实验过程中该同学对实验乙中产生的气体进行收集,并在2min内6个时间点对注射器内气体进行读数,记录数据如下表。
0~20s的反应速率v1=__________ mL/s,100~120s的反应速率v2=__________ mL/s。不考虑实验测量误差,二者速率存在差异的主要原因是__________ 。
| 编号 | 温度 | 反应物 | 催化剂 |
| 甲 | 25℃ | 试管中加入3mL5%H2O2溶液 | 1mL蒸馏水 |
| 乙 | 25℃ | 试管中加入3mL5%H2O2溶液 | 1mL0.1mol/LFeCl3溶液 |
| 丙 | 40℃ | 试管中加入3mL5%H2O2溶液 | 1mL蒸馏水 |
(2)实验甲和实验乙的实验目的是
(3)实验过程中该同学对实验乙中产生的气体进行收集,并在2min内6个时间点对注射器内气体进行读数,记录数据如下表。
| 时间/s | 20 | 40 | 60 | 80 | 100 | 120 | |
| 气体体积/mL | 实验乙 | 15.0 | 29.5 | 43.5 | 56.5 | 69.5 | 81.5 |
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
【推荐2】察尔汗盐湖是我国最大的钾肥生成基地,生产过程中会产生大量水氯镁石(MgCl2·6H2O)。为实现资源综合利用,以水氯镁石为原料制轻质氧化镁。工艺如下:

按要求回答问题:
(1)锂与镁元素性质相似,写出向Li2SO4溶液中滴加Na2CO3溶液的离子方程式为___________ 。
(2)在“水浸”时适当升温的目的是___________ 。
(3)“沉镁”采用的温度为90℃~95℃,温度不宜超过95℃的理由是___________ 。
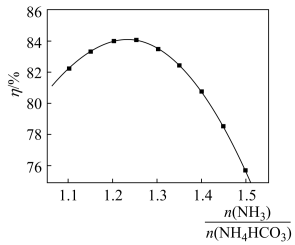
(4) 与沉镁效率(η)的关系如图所示,指出沉镁的
与沉镁效率(η)的关系如图所示,指出沉镁的 最佳范围为
最佳范围为___________ 。
(5)试说明“煅烧”后得到疏松多孔的MgO的原因是分解过程中产生大量的___________ 。
(6)“滤液”中的主要成分为___________ 。(填化学式)

按要求回答问题:
(1)锂与镁元素性质相似,写出向Li2SO4溶液中滴加Na2CO3溶液的离子方程式为
(2)在“水浸”时适当升温的目的是
(3)“沉镁”采用的温度为90℃~95℃,温度不宜超过95℃的理由是
(4)
 与沉镁效率(η)的关系如图所示,指出沉镁的
与沉镁效率(η)的关系如图所示,指出沉镁的 最佳范围为
最佳范围为
(5)试说明“煅烧”后得到疏松多孔的MgO的原因是分解过程中产生大量的
(6)“滤液”中的主要成分为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐3】KI溶液在酸性条件下能与氧气反应。现有以下实验记录:
回答下列问题:
(1)该反应的离子方程式为________________ 。
(2)该实验的目的是_________________ 。
(3)实验试剂除了1 mol·L-1KI溶液、0.1 mol·L-1H2SO4溶液外,还需要的试剂是_____ 。
(4)由上述实验记录可推测出若温度为20℃,显色时间是______ 。
(5)若要进行溶液酸性强弱对反应速率的影响的探究实验,你会采取的措施是____ 。
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| 温度/℃ | 30 | 40 | 50 | 60 | 70 |
| 显色时间/s | 160 | 80 | 40 | 20 | 10 |
(1)该反应的离子方程式为
(2)该实验的目的是
(3)实验试剂除了1 mol·L-1KI溶液、0.1 mol·L-1H2SO4溶液外,还需要的试剂是
(4)由上述实验记录可推测出若温度为20℃,显色时间是
(5)若要进行溶液酸性强弱对反应速率的影响的探究实验,你会采取的措施是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐1】我国科学家屠呦呦因成功从黄花蒿中提取青蒿素而获得2015年诺贝尔奖。青蒿素是治疗疟疾的有效药物,属于酯类化合物,其分子结构如图所示。
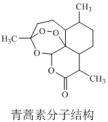
(1)从黄花蒿中提取青蒿素的流程如下:
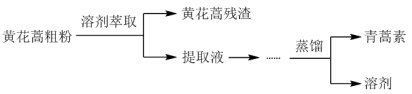
研究团队经历了使用不同溶剂和不同温度的探究过程,实验结果如下:
①分离黄花蒿残渣与提取液的实验操作是_______ 。
②提取青蒿素使用的溶剂最好选择_______ 。
③研究发现,青蒿素分子中的某个基团受热不稳定,据此分析用乙醇作溶剂,提取效率偏低,不能达到理想效果的原因是_______ 。
④蒸馏操作中用到的玻璃仪器有:酒精灯、蒸馏烧瓶、_______ 、冷凝管、尾接管、锥形瓶。
(2)研究还发现,将青蒿素通过下面反应转化为双氢青蒿素,治疗疟疾的效果更好。
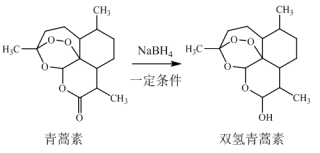
①该反应的反应类型是_______ 。
②从分子结构与物理性质的关系角度推测双氢青蒿素疗效更好的原因_______ 。
(3)提取并转化青蒿素治疗疟疾的过程中,应考虑物质的_______ 、_______ 等性质。

(1)从黄花蒿中提取青蒿素的流程如下:

研究团队经历了使用不同溶剂和不同温度的探究过程,实验结果如下:
| 溶剂 | 水 | 乙醇 | 乙醚 |
| 沸点/℃ | 100 | 78 | 35 |
| 提取效率 | 几乎为0 | 35% | 95% |
②提取青蒿素使用的溶剂最好选择
③研究发现,青蒿素分子中的某个基团受热不稳定,据此分析用乙醇作溶剂,提取效率偏低,不能达到理想效果的原因是
④蒸馏操作中用到的玻璃仪器有:酒精灯、蒸馏烧瓶、
(2)研究还发现,将青蒿素通过下面反应转化为双氢青蒿素,治疗疟疾的效果更好。

①该反应的反应类型是
②从分子结构与物理性质的关系角度推测双氢青蒿素疗效更好的原因
(3)提取并转化青蒿素治疗疟疾的过程中,应考虑物质的
您最近一年使用:0次
【推荐2】如图是甲、乙两位同学一起在实验室进行的氢氧化钠与盐酸中和反应的实验。

根据上图实验,请你与甲、乙同学一起完成下列探究:

根据上图实验,请你与甲、乙同学一起完成下列探究:
| 探究 环节 | 甲同学的探究 | 乙同学的探究 |
| 提出 问题 | A3溶液为什么不变红? | B3溶液中溶质成分是什么?(酚酞不计) |
| 作出 猜想 | 实验过程中,酚酞变质了。 | 猜想一:NaCl;猜想二:NaCl、HCl |
| 实验 验证 | (1)取少量A3溶液于另一试管中,向其中滴加NaOH溶液,溶液变红,说明甲同学的猜想 (2)你认为,在常温下A2溶液测出的pH应 | 取少量B3溶液加入盛有少量铁粉的试管中,观察到有无色气泡产生,固体逐渐减少,溶液由无色变为 |
| 交流 反思 | (1)甲、乙同学的实验中,反应均涉及到的化学方程式是 (2)A3溶液未变红,你认为原因是A2溶液中 (3)甲、乙同学经过实验对比探究,一致认为做化学实验时应注意药品用量的控制。 | |
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐3】某实验兴趣小组利用如图实验装置探究氯气与过量氨气反应的实验。
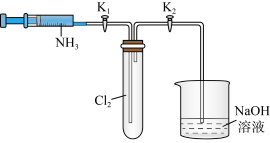
(1)请描述如何检验该装置的气密性_____ 。
(2)试管中可以观察到的现象是___________ 。

(1)请描述如何检验该装置的气密性
(2)试管中可以观察到的现象是
您最近一年使用:0次



