CO广泛应用于冶金工业,是合成羰基类有机产品的重要原料。工业上常利用水蒸气和炽热焦炭制备CO:
i.

体系中还存在水煤气变换反应:
ii.
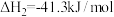
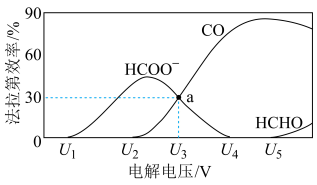
(1)已知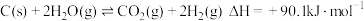 ,则
,则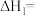
___________ 。
(2)在一定温度下,向某恒容密闭容器中加入 和
和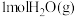 ,发生反应
,发生反应 和
和 。已知起始时体系的压强为
。已知起始时体系的压强为 ,在不同条件下测定体系的总压强
,在不同条件下测定体系的总压强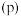 如下表所示。
如下表所示。
①下列说法正确的是___________ 。
A.混合气体的平均摩尔质量保持不变,说明反应体系已达到平衡
B.平衡时CO2的体积分数可能为
C.采用对反应i选择性高的催化剂有利于提高CO的平衡产率
②条件I中,700—800℃范围内体系总压变化的原因可能为___________ 。
③条件II中,740℃时测得体系中的CO2分压p(CO2)=15kPa,该条件下H2O的消耗速率为___________ kPa·h-1,780℃时,测得体系中H2的平衡分压p(H2)=90kPa,则反应i在该温度下用平衡分压表示的平衡常数Kp=___________ 。
(3)电解还原CO2也是合成CO的重要途径,同时可实现CO2的资源化利用。以Au为电极材料、KHCO3溶液为电解质,往M极持续通入CO2,其他条件不变,恒定通过电解池的电量,测得M极含碳产物的法拉第效率(FE%) 随电解电压的变化如图所示。
随电解电压的变化如图所示。
①电解时M极与电源的___________ 极相连。
②a点时,CO2发生电解反应的电极方程式为___________ 。
i.


体系中还存在水煤气变换反应:
ii.

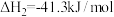
(1)已知
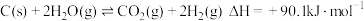 ,则
,则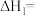
(2)在一定温度下,向某恒容密闭容器中加入
 和
和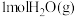 ,发生反应
,发生反应 和
和 。已知起始时体系的压强为
。已知起始时体系的压强为 ,在不同条件下测定体系的总压强
,在不同条件下测定体系的总压强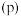 如下表所示。
如下表所示。| 条件 | T/℃ p/kPa | 700 | 720 | 740 | 760 | 780 | 800 |
| I | 催化剂1,2h | 140 | 110 | 108 | 112 | 117 | 125 |
| II | 催化剂2,2h | 125 | 132 | 140 | 150 | 163 | 170 |
| III | 催化剂2,h | 140 | 150 | 163 | 172 | 180 | 185 |
A.混合气体的平均摩尔质量保持不变,说明反应体系已达到平衡
B.平衡时CO2的体积分数可能为

C.采用对反应i选择性高的催化剂有利于提高CO的平衡产率
②条件I中,700—800℃范围内体系总压变化的原因可能为
③条件II中,740℃时测得体系中的CO2分压p(CO2)=15kPa,该条件下H2O的消耗速率为
(3)电解还原CO2也是合成CO的重要途径,同时可实现CO2的资源化利用。以Au为电极材料、KHCO3溶液为电解质,往M极持续通入CO2,其他条件不变,恒定通过电解池的电量,测得M极含碳产物的法拉第效率(FE%)
 随电解电压的变化如图所示。
随电解电压的变化如图所示。
①电解时M极与电源的
②a点时,CO2发生电解反应的电极方程式为
更新时间:2024-01-13 13:04:40
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:
(1)根据如图数据计算反应 的
的
_______ kJ/mol

(2)合成氨气的氢气可由天然气制备。
①其反应如下
 =+206kJ/mol,该反应自发的条件是
=+206kJ/mol,该反应自发的条件是_______________ (填“低温自发”“高温自发”或“任意温度自发”);
②为提高 的平衡转化率,可采用的措施是
的平衡转化率,可采用的措施是_______________ (填序号);
A.使用合适的催化剂 B.采用较高的温度 C.采用较高的压强 D.延长反应时间
③ 某温度下,在1L密闭容器中充入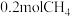 和
和 进行反应,达到平衡时再往容器内充入
进行反应,达到平衡时再往容器内充入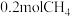 和
和 , 则该反应CH4转化率
, 则该反应CH4转化率_________ (填“变大”“变小”或“不变”)。
(3)催化剂的选择是合成氨的核心技术之一,使用催化剂1或催化剂2合成氨,产氨速率与温度的关系如图甲。


①由图判断,相同温度下,活化能Ea1_____________ Ea2(填“>”“<”或 “=”,下同)。
②在一定条件下,向某反应容器中投入 5mol N2和15mol H2,在不同温度下反应,平衡体系中氨的质量分数随压强变化曲线如图乙所示,温度 、
、  、
、  中,最大的是
中,最大的是____ ,  点
点  的转化率为
的转化率为____ 。
③1939年捷姆金和佩热夫推出氨合成反应在接近平衡时净速率方程式为 ,
, 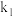 、
、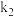 分别为正反应和逆反应的速率常数,
分别为正反应和逆反应的速率常数,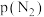 、
、 、
、 代表各组分的分压(分压
代表各组分的分压(分压  总压×物质的量分数);
总压×物质的量分数); 为常数,工业上以铁为催化剂时,
为常数,工业上以铁为催化剂时,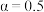 。由
。由 点数据计算
点数据计算 
_________ (MPa)-2。
(4)以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染等特点。工作原理如图所示:

写出该电池的负极电极反应方程式________________________________________ 。
(1)根据如图数据计算反应
 的
的

(2)合成氨气的氢气可由天然气制备。
①其反应如下

 =+206kJ/mol,该反应自发的条件是
=+206kJ/mol,该反应自发的条件是②为提高
 的平衡转化率,可采用的措施是
的平衡转化率,可采用的措施是A.使用合适的催化剂 B.采用较高的温度 C.采用较高的压强 D.延长反应时间
③ 某温度下,在1L密闭容器中充入
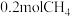 和
和 进行反应,达到平衡时再往容器内充入
进行反应,达到平衡时再往容器内充入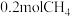 和
和 , 则该反应CH4转化率
, 则该反应CH4转化率(3)催化剂的选择是合成氨的核心技术之一,使用催化剂1或催化剂2合成氨,产氨速率与温度的关系如图甲。


①由图判断,相同温度下,活化能Ea1
②在一定条件下,向某反应容器中投入 5mol N2和15mol H2,在不同温度下反应,平衡体系中氨的质量分数随压强变化曲线如图乙所示,温度
 、
、  、
、  中,最大的是
中,最大的是 点
点  的转化率为
的转化率为③1939年捷姆金和佩热夫推出氨合成反应在接近平衡时净速率方程式为
 ,
, 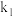 、
、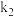 分别为正反应和逆反应的速率常数,
分别为正反应和逆反应的速率常数,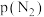 、
、 、
、 代表各组分的分压(分压
代表各组分的分压(分压  总压×物质的量分数);
总压×物质的量分数); 为常数,工业上以铁为催化剂时,
为常数,工业上以铁为催化剂时,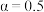 。由
。由 点数据计算
点数据计算 
(4)以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染等特点。工作原理如图所示:

写出该电池的负极电极反应方程式
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】研究CO2的转化可实现碳的循环利用。在反应器内CO2和H2在催化剂作用下可发生如下反应:
I.

Ⅱ.

(1)反应I的历程如图所示,其中吸附在催化剂表面上的物种用*标注。

下列说法不正确的是_______。
(2)若反应Ⅱ的正、逆反应速率分别表示为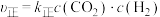 ,
,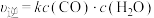 ,
, 、
、 分别为正、逆反应速率常数,c为物质的量浓度。
分别为正、逆反应速率常数,c为物质的量浓度。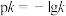 ,如图中有表示反应Ⅱ的正、逆反应速率常数随温度
,如图中有表示反应Ⅱ的正、逆反应速率常数随温度 变化的图像,若A、B、C、D点的纵坐标分别为
变化的图像,若A、B、C、D点的纵坐标分别为 、
、 、
、 、
、 ,则温度
,则温度 时反应Ⅱ的化学平衡常数
时反应Ⅱ的化学平衡常数
_______ 。

(3)在恒压条件下,CO2和H2发生反应I、反应Ⅱ,反应相同时间,测得不同温度下CO2的转化率和CH3OH的选择性如下图中实验值所示。图中平衡值表示相同条件下平衡状态CO2的转化率和CH3OH的选择性随温度的变化[CH3OH的选择性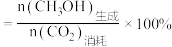 ]
]

① 时,测得反应器出口气体中全部含碳物质的物质的量之比
时,测得反应器出口气体中全部含碳物质的物质的量之比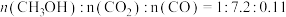 ,则该温度下CO2转化率
,则该温度下CO2转化率
_______ 。(结果保留1位小数)。
② 甲醇的平衡选择性随温度升高而降低的原因可能是
甲醇的平衡选择性随温度升高而降低的原因可能是_______ 。
③ 时,甲醇产率的实验值是
时,甲醇产率的实验值是_______ 。
(4)若只考虑反应I,在有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O,甲醇产率先增大后减小的原因是_______ ;请在下图中画出无分子筛膜时甲醇的平衡产率随温度的变化曲线_______ 。

I.


Ⅱ.


(1)反应I的历程如图所示,其中吸附在催化剂表面上的物种用*标注。

下列说法不正确的是_______。
A.该反应的 ,能低温自发 ,能低温自发 |
B.该历程中最小能垒(活化能)步骤的化学方程式为: |
| C.催化剂可以降低反应活化能和反应热,但对反应物的转化率无影响 |
D.最后一步是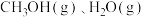 从催化剂表面的解吸过程, 从催化剂表面的解吸过程,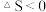 |
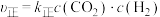 ,
,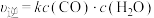 ,
, 、
、 分别为正、逆反应速率常数,c为物质的量浓度。
分别为正、逆反应速率常数,c为物质的量浓度。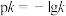 ,如图中有表示反应Ⅱ的正、逆反应速率常数随温度
,如图中有表示反应Ⅱ的正、逆反应速率常数随温度 变化的图像,若A、B、C、D点的纵坐标分别为
变化的图像,若A、B、C、D点的纵坐标分别为 、
、 、
、 、
、 ,则温度
,则温度 时反应Ⅱ的化学平衡常数
时反应Ⅱ的化学平衡常数

(3)在恒压条件下,CO2和H2发生反应I、反应Ⅱ,反应相同时间,测得不同温度下CO2的转化率和CH3OH的选择性如下图中实验值所示。图中平衡值表示相同条件下平衡状态CO2的转化率和CH3OH的选择性随温度的变化[CH3OH的选择性
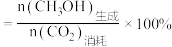 ]
]
①
 时,测得反应器出口气体中全部含碳物质的物质的量之比
时,测得反应器出口气体中全部含碳物质的物质的量之比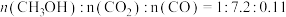 ,则该温度下CO2转化率
,则该温度下CO2转化率
②
 甲醇的平衡选择性随温度升高而降低的原因可能是
甲醇的平衡选择性随温度升高而降低的原因可能是③
 时,甲醇产率的实验值是
时,甲醇产率的实验值是(4)若只考虑反应I,在有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出H2O,甲醇产率先增大后减小的原因是

您最近一年使用:0次
【推荐3】随着科学技术的发展和环保要求不断提高,CO2的捕集利用技术成为研究的重点。
Ⅰ.工业上使用的捕碳剂有NH3和(NH4)2CO3,它们与CO2可发生如下可逆反应:
NH3(l)+H2O(l)+CO2(g) NH4HCO3(aq) ΔH1
NH4HCO3(aq) ΔH1
2NH3(l)+H2O(l)+CO2(g) (NH4)2CO3(aq) ΔH2
(NH4)2CO3(aq) ΔH2
(NH4)2CO3(aq)+H2O(l)+CO2(g) 2NH4HCO3(aq)ΔH3
2NH4HCO3(aq)ΔH3
则ΔH3=___________ (用含ΔH1、ΔH2的代数式表示)。
Ⅱ.目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的化学反应方程式为CO2(g)+4H2(g)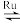 CH4(g)+2H2O(g),已知:H2的体积分数随温度的升高而增加。
CH4(g)+2H2O(g),已知:H2的体积分数随温度的升高而增加。
(1)该反应的ΔS___________ 0(填“>”“<”或“=”),该反应的ΔH___________ 0(填“>”或“<”)。
(2)在恒容密闭容器中通入等物质的量的CO2和H2并发生上述反应,T ℃下,CO2物质的量浓度c(CO2)随时间t变化的曲线如图所示。下列能说明反应达到平衡状态的是___________ (填字母代号)。
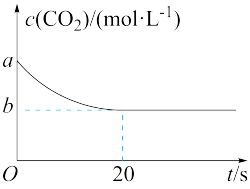
A.体系压强保持不变
B.混合气体密度保持不变
C.甲烷和水蒸气的物质的量之比保持不变
D.H2的质量分数保持不变
(3)T ℃下,反应前20 s的平均反应速率v(H2)=___________ (用含a、b的代数式表示)。
(4)T ℃下,该反应的平衡常数K=___________ (用含a、b的代数式表示)。
(5)若降低温度,反应重新达到平衡,则v(正)___________ ;CO2转化率___________ (填“增大”“减小”或“不变”)。
Ⅰ.工业上使用的捕碳剂有NH3和(NH4)2CO3,它们与CO2可发生如下可逆反应:
NH3(l)+H2O(l)+CO2(g)
 NH4HCO3(aq) ΔH1
NH4HCO3(aq) ΔH12NH3(l)+H2O(l)+CO2(g)
 (NH4)2CO3(aq) ΔH2
(NH4)2CO3(aq) ΔH2(NH4)2CO3(aq)+H2O(l)+CO2(g)
 2NH4HCO3(aq)ΔH3
2NH4HCO3(aq)ΔH3则ΔH3=
Ⅱ.目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的化学反应方程式为CO2(g)+4H2(g)
 CH4(g)+2H2O(g),已知:H2的体积分数随温度的升高而增加。
CH4(g)+2H2O(g),已知:H2的体积分数随温度的升高而增加。(1)该反应的ΔS
(2)在恒容密闭容器中通入等物质的量的CO2和H2并发生上述反应,T ℃下,CO2物质的量浓度c(CO2)随时间t变化的曲线如图所示。下列能说明反应达到平衡状态的是

A.体系压强保持不变
B.混合气体密度保持不变
C.甲烷和水蒸气的物质的量之比保持不变
D.H2的质量分数保持不变
(3)T ℃下,反应前20 s的平均反应速率v(H2)=
(4)T ℃下,该反应的平衡常数K=
(5)若降低温度,反应重新达到平衡,则v(正)
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(约6 mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。
(1)试从下图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是A接__________ ,B接__________ 。
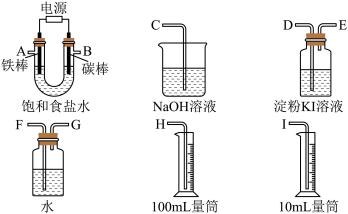
(2)铁棒接直流电源的________ 极;碳棒上发生的电极反应为_______ 。
(3)能说明氯气具有氧化性的实验现象是_______________________ 。
(4)假定装入的食盐水为50 mL,一段时间后,产生5.6 mL(标准状况)H2时,所得溶液在25 ℃时的pH=________ 。
(5)若将B电极换成铁电极,写出在电解过程中U形管底部出现的现象:__________ 。
(1)试从下图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是A接

(2)铁棒接直流电源的
(3)能说明氯气具有氧化性的实验现象是
(4)假定装入的食盐水为50 mL,一段时间后,产生5.6 mL(标准状况)H2时,所得溶液在25 ℃时的pH=
(5)若将B电极换成铁电极,写出在电解过程中U形管底部出现的现象:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】2020年9月我国明确提出2030年实现“碳达练”与2060年实现“碳中和”的目标,倡导绿色、环保、低碳的生活方式。二氧化碳催化加氢合成乙烯在环境保护、资源利用、战略需求等方面具有重要意义。 和
和 在铁系催化剂作用下发生化学反应:
在铁系催化剂作用下发生化学反应:
Ⅰ.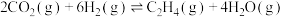

Ⅱ.

回答下列问题:
(1)反应Ⅰ能自发进行,则
___________ 0(填“<”“>”或“=”):该反应自发进行的条件是___________ (填“高温”或“低温”)。
(2)在密闭容器中通入1
 和3
和3
 ,在铁系催化剂作用下进行反应,某一压强下,
,在铁系催化剂作用下进行反应,某一压强下, 的平衡转化率随温度的变化如图所示。
的平衡转化率随温度的变化如图所示。___________ (填标号)。
A.由图1可知:在该压强下,200~550℃之间以反应Ⅰ为主,550℃后以反应Ⅱ为主
B.反应Ⅱ化学方程式前后物质的化学计量数之和相等、所以增大压强反应Ⅱ的速率一定不变
C.恒温恒压下,容器内气体的密度不变时,说明反应已达到平衡
D.其他条件不变,将 和
和 的初始物质的量之比变为2∶3,可提高
的初始物质的量之比变为2∶3,可提高 平衡转化率
平衡转化率
②图1中点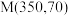 ,此时乙烯的选择性为
,此时乙烯的选择性为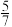 (选择性:转化的
(选择性:转化的 中,用于生成
中,用于生成 的
的 所占的物质的量分数),计算该温度时反应Ⅱ的平衡常数
所占的物质的量分数),计算该温度时反应Ⅱ的平衡常数
___________ (结果用分数表示)。
(3)利用电解法也可以实现 转化为
转化为 ,试写出在酸性介质中该电解池阴极的电极反应式:
,试写出在酸性介质中该电解池阴极的电极反应式:___________ 。
(4)工业上常用乙烯水合法制乙醇,乙醇脱水可制得二乙醚:
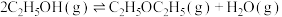
 。
。
实验测得: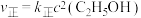 ,
, ,
, 、
、 为速率常数。
为速率常数。 温度下,向2L恒容密闭容器中加入0.2
温度下,向2L恒容密闭容器中加入0.2
 ,10min时达到平衡,
,10min时达到平衡, 的体积分数为25%,用
的体积分数为25%,用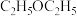 表示的平均反应速率为
表示的平均反应速率为___________  ,当温度变为
,当温度变为 时,
时,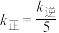 ,则
,则
___________  (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。
(5)温度为T℃时、在恒容密闭容器中发生反应 ,反应物
,反应物 和
和 的平衡转化率分别随着水、一氧化碳的物质的量之比
的平衡转化率分别随着水、一氧化碳的物质的量之比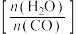 的变化曲线如图所示:
的变化曲线如图所示:
 、1.8
、1.8
 、3.2
、3.2
 、1.2
、1.2
 ,发生上述反应,反应进行的方向为
,发生上述反应,反应进行的方向为___________ (填“正向”或“逆向”)。
 和
和 在铁系催化剂作用下发生化学反应:
在铁系催化剂作用下发生化学反应:Ⅰ.
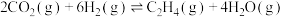

Ⅱ.


回答下列问题:
(1)反应Ⅰ能自发进行,则

(2)在密闭容器中通入1

 和3
和3
 ,在铁系催化剂作用下进行反应,某一压强下,
,在铁系催化剂作用下进行反应,某一压强下, 的平衡转化率随温度的变化如图所示。
的平衡转化率随温度的变化如图所示。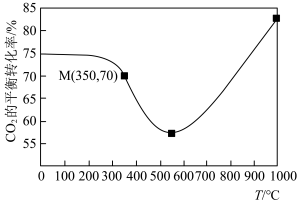
A.由图1可知:在该压强下,200~550℃之间以反应Ⅰ为主,550℃后以反应Ⅱ为主
B.反应Ⅱ化学方程式前后物质的化学计量数之和相等、所以增大压强反应Ⅱ的速率一定不变
C.恒温恒压下,容器内气体的密度不变时,说明反应已达到平衡
D.其他条件不变,将
 和
和 的初始物质的量之比变为2∶3,可提高
的初始物质的量之比变为2∶3,可提高 平衡转化率
平衡转化率②图1中点
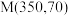 ,此时乙烯的选择性为
,此时乙烯的选择性为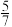 (选择性:转化的
(选择性:转化的 中,用于生成
中,用于生成 的
的 所占的物质的量分数),计算该温度时反应Ⅱ的平衡常数
所占的物质的量分数),计算该温度时反应Ⅱ的平衡常数
(3)利用电解法也可以实现
 转化为
转化为 ,试写出在酸性介质中该电解池阴极的电极反应式:
,试写出在酸性介质中该电解池阴极的电极反应式:(4)工业上常用乙烯水合法制乙醇,乙醇脱水可制得二乙醚:
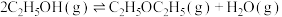
 。
。实验测得:
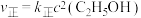 ,
, ,
, 、
、 为速率常数。
为速率常数。 温度下,向2L恒容密闭容器中加入0.2
温度下,向2L恒容密闭容器中加入0.2
 ,10min时达到平衡,
,10min时达到平衡, 的体积分数为25%,用
的体积分数为25%,用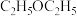 表示的平均反应速率为
表示的平均反应速率为 ,当温度变为
,当温度变为 时,
时,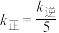 ,则
,则
 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。(5)温度为T℃时、在恒容密闭容器中发生反应
 ,反应物
,反应物 和
和 的平衡转化率分别随着水、一氧化碳的物质的量之比
的平衡转化率分别随着水、一氧化碳的物质的量之比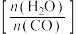 的变化曲线如图所示:
的变化曲线如图所示: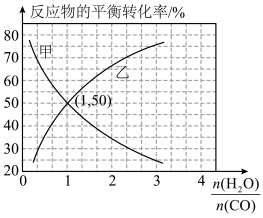

 、1.8
、1.8
 、3.2
、3.2
 、1.2
、1.2
 ,发生上述反应,反应进行的方向为
,发生上述反应,反应进行的方向为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】H2O2、O2、O3在水中可形成具有超强氧化能力的羟基自由基(·OH),能有效去除废水中的H2PO 、苯酚等物质。
、苯酚等物质。
(1)H2O2、O3在一定条件可处理废水中H2PO 。
。
①弱碱性条件下·OH将H2PO 氧化成PO
氧化成PO ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
②为比较不同投料方式下含H2PO 模拟废水的处理效果,向两份等体积废水样品中加入等量H2O2和O3,其中一份再加入FeSO4,反应相同时间,实验结果如下图所示。
模拟废水的处理效果,向两份等体积废水样品中加入等量H2O2和O3,其中一份再加入FeSO4,反应相同时间,实验结果如下图所示。

添加FeSO4后,次磷酸盐氧化率、磷元素沉淀率均显著提高,原因是___________ 。
(2)I.利用电化学高级氧化技术可以通过电解装置在电解槽中持续产生·OH,使处理含苯酚废水更加高效,装置如图所示。已知 a极主要发生的反应是 O2生成 H2O2,然后在电解液中产生·OH 并迅速与苯酚反应。

①b 极连接电源的___________ 极(填“正”或“负”)。
②a 极的电极反应式为___________ 。
③·OH与苯酚反应的化学方程式为___________ 。
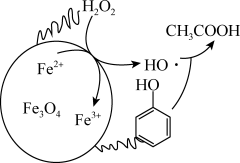
II. H2O2在Fe3O4催化下也可有效除去废水中的苯酚等有机污染物。除去废水中的苯酚的原理如图所示。研究在不同初始pH条件下,苯酚的去除率随时间的变化,结果表明:在反应开始时,初始pH=6的溶液中苯酚的去除率明显低于初始pH=3的溶液,但一段时间后两者接近,原因是___________ 。
 、苯酚等物质。
、苯酚等物质。(1)H2O2、O3在一定条件可处理废水中H2PO
 。
。①弱碱性条件下·OH将H2PO
 氧化成PO
氧化成PO ,该反应的离子方程式为
,该反应的离子方程式为②为比较不同投料方式下含H2PO
 模拟废水的处理效果,向两份等体积废水样品中加入等量H2O2和O3,其中一份再加入FeSO4,反应相同时间,实验结果如下图所示。
模拟废水的处理效果,向两份等体积废水样品中加入等量H2O2和O3,其中一份再加入FeSO4,反应相同时间,实验结果如下图所示。
添加FeSO4后,次磷酸盐氧化率、磷元素沉淀率均显著提高,原因是
(2)I.利用电化学高级氧化技术可以通过电解装置在电解槽中持续产生·OH,使处理含苯酚废水更加高效,装置如图所示。已知 a极主要发生的反应是 O2生成 H2O2,然后在电解液中产生·OH 并迅速与苯酚反应。

①b 极连接电源的
②a 极的电极反应式为
③·OH与苯酚反应的化学方程式为
II. H2O2在Fe3O4催化下也可有效除去废水中的苯酚等有机污染物。除去废水中的苯酚的原理如图所示。研究在不同初始pH条件下,苯酚的去除率随时间的变化,结果表明:在反应开始时,初始pH=6的溶液中苯酚的去除率明显低于初始pH=3的溶液,但一段时间后两者接近,原因是

您最近一年使用:0次



