电絮凝技术(EC)是一种集混凝、气浮、电化学于一体的新兴水处理技术,实验表明电絮凝技术能除去废水中96%以上的磷(主要以PO 形式存在)和油污,某化学兴趣小组用CH4燃料电池作为电源模拟电絮凝净水,装置如图所示。
形式存在)和油污,某化学兴趣小组用CH4燃料电池作为电源模拟电絮凝净水,装置如图所示。
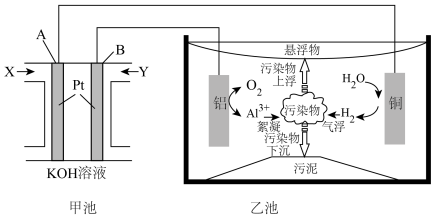
回答下列问题:
(1)燃料电池中OH-向___________ 极(填A或B)移动。写出A电极反应式___________ 。
(2)乙池中铜电极发生___________ 反应(填“氧化”或“还原”)。
(3)乙池铝电极上存在两个竞争反应,电极反应式分别为___________ ,___________ 。
(4)乙池由于电解过程中产生能吸附水中油污等污染物。用离子方程式说明净水的原因为___________ 。
 形式存在)和油污,某化学兴趣小组用CH4燃料电池作为电源模拟电絮凝净水,装置如图所示。
形式存在)和油污,某化学兴趣小组用CH4燃料电池作为电源模拟电絮凝净水,装置如图所示。
回答下列问题:
(1)燃料电池中OH-向
(2)乙池中铜电极发生
(3)乙池铝电极上存在两个竞争反应,电极反应式分别为
(4)乙池由于电解过程中产生能吸附水中油污等污染物。用离子方程式说明净水的原因为
更新时间:2024-01-31 12:43:13
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】饮用水中含有砷会导致砷中毒,水体中溶解的砷主要以As( Ⅲ)亚砷酸盐和As(V)砷酸盐形式存在。
(1)砷与磷为同一主族元素,磷的原子结构示意图为___________________ 。
(2)根据元素周期律,下列说法正确的是____________________ (填字母代号)。
a.最高价氧化物对应水化物的酸性:S>P>As b. 原子半径:S>P>As c.非金属性:S>P>As
(3)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成SO42-,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为_________________________ 。
(4)去除水体中的砷,可先将As(Ⅲ )转化为As(V),选用NaClO可实现该转化。
已知:投料前水样pH=5.81,0.1 mol/L NaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸。
研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果:
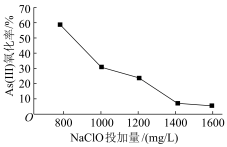
产生此结果的原因是_________________________ 。
(5)强阴离子交换柱可以吸附以阴离子形式存在的As(V),从而达到去除As的目的。
已知:一定条件下,As(V)的存在形式如下表所示:
pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是_____________________ 。
(1)砷与磷为同一主族元素,磷的原子结构示意图为
(2)根据元素周期律,下列说法正确的是
a.最高价氧化物对应水化物的酸性:S>P>As b. 原子半径:S>P>As c.非金属性:S>P>As
(3)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成SO42-,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为
(4)去除水体中的砷,可先将As(Ⅲ )转化为As(V),选用NaClO可实现该转化。
已知:投料前水样pH=5.81,0.1 mol/L NaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸。
研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果:

产生此结果的原因是
(5)强阴离子交换柱可以吸附以阴离子形式存在的As(V),从而达到去除As的目的。
已知:一定条件下,As(V)的存在形式如下表所示:
| pH | <2 | 2~7 | 7~11 | 11~14 |
| 存在形式 | H3AsO4 | H2AsO4- | HAsO42- | HAsO42-、AsO43- |
pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】I.2Al+Fe2O3 Al2O3+2Fe在化学反应过程中产生超高热,曾用于钢轨焊接。完成下列填空:
Al2O3+2Fe在化学反应过程中产生超高热,曾用于钢轨焊接。完成下列填空:
(1)氧元素在元素周期表中的位置为_______________ ,其离子结构示意图为__________ 。
(2)铝盐常用作净水剂,用文字和化学用语进行解释_____________________ 。
(3)氧的非金属性强于氮,用元素周期律知识分析原因_____________________ 。
(4)Al2O3与NaOH溶液反应的离子方程式为_____________________ 。
II.。
(5)NH4Al(SO4)2·12H2O水溶液呈_____ 性(选填“酸”、“碱”或“中”),比较溶液中离子浓度大小c( )
)_____ c(Al3+)(选填“>”、“<”或“=”)。
 Al2O3+2Fe在化学反应过程中产生超高热,曾用于钢轨焊接。完成下列填空:
Al2O3+2Fe在化学反应过程中产生超高热,曾用于钢轨焊接。完成下列填空:(1)氧元素在元素周期表中的位置为
(2)铝盐常用作净水剂,用文字和化学用语进行解释
(3)氧的非金属性强于氮,用元素周期律知识分析原因
(4)Al2O3与NaOH溶液反应的离子方程式为
II.。
(5)NH4Al(SO4)2·12H2O水溶液呈
 )
)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是__________________ 。(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1 NH4Al(SO4)2中c(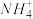 )
)________ (填“等于”“大于”或“小于”)0.1 mol·L-1 NH4HSO4中c(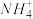 )。
)。
(3)0.1 mol·L-1电解质溶液的pH随温度变化的图象如图所示:

①其中符合0.1 mol·L-1 NH4Al(SO4)2的pH随温度变化的曲线是________ (填写序号),导致pH随温度变化的原因是__________________ ;
②20℃时,0.1mol·L-1NH4Al(SO4)2中2c( )-c(
)-c(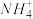 )-3c(Al3+)=
)-3c(Al3+)=________ (填数值)。
(1)NH4Al(SO4)2可作净水剂,其理由是
(2)相同条件下,0.1 mol·L-1 NH4Al(SO4)2中c(
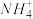 )
)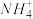 )。
)。(3)0.1 mol·L-1电解质溶液的pH随温度变化的图象如图所示:

①其中符合0.1 mol·L-1 NH4Al(SO4)2的pH随温度变化的曲线是
②20℃时,0.1mol·L-1NH4Al(SO4)2中2c(
 )-c(
)-c(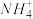 )-3c(Al3+)=
)-3c(Al3+)=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率,回答下列问题。
(1)化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的,图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:

该反应中,每生成1molNO(g),放出(或吸收)热量___________ kJ。
(2)下列变化中,属于吸热反应的是___________ (填序号)。
a.铝片与稀盐酸的反应
b. 晶体与NH4Cl晶体混合反应
晶体与NH4Cl晶体混合反应
c.铁在氯气中燃烧
d.氯酸钾分解制氧气
e.生石灰与水反应生成熟石灰
(3)如图是甲烷燃料电池的原理示意图:

①电池的正极是___________ (填“a”或“b”)电极,负极的电极反应式为___________ 。
②电池工作一段时间后,电解质溶液的pH___________ (填“增大”、“减小”或“不变”)。
(4)某温度下,在一个2L的恒容密闭容器中,X、Y、Z三种气体(均不是稀有气体)物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白:

①从开始至2min,X的平均反应速率为___________ ;
②下列措施能加快反应速率的是___________ (填序号,下同)。
A.往容器中充入He B.升高温度
C.减少X气体的通入量 D.选择高效的催化剂
③下列能说明反应已达平衡的是___________ 。
A.X、Y、Z三种物质的浓度相等
B.混合气体的物质的量不再改变
C.反应速率
D.混合气体的密度不随时间变化而变化
E.容器中Z的体积分数不变
(1)化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的,图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:

该反应中,每生成1molNO(g),放出(或吸收)热量
(2)下列变化中,属于吸热反应的是
a.铝片与稀盐酸的反应
b.
 晶体与NH4Cl晶体混合反应
晶体与NH4Cl晶体混合反应c.铁在氯气中燃烧
d.氯酸钾分解制氧气
e.生石灰与水反应生成熟石灰
(3)如图是甲烷燃料电池的原理示意图:

①电池的正极是
②电池工作一段时间后,电解质溶液的pH
(4)某温度下,在一个2L的恒容密闭容器中,X、Y、Z三种气体(均不是稀有气体)物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白:

①从开始至2min,X的平均反应速率为
②下列措施能加快反应速率的是
A.往容器中充入He B.升高温度
C.减少X气体的通入量 D.选择高效的催化剂
③下列能说明反应已达平衡的是
A.X、Y、Z三种物质的浓度相等
B.混合气体的物质的量不再改变
C.反应速率

D.混合气体的密度不随时间变化而变化
E.容器中Z的体积分数不变
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】(1)依据氧化还原反应2Ag+(ag)+Cu(s)==Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
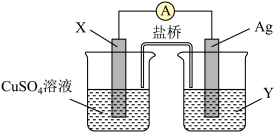
电极X的材料是_______ ;电解质溶液Y是_________________ ;银电极为电池的________ 极,发生的电极反应为______________________ ;X电极上发生的电极反应为______________________ 。
(2)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入CH4和O2,该电池即为氢氧燃料电池,
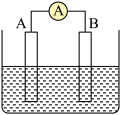
写出A电极反应式:___________________________________ ;写出B电极反应式:_______________________ ;写出该电池反应:__________ 。

电极X的材料是
(2)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入CH4和O2,该电池即为氢氧燃料电池,

写出A电极反应式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】人们应用电化学原理满足不同的需要。以下每小题中的电化学原理广泛应用于日常生活、生产和科学技术等方面,请根据题中提供的信息填空。
(1)蓄电池在放电时起原电池作用,在充电时起电解池的作用。铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。负极反应式为____ ,反应一段时间后负极的质量____ (填“增加”“减少”或“不变”)。
(2)燃料电池是一种高效、环境友好的供电装置,如图是甲烷燃料电池原理示意图,

该电池的负极反应式是:____ ;正极反应式为____ 。
(3)如图为电解精炼银的示意图,____ (填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为____ 。

(4)为处理银器表面的黑斑(Ag2S),将银器浸于铝质容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为____ 。
(1)蓄电池在放电时起原电池作用,在充电时起电解池的作用。铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。负极反应式为
(2)燃料电池是一种高效、环境友好的供电装置,如图是甲烷燃料电池原理示意图,

该电池的负极反应式是:
(3)如图为电解精炼银的示意图,

(4)为处理银器表面的黑斑(Ag2S),将银器浸于铝质容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】回答下列电化学问题:
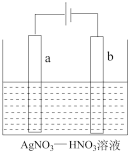
(1)如图为电解精炼银的示意图,___ (填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为_________________ 。
(2)通过NOx传感器可监测NOx的含量,其工作原理示意图如图所示:
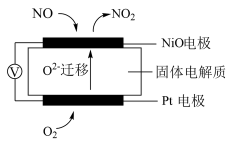
①Pt电极上发生的是________ 反应(填“氧化”或“还原”),
②写出NiO电极的电极反应式:______________________ 。
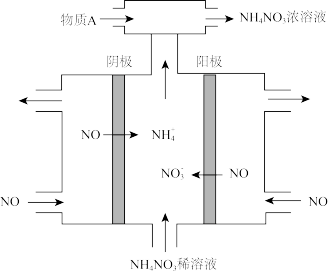
(3)电解NO制备NH4NO3的工作原理如图所示,其中阳极的电极反应式:_____________ ,为使电解产物全部转化为NH4NO3,需补充物质A,则A可以是______ 。
(1)如图为电解精炼银的示意图,

(2)通过NOx传感器可监测NOx的含量,其工作原理示意图如图所示:

①Pt电极上发生的是
②写出NiO电极的电极反应式:
(3)电解NO制备NH4NO3的工作原理如图所示,其中阳极的电极反应式:

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色。试完成以下问题:
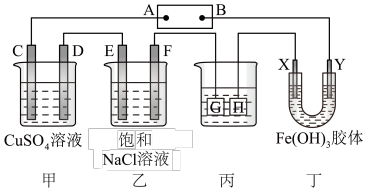
(1)电源A极的名称是________ 。
(2)甲装置中电解反应的总化学方程式是____________ 。
(3)如果收集乙装置中产生的气体,两种气体的体积比是________ 。
(4)欲用丙装置给铜镀银,G应该是________ (填“铜”或“银”),电镀液的主要成分是________ (填化学式) 。
(5)装置丁的现象是________ ,说明________ 。

(1)电源A极的名称是
(2)甲装置中电解反应的总化学方程式是
(3)如果收集乙装置中产生的气体,两种气体的体积比是
(4)欲用丙装置给铜镀银,G应该是
(5)装置丁的现象是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】某小组同学设想利用燃料电池和电解池组合,设计一种制备硫酸和氨的装置,相关的物质及工作原理示意图如图。a、b、c、d均为惰性电极,电解池中d上有可催化N2放电的纳米颗粒,固体氧化物电解质只允许O2-在其中迁移。
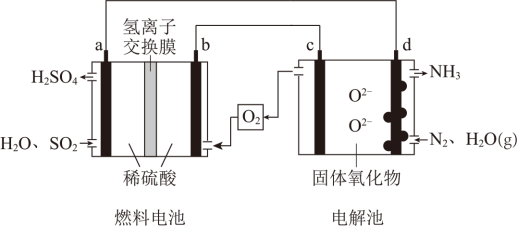
(1)燃料电池制备硫酸。
①a为_____ (填“正极”或“负极”),电极反应式为_____ 。
②H+的迁移方向为______ (填“a→b”或“b→a”)。
③电池总反应的化学方程式为______ 。
(2)电解池制备氨。下列关于电解过程的说法正确的是_____ 。
A.d上,N2被还原
B.c的电极反应:2O2--4e-=O2↑
C.固体氧化物中O2-的迁移方向为d→c
(3)燃料电池中每消耗48gSO2,在电解池中,理论上产生的NH3在标准状况下的体积为_____ L。

(1)燃料电池制备硫酸。
①a为
②H+的迁移方向为
③电池总反应的化学方程式为
(2)电解池制备氨。下列关于电解过程的说法正确的是
A.d上,N2被还原
B.c的电极反应:2O2--4e-=O2↑
C.固体氧化物中O2-的迁移方向为d→c
(3)燃料电池中每消耗48gSO2,在电解池中,理论上产生的NH3在标准状况下的体积为
您最近一年使用:0次
【推荐1】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为离子交换膜。请按要求回答相关问题:
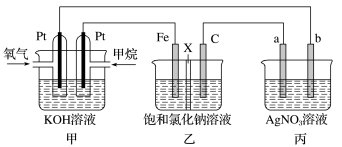
(1)甲装置中通入___________ 一极是负极。
(2)乙中X是___________ (阴、阳)离子交换膜,向乙中加入几滴酚酞溶液,工作一段时间后___________ 电极(填Fe或C)附近溶液变红,请用化学用语解释相关原因___________ 。
(3)若在标准状况下,有 氧气参加反应,则乙装置中C电极上生成的气体的物质的量为
氧气参加反应,则乙装置中C电极上生成的气体的物质的量为___________ 。
(4)若丙装置中a、b电极均为 ,则丙池电解的总反应离子方程式是
,则丙池电解的总反应离子方程式是___________ 。
(5)化学在环境保护中起十分重要的作用,电化学降解法可用于治理水中硝酸盐污染,电化学降解 的原理如图所示:
的原理如图所示:

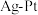 电极上的电极反应式为
电极上的电极反应式为___________ 。

(1)甲装置中通入
(2)乙中X是
(3)若在标准状况下,有
 氧气参加反应,则乙装置中C电极上生成的气体的物质的量为
氧气参加反应,则乙装置中C电极上生成的气体的物质的量为(4)若丙装置中a、b电极均为
 ,则丙池电解的总反应离子方程式是
,则丙池电解的总反应离子方程式是(5)化学在环境保护中起十分重要的作用,电化学降解法可用于治理水中硝酸盐污染,电化学降解
 的原理如图所示:
的原理如图所示:
 电极上的电极反应式为
电极上的电极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】氮及其化合物在工农业生产和生命活动中起着重要的作用。回答下列问题:
(1)“中国制造2025”是中国政府实施制造强国战略第一 个十年行动纲领。氮化铬在现代工业中发挥更重要的作用,请写出Cr3+的价电子轨道表示式___________ ;基态铬、氮原子的未成对电子数之比为___________ 。
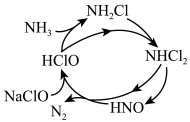
(2)NH3也是造成水体富营养化的重要原因之一,用NaClO溶液氧化可除去氨气。其反应机理如图所示(其中H2O和NaCl 略去)。NaClO 氧化NH3的总反应化学程式为___________ 。
(3)改变 对溶液中NaClO去除氨气效果与余氯(溶液中+1价氯元素的含量)的影响如图所示,则除氨气过程中最佳的
对溶液中NaClO去除氨气效果与余氯(溶液中+1价氯元素的含量)的影响如图所示,则除氨气过程中最佳的 值约为
值约为___________ 。

(4)室温下,用水稀释0.1mol·L-1氨水,溶液中随着水量的增加而减小的是___________。
(5)25°C时,将amol NH4NO3溶于水,向该溶液中滴加bL氨水后溶液呈中性,滴加氨水的过程中水的电离平衡将___________ (填 “正向”、“逆向”或“不”)移动。
(6)工业上利用NH3制备联氨(N2H4)装置如下图,其阳极电极反应式为___________ 。
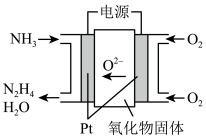
(1)“中国制造2025”是中国政府实施制造强国战略第一 个十年行动纲领。氮化铬在现代工业中发挥更重要的作用,请写出Cr3+的价电子轨道表示式
(2)NH3也是造成水体富营养化的重要原因之一,用NaClO溶液氧化可除去氨气。其反应机理如图所示(其中H2O和NaCl 略去)。NaClO 氧化NH3的总反应化学程式为

(3)改变
 对溶液中NaClO去除氨气效果与余氯(溶液中+1价氯元素的含量)的影响如图所示,则除氨气过程中最佳的
对溶液中NaClO去除氨气效果与余氯(溶液中+1价氯元素的含量)的影响如图所示,则除氨气过程中最佳的 值约为
值约为
(4)室温下,用水稀释0.1mol·L-1氨水,溶液中随着水量的增加而减小的是___________。
A.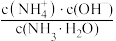 ) ) | B.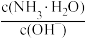 |
| C.c(H+) | D.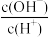 |
(6)工业上利用NH3制备联氨(N2H4)装置如下图,其阳极电极反应式为

您最近一年使用:0次

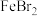 溶液中通入足量氯气:
溶液中通入足量氯气: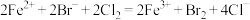
 饱和溶液:
饱和溶液: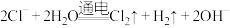
 溶液中通入二氧化碳气体:
溶液中通入二氧化碳气体: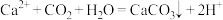
 溶液中加入稀硫酸:
溶液中加入稀硫酸: