Ⅰ.硫酸酸化的高锰酸钾溶液与草酸发生化学反应,反应如下:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,某化学兴趣小组为了测定草酸浓度,主要做了如下实验。用0.1000mol/L酸性高锰酸钾溶液滴定未知浓度的H2C2O4溶液。实验中测得的数据记录如下:
回答问题:
(1)配制KMnO4标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要图中的______ (填字母代号)。

(2)用配制好的高锰酸钾滴定草酸时,高锰酸钾溶液应盛装于______ 滴定管。滴定时,眼睛应注视______ 。
(3)该实验中未使用指示剂就可判断终点,到达终点的判断标志是________ 。
(4)根据表中数据,计算H2C2O4溶液的浓度_________ 。
(5)下列造成H2C2O4溶液的浓度偏高的是________。
Ⅱ.氧化还原滴定,可用于 粗产品的纯度测定。
粗产品的纯度测定。
称取m g产品配成250mL溶液,取25.00mL溶液加入足量的KI和稀H2SO4,充分反应后加入淀粉溶液作指示剂,用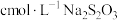 标准溶液滴定至终点(
标准溶液滴定至终点( ),平均消耗标准溶液的体积为VmL。
),平均消耗标准溶液的体积为VmL。
(6)加入KI和稀 后发生反应的离子方程式为
后发生反应的离子方程式为_________ 。
(7)滴定终点的现象为________ ,则产品中 的质量分数为
的质量分数为_______ %。
| 滴定次数 | H2C2O4体积 | 滴定前KMnO4体积 | 终点时KMnO4体积 |
| 1 | 25.00mL | 0.00mL | 21.41mL |
| 2 | 25.00mL | 0.02mL | 21.44mL |
| 3 | 25.00mL | 1.04mL | 22.47mL |
| 4 | 25.00mL | 0.04mL | 24.46 mL |
(1)配制KMnO4标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要图中的

(2)用配制好的高锰酸钾滴定草酸时,高锰酸钾溶液应盛装于
(3)该实验中未使用指示剂就可判断终点,到达终点的判断标志是
(4)根据表中数据,计算H2C2O4溶液的浓度
(5)下列造成H2C2O4溶液的浓度偏高的是________。
| A.滴定终点读数时俯视 | B.滴定前有气泡,滴定后气泡消失 |
| C.润洗锥形瓶 | D.滴定过程中加入少量蒸馏水冲洗瓶壁 |
Ⅱ.氧化还原滴定,可用于
 粗产品的纯度测定。
粗产品的纯度测定。称取m g产品配成250mL溶液,取25.00mL溶液加入足量的KI和稀H2SO4,充分反应后加入淀粉溶液作指示剂,用
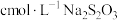 标准溶液滴定至终点(
标准溶液滴定至终点( ),平均消耗标准溶液的体积为VmL。
),平均消耗标准溶液的体积为VmL。(6)加入KI和稀
 后发生反应的离子方程式为
后发生反应的离子方程式为(7)滴定终点的现象为
 的质量分数为
的质量分数为
更新时间:2024-02-07 17:02:21
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】铝镁合金已成为轮船制造、化工生产等行业的重要材料。某研究性学习小组的两位同学为测定某铝镁合金(不含其他元素)中铝的质量分数,设计下列两种不同实验方案进行探究。填写下列空白:
探究一、实验方案:
(1)铝镁合金 测定剩余固体质量。实验中发生反应的化学方程式是
测定剩余固体质量。实验中发生反应的化学方程式是___________ 。称取5.4g铝镁合金粉末样品,投入体积为 、浓度为4.0mol/L的
、浓度为4.0mol/L的 溶液中,充分反应。为保证合金充分反应,
溶液中,充分反应。为保证合金充分反应, 溶液的体积
溶液的体积
___________ mL。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得铝的质量分数将___________ (填“偏大”或“偏小”)。
探究二、实验方案:称取3.9g铝镁合金 测定生成气体的体积(实验装置如图所示)。
测定生成气体的体积(实验装置如图所示)。

(3)盛装盐酸的仪器名称为___________ 。
(4)为使测定结果尽可能精确,实验中应注意的问题有___________(填序号)。
(5)经测定生成的气体体积为4.48L(已折算为标准状况下的体积),计算该铝镁合金中铝的质量分数为___________ 。(保留到小数点后1位)
探究一、实验方案:
(1)铝镁合金
 测定剩余固体质量。实验中发生反应的化学方程式是
测定剩余固体质量。实验中发生反应的化学方程式是 、浓度为4.0mol/L的
、浓度为4.0mol/L的 溶液中,充分反应。为保证合金充分反应,
溶液中,充分反应。为保证合金充分反应, 溶液的体积
溶液的体积
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得铝的质量分数将
探究二、实验方案:称取3.9g铝镁合金
 测定生成气体的体积(实验装置如图所示)。
测定生成气体的体积(实验装置如图所示)。
(3)盛装盐酸的仪器名称为
(4)为使测定结果尽可能精确,实验中应注意的问题有___________(填序号)。
| A.检查装置的气密性 | B.加入足量盐酸 |
| C.调整量气管C的高度,使C中液面与B中液面相平 | D.待冷却至室温再读体积 |
(5)经测定生成的气体体积为4.48L(已折算为标准状况下的体积),计算该铝镁合金中铝的质量分数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】利用FeCl3溶液作为腐蚀液,将覆铜板上的铜腐蚀,可以制作印刷电路板。使用后的腐蚀液进行处理,可以实现资源的充分利用。
(1)印刷电路板腐蚀过程中发生的离子反应方程式为_______ 。
(2)使用后的腐蚀液可以用来处理含H2S的废气。转化过程原理如图所示。

①在图示的物质转化中,作为氧化剂的微粒有_______ 。
②过程II中发生反应的离子反应方程式为_______ 。
③该转化总的过程可简单描述为_______ 。
(3)准确量取25.00 mL使用后的腐蚀液于100mL容量瓶中,加水稀释至刻度;准确量取20.00mL稀释后的溶液,加足量AgNO3溶液充分反应后,过滤、洗涤、干燥得沉淀5.1660g。计算原FeCl3溶液物质的量浓度_______ (写出计算过程)。假设腐蚀过程中溶液体积不变。
(1)印刷电路板腐蚀过程中发生的离子反应方程式为
(2)使用后的腐蚀液可以用来处理含H2S的废气。转化过程原理如图所示。

①在图示的物质转化中,作为氧化剂的微粒有
②过程II中发生反应的离子反应方程式为
③该转化总的过程可简单描述为
(3)准确量取25.00 mL使用后的腐蚀液于100mL容量瓶中,加水稀释至刻度;准确量取20.00mL稀释后的溶液,加足量AgNO3溶液充分反应后,过滤、洗涤、干燥得沉淀5.1660g。计算原FeCl3溶液物质的量浓度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】实验室模拟工业以NH3和CS2为原料制备KSCN的实验装置如图所示:
已知:①NH3不溶于CS2,CS2密度比水大且难溶于水;②三颈烧瓶内盛放CS2、水和催化剂,发生反应:CS2+3NH3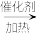 NH4SCN+NH4HS,该反应比较缓慢,且NH4SCN高于170℃易分解。③KSCN的溶解度随温度变化较大。
NH4SCN+NH4HS,该反应比较缓慢,且NH4SCN高于170℃易分解。③KSCN的溶解度随温度变化较大。

(1)装置A中的烧瓶内固体可选用__ (填字母),装置B可以选用__ (填字母)。
A.碳酸氢铵 B.生石灰 C.碱石灰 D.二氧化锰 E.氯化钙
(2)三颈烧瓶内的导气管插入下层 CS2液体中,原因是__ 。
(3)待实验中观察到三颈烧瓶内液体不分层时,关闭A处分液漏斗活塞,待D中无气泡产生时关闭K1保持三颈烧瓶内恒温105℃一段时间,使NH4HS=NH3↑+H2S↑进行完全后,打开K2,继续保持恒温105℃,滴入适量的KOH溶液,写出生成KSCN的化学方程式__ 。
(4)装置E的作用__ ,写出E中生成浅黄色沉淀的离子方程式__ 。
(5)反应结束后将三颈烧瓶中的固体催化剂滤去,得到硫氰化钾粗品,经过__ (填操作名称)可将硫氰化钾晶体纯化。
(6)晶体中KSCN含量的测定:称取10.00g样品,配成1000mL溶液。量取25.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴a作指示剂,用0.1000mol•L-1AgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液数据如下。(已知:滴定时发生的反应为SCN-+Ag+=AgSCN↓(白色))
①指示剂a为__ 。
②晶体中KSCN的质量分数为__ %。
已知:①NH3不溶于CS2,CS2密度比水大且难溶于水;②三颈烧瓶内盛放CS2、水和催化剂,发生反应:CS2+3NH3
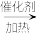 NH4SCN+NH4HS,该反应比较缓慢,且NH4SCN高于170℃易分解。③KSCN的溶解度随温度变化较大。
NH4SCN+NH4HS,该反应比较缓慢,且NH4SCN高于170℃易分解。③KSCN的溶解度随温度变化较大。
(1)装置A中的烧瓶内固体可选用
A.碳酸氢铵 B.生石灰 C.碱石灰 D.二氧化锰 E.氯化钙
(2)三颈烧瓶内的导气管插入
(3)待实验中观察到三颈烧瓶内液体不分层时,关闭A处分液漏斗活塞,待D中无气泡产生时关闭K1保持三颈烧瓶内恒温105℃一段时间,使NH4HS=NH3↑+H2S↑进行完全后,打开K2,继续保持恒温105℃,滴入适量的KOH溶液,写出生成KSCN的化学方程式
(4)装置E的作用
(5)反应结束后将三颈烧瓶中的固体催化剂滤去,得到硫氰化钾粗品,经过
(6)晶体中KSCN含量的测定:称取10.00g样品,配成1000mL溶液。量取25.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴a作指示剂,用0.1000mol•L-1AgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液数据如下。(已知:滴定时发生的反应为SCN-+Ag+=AgSCN↓(白色))
| 序号 | 1 | 2 | 3 | 4 |
| 标准溶液体积/mL | 20.05 | 18.40 | 19.95 | 20.00 |
②晶体中KSCN的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】实验室用 通入
通入 和
和 的混合溶液中来制备
的混合溶液中来制备 并测定所得产品纯度。
并测定所得产品纯度。

已知:① 易溶于水,难溶于乙醇,温度高于
易溶于水,难溶于乙醇,温度高于 易失去结晶水。
易失去结晶水。
②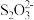 酸性条件下易发生反应:
酸性条件下易发生反应: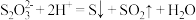 。
。
实验步骤:
Ⅰ. 的制备:装置B产生的
的制备:装置B产生的 缓慢的通入装置
缓慢的通入装置 中
中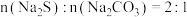 的混合溶液,加热并搅拌至溶液
的混合溶液,加热并搅拌至溶液 约为7时,停止通入
约为7时,停止通入 ,停止搅拌和加热得混合溶液。
,停止搅拌和加热得混合溶液。
Ⅱ.产品分离提纯:将 中混合溶液,经操作(a)、过滤、洗涤、干燥,得到
中混合溶液,经操作(a)、过滤、洗涤、干燥,得到 粗产品。
粗产品。
Ⅲ.产品纯度测定:取 产品配制成
产品配制成 溶液,取出
溶液,取出 置于锥形瓶中,加入淀粉溶液作指示剂,用
置于锥形瓶中,加入淀粉溶液作指示剂,用 的碘标准溶液滴定至终点,发生反应:
的碘标准溶液滴定至终点,发生反应: ,滴定三次平均消耗碘溶液
,滴定三次平均消耗碘溶液 ,计算样品中
,计算样品中 纯度。
纯度。
请回答:
(1)装置 的名称为
的名称为_________ .
(2)制取 的反应的化学方程式为
的反应的化学方程式为__________________ ;C中反应结束时混合溶液 过高或过低将导致
过高或过低将导致 产率降低,原因是
产率降低,原因是_________ .
(3)Ⅱ为产品的分离提纯
①操作(a)为_________ ,为减少产品损失,粗产品可以用_________ 洗涤。
②从下图选出Ⅱ中可能使用到的仪器_________ .
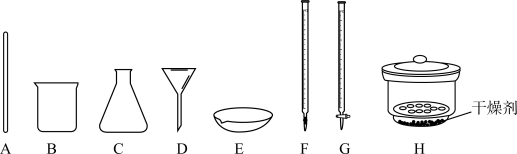
(4)Ⅲ为氧化还原滴定法测定样品中 的纯度
的纯度
①滴定终点的现象是__________________ .
②样品中 的纯度为
的纯度为_________ .
 通入
通入 和
和 的混合溶液中来制备
的混合溶液中来制备 并测定所得产品纯度。
并测定所得产品纯度。
已知:①
 易溶于水,难溶于乙醇,温度高于
易溶于水,难溶于乙醇,温度高于 易失去结晶水。
易失去结晶水。②
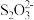 酸性条件下易发生反应:
酸性条件下易发生反应: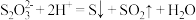 。
。实验步骤:
Ⅰ.
 的制备:装置B产生的
的制备:装置B产生的 缓慢的通入装置
缓慢的通入装置 中
中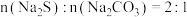 的混合溶液,加热并搅拌至溶液
的混合溶液,加热并搅拌至溶液 约为7时,停止通入
约为7时,停止通入 ,停止搅拌和加热得混合溶液。
,停止搅拌和加热得混合溶液。Ⅱ.产品分离提纯:将
 中混合溶液,经操作(a)、过滤、洗涤、干燥,得到
中混合溶液,经操作(a)、过滤、洗涤、干燥,得到 粗产品。
粗产品。Ⅲ.产品纯度测定:取
 产品配制成
产品配制成 溶液,取出
溶液,取出 置于锥形瓶中,加入淀粉溶液作指示剂,用
置于锥形瓶中,加入淀粉溶液作指示剂,用 的碘标准溶液滴定至终点,发生反应:
的碘标准溶液滴定至终点,发生反应: ,滴定三次平均消耗碘溶液
,滴定三次平均消耗碘溶液 ,计算样品中
,计算样品中 纯度。
纯度。请回答:
(1)装置
 的名称为
的名称为(2)制取
 的反应的化学方程式为
的反应的化学方程式为 过高或过低将导致
过高或过低将导致 产率降低,原因是
产率降低,原因是(3)Ⅱ为产品的分离提纯
①操作(a)为
②从下图选出Ⅱ中可能使用到的仪器

(4)Ⅲ为氧化还原滴定法测定样品中
 的纯度
的纯度①滴定终点的现象是
②样品中
 的纯度为
的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】草酸晶体的化学式可表示为H2C2O4·xH2O,为测定x值进行下列实验:
①称取W g草酸晶体,配成100.00 mL溶液。
②取25.00 mL所配溶液置于锥形瓶中,加入适量稀硫酸后,用浓度为a mol·L-1KMnO4溶液滴定。KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O(未配平)
回答下列问题:
(1)实验①中,为配制准确的草酸溶液,必须使用的仪器有_______ ;
(2)实验②中,滴定时,KMnO4溶液应盛在_______ 中(填酸式或碱式滴定管);
(3)若滴定用的KMnO4溶液因放置而变质,浓度偏低,则根据实验求出的x值_______ (填偏高、偏低、无影响);
(4)滴定终点时,锥形瓶内溶液颜色变化是_______ ;
(5)若滴定终点时,共用去KMnO4溶液V mL,求草酸溶液的物质的量浓度及x的值:_______ , _______ 。
①称取W g草酸晶体,配成100.00 mL溶液。
②取25.00 mL所配溶液置于锥形瓶中,加入适量稀硫酸后,用浓度为a mol·L-1KMnO4溶液滴定。KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O(未配平)
回答下列问题:
(1)实验①中,为配制准确的草酸溶液,必须使用的仪器有
(2)实验②中,滴定时,KMnO4溶液应盛在
(3)若滴定用的KMnO4溶液因放置而变质,浓度偏低,则根据实验求出的x值
(4)滴定终点时,锥形瓶内溶液颜色变化是
(5)若滴定终点时,共用去KMnO4溶液V mL,求草酸溶液的物质的量浓度及x的值:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】实验室由甲苯制备苯甲酸的反应式如下:
①烧瓶最适宜规格为_______ mL,仪器A中应加入_______ (填“水”或“油”)作为热传导介质。
②仪器B的名称是_______ 。当烧瓶中出现_______ (填写现象)时停止加热。
(2)①从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,其目的是_______ ;反应后的混合物趁热过滤,用少量_______ (填热水或冷水)洗涤滤渣。该滤渣的主要成份是_______ (填化学式)。烧瓶中发生反应的离子方程式是_______ 。
②滤液和洗涤液合并,用浓盐酸酸化后于冰水浴中冷却、过滤、洗涤、干燥、称量,得粗产品1.0g。冰水浴中冷却的目的是_______ 。
(3)苯甲酸纯度测定
①称取0.122g粗产品,用乙醇溶解配成100mL溶液,每次移取25.00mL溶液于锥形瓶中,并加入几滴_______ (填指示剂名称),用0.01000mol⋅L-1的KOH标准溶液滴定,滴定终点的现象是_______ 。
②三次滴定平均消耗21.50mL的KOH标准溶液。本实验制备的苯甲酸的纯度为_______ %。
③将粗产品进行提纯得到更纯净的苯甲酸,常用实验方法的名称是_______ 。
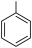 +KMnO4
+KMnO4
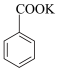 +MnO2
+MnO2  +HCl→
+HCl→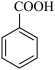 +KCl
+KCl
| 名称 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度,/(g·mL ) ) | 溶解性 |
| 甲苯 | 92 | -95 | 110.6 | 0.867 | 不溶于水,易溶于乙醇 |
| 苯甲酸 | 122 | 122.4(100℃左右开始升华) | 248 | —— | 微溶于冷水,易溶于乙醇、热水 |
(1)制备 的装置如下图所示:
的装置如下图所示:
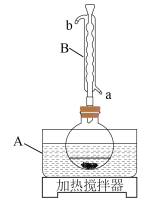
①烧瓶最适宜规格为
②仪器B的名称是
(2)①从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,其目的是
②滤液和洗涤液合并,用浓盐酸酸化后于冰水浴中冷却、过滤、洗涤、干燥、称量,得粗产品1.0g。冰水浴中冷却的目的是
(3)苯甲酸纯度测定
①称取0.122g粗产品,用乙醇溶解配成100mL溶液,每次移取25.00mL溶液于锥形瓶中,并加入几滴
②三次滴定平均消耗21.50mL的KOH标准溶液。本实验制备的苯甲酸的纯度为
③将粗产品进行提纯得到更纯净的苯甲酸,常用实验方法的名称是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】用质量分数为375%的浓盐酸密度为116 g/cm3配制250mL浓度为1mol/L的稀盐酸。试回答下列问题:
(1)配制稀盐酸时,应选用容量为______ mL的容量瓶;
(2)经计算需要______ mL浓盐酸,在量取时宜选用下列量筒中的______ 。(填字母)
A. 5 mL B. 10 mL C. 25 mL D. 50 mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释后的盐酸温度与室温一致后,沿玻璃棒将盐酸注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面接近环形标线2~3 cm处,改用胶头滴管加蒸馏水,使溶液的凹面底部与瓶颈的环形标线相切。
③在盛盐酸的烧杯中注入蒸馏水几十毫升,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)________________________ 。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是__________ (填“偏高”、“偏低”、“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是_______ (填“偏高”、“偏低”、“无影响”)。
(5)配制完后,应将容量瓶中的稀盐酸转移到_______ 中存放,并贴上标签。
(1)配制稀盐酸时,应选用容量为
(2)经计算需要
A. 5 mL B. 10 mL C. 25 mL D. 50 mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释后的盐酸温度与室温一致后,沿玻璃棒将盐酸注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面接近环形标线2~3 cm处,改用胶头滴管加蒸馏水,使溶液的凹面底部与瓶颈的环形标线相切。
③在盛盐酸的烧杯中注入蒸馏水几十毫升,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是
(5)配制完后,应将容量瓶中的稀盐酸转移到
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】“84消毒液”是一种以NaClO为主的高效消毒剂。某“84消毒液”瓶体部分标签如图1所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)配制100g24%84消毒液需要水多少______ g.需要的玻璃仪器有烧杯,玻璃棒______ (填名称)
(2)此“84消毒液”的物质的量浓度约为______ mol/L。(计算结果保留一位小数)
(3)某同学量取100mL此“84消毒液”,按说明要求稀释后用于消毒,则稀释后的溶液中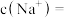
______ mol/L。
该同学参阅“84消毒液”的配方,欲用NaClO固体配制500mL含NaClO质量分数为24%的消毒液。
(4)如图2所示的仪器中配制溶液需要使用的是______ (填仪器序号),
(5)下列操作中,容量瓶不具备的功能是______ (填序号)。
a.配制一定体积准确浓度的标准溶液 b.贮存溶液
c.测量容量瓶规格以下的任意体积的溶液 d.准确稀释某一浓度的溶液
e.用来加热溶解固体溶质
(6)若实验遇下列情况,导致所配溶液的物质的量浓度偏高的是______。(填序号)。

(1)配制100g24%84消毒液需要水多少
(2)此“84消毒液”的物质的量浓度约为
(3)某同学量取100mL此“84消毒液”,按说明要求稀释后用于消毒,则稀释后的溶液中
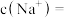
该同学参阅“84消毒液”的配方,欲用NaClO固体配制500mL含NaClO质量分数为24%的消毒液。
(4)如图2所示的仪器中配制溶液需要使用的是
(5)下列操作中,容量瓶不具备的功能是
a.配制一定体积准确浓度的标准溶液 b.贮存溶液
c.测量容量瓶规格以下的任意体积的溶液 d.准确稀释某一浓度的溶液
e.用来加热溶解固体溶质
(6)若实验遇下列情况,导致所配溶液的物质的量浓度偏高的是______。(填序号)。
| A.定容时俯视刻度线 | B.转移前,容量瓶内有蒸馏水 |
| C.未冷至室温就转移定容 | D.定容时水多用胶头滴管吸出 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】I. 和
和 是两种常见的钠盐。向
是两种常见的钠盐。向 和
和 的混合溶液中逐滴滴加盐酸,所得气体的体积与所加盐酸的体积关系如图所示。
的混合溶液中逐滴滴加盐酸,所得气体的体积与所加盐酸的体积关系如图所示。
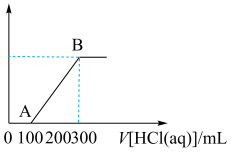
(1)OA段发生反应的离子方程式:_______ 。
(2)原溶液中碳酸钠和碳酸氢钠的物质的量之比为_______ 。
Ⅱ.实验室中需0.2mol/L的 溶液80mL,请回答下列问题。
溶液80mL,请回答下列问题。
(3)配制上述溶液所需的玻璃 仪器有:玻璃棒、烧杯、胶头滴管和_______ 。
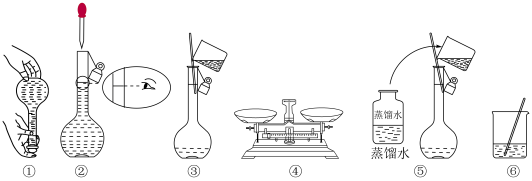
(4)实验时下图所示操作的先后顺序为_______ (填编号)。
(5)取用任意体积的该 溶液时,下列物理量不随所取体积的多少而变化的是
溶液时,下列物理量不随所取体积的多少而变化的是_______ 。
a.溶液中 的物质的量 b.溶液的浓度
的物质的量 b.溶液的浓度
c.溶液中 的数目 d.溶液的密度
的数目 d.溶液的密度
(6)下列操作中,会造成溶液浓度有何变化(填偏高,偏低,无影响)。
①定容时,俯视刻度线_______ 。
②未冷却至室温就开始定容_______ 。
 和
和 是两种常见的钠盐。向
是两种常见的钠盐。向 和
和 的混合溶液中逐滴滴加盐酸,所得气体的体积与所加盐酸的体积关系如图所示。
的混合溶液中逐滴滴加盐酸,所得气体的体积与所加盐酸的体积关系如图所示。
(1)OA段发生反应的离子方程式:
(2)原溶液中碳酸钠和碳酸氢钠的物质的量之比为
Ⅱ.实验室中需0.2mol/L的
 溶液80mL,请回答下列问题。
溶液80mL,请回答下列问题。(3)配制上述溶液所需的
(4)实验时下图所示操作的先后顺序为

(5)取用任意体积的该
 溶液时,下列物理量不随所取体积的多少而变化的是
溶液时,下列物理量不随所取体积的多少而变化的是a.溶液中
 的物质的量 b.溶液的浓度
的物质的量 b.溶液的浓度c.溶液中
 的数目 d.溶液的密度
的数目 d.溶液的密度(6)下列操作中,会造成溶液浓度有何变化(填偏高,偏低,无影响)。
①定容时,俯视刻度线
②未冷却至室温就开始定容
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】草酸(H2C2O4)是一种重要的有机化工原料。为探究草酸的制取、性质及应用,进行如下实验。
实验Ⅰ:草酸晶体的制备
实验室用硝酸氧化淀粉水解液法制备草酸,装置如图所示:
①一定量的淀粉水解液加入三颈烧瓶中
②控制反应温度55-60℃,边搅拌边缓慢滴加一定量的混合酸
③反应3小时,冷却,抽滤后再重结晶得到草酸晶体。
(1)上图实验装置中仪器甲的名称为________ 。冷凝水的进口是________ (填“a”或“b”)。
(2)检验淀粉是否水解完全所需要的试剂为______________ 。
实验Ⅱ:探究草酸与酸性高锰酸钾溶液的反应
(3)向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,可推测草酸可能具有________ 性。反应速率开始很慢,后来逐渐加快,可能的原因是_________ 。写出反应的离子方程式________________ 。
实验Ⅲ:草酸性质的应用
利用比H2C2O4与酸性KMnO4溶液反应探究“条件对化学反应速率的影响。”实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。设计方案如下:
(4)为了观察到紫色褪去,H2C2O4与KMnO4溶液初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥________ 。
(5)探究温度对化学反应速率影响的实验编号是___________ ,探究反应物浓度对化学反应速率影响的实验编号是__________ 。
实验Ⅳ:草酸晶体中结晶水测定
草酸晶体的化学式可表示为H2C2O4•xH2O,为测定x的值,进行下列实验:
①称取6.3g某草酸晶体配成100. 0mL的水溶液。
②取25.00mL所配溶液置于锥形瓶中,加入适量稀H2SO4,用浓度为0.5mol/L的KMnO4溶液滴定,滴定终点时消耗KMnO4的体积为10.00mL。
(6)计算x=________ 。
实验Ⅰ:草酸晶体的制备
实验室用硝酸氧化淀粉水解液法制备草酸,装置如图所示:

①一定量的淀粉水解液加入三颈烧瓶中
②控制反应温度55-60℃,边搅拌边缓慢滴加一定量的混合酸
③反应3小时,冷却,抽滤后再重结晶得到草酸晶体。
(1)上图实验装置中仪器甲的名称为
(2)检验淀粉是否水解完全所需要的试剂为
实验Ⅱ:探究草酸与酸性高锰酸钾溶液的反应
(3)向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,可推测草酸可能具有
实验Ⅲ:草酸性质的应用
利用比H2C2O4与酸性KMnO4溶液反应探究“条件对化学反应速率的影响。”实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。设计方案如下:
编号 | H2C2O4溶液 | 酸性高锰酸钾溶液 | 温度/℃ | ||
浓度/mol•L-1 | 体积/mL | 浓度/mol•L-l | 体积/mL | ||
甲 | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
乙 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
丙 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(5)探究温度对化学反应速率影响的实验编号是
实验Ⅳ:草酸晶体中结晶水测定
草酸晶体的化学式可表示为H2C2O4•xH2O,为测定x的值,进行下列实验:
①称取6.3g某草酸晶体配成100. 0mL的水溶液。
②取25.00mL所配溶液置于锥形瓶中,加入适量稀H2SO4,用浓度为0.5mol/L的KMnO4溶液滴定,滴定终点时消耗KMnO4的体积为10.00mL。
(6)计算x=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】锗是一种重要的半导体材料,工业上用精硫锗矿(主要成分为 )制取高纯度锗的工艺流程如图所示:
)制取高纯度锗的工艺流程如图所示: 分子中各原子均达到8电子稳定结构,其结构式为
分子中各原子均达到8电子稳定结构,其结构式为___________ 。
(2) 升华时通入
升华时通入 的目的是:
的目的是:___________ 、___________ 。
(3)酸浸时 、S元素均被氧化到最高价态,写出该反应的离子方程式:
、S元素均被氧化到最高价态,写出该反应的离子方程式:___________ ,酸浸时温度不能过高的原因是___________ 。
(4) 易水解生成
易水解生成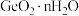 ,证明
,证明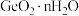 沉淀洗涤干净的方法是
沉淀洗涤干净的方法是___________ 。
(5)测定锗的含量:称取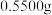 锗样品,加入双氧水溶解,再加入盐酸生成
锗样品,加入双氧水溶解,再加入盐酸生成 ,以淀粉为指示剂,用
,以淀粉为指示剂,用 的碘酸钾标准溶液滴定,消耗碘酸钾的体积为
的碘酸钾标准溶液滴定,消耗碘酸钾的体积为 。已知:酸性条件下
。已知:酸性条件下 ,能将
,能将 氧化为
氧化为 ,①在滴定过程中依次发生的离子方程式为:
,①在滴定过程中依次发生的离子方程式为:___________ 、 ,②该样品中储的质量分数是
,②该样品中储的质量分数是___________ %(精确到0.01%)。
 )制取高纯度锗的工艺流程如图所示:
)制取高纯度锗的工艺流程如图所示: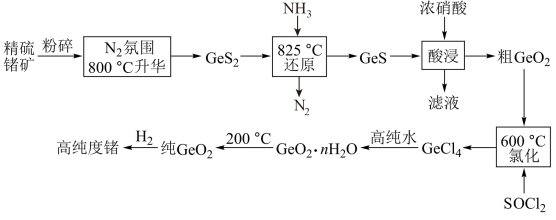
 分子中各原子均达到8电子稳定结构,其结构式为
分子中各原子均达到8电子稳定结构,其结构式为(2)
 升华时通入
升华时通入 的目的是:
的目的是:(3)酸浸时
 、S元素均被氧化到最高价态,写出该反应的离子方程式:
、S元素均被氧化到最高价态,写出该反应的离子方程式:(4)
 易水解生成
易水解生成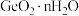 ,证明
,证明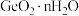 沉淀洗涤干净的方法是
沉淀洗涤干净的方法是(5)测定锗的含量:称取
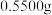 锗样品,加入双氧水溶解,再加入盐酸生成
锗样品,加入双氧水溶解,再加入盐酸生成 ,以淀粉为指示剂,用
,以淀粉为指示剂,用 的碘酸钾标准溶液滴定,消耗碘酸钾的体积为
的碘酸钾标准溶液滴定,消耗碘酸钾的体积为 。已知:酸性条件下
。已知:酸性条件下 ,能将
,能将 氧化为
氧化为 ,①在滴定过程中依次发生的离子方程式为:
,①在滴定过程中依次发生的离子方程式为: ,②该样品中储的质量分数是
,②该样品中储的质量分数是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】亚硝酸钠 是一种无色、无味晶体,具有防腐和抗氧化作用,常用作食品添加剂,但在使用时必须严格控制其用量。
是一种无色、无味晶体,具有防腐和抗氧化作用,常用作食品添加剂,但在使用时必须严格控制其用量。
为了测定某样品中 的含量,某同学进行如下实验:①称取样品a g,加水溶解配制成
的含量,某同学进行如下实验:①称取样品a g,加水溶解配制成 溶液;②取
溶液;②取 溶液于锥形瓶中,用
溶液于锥形瓶中,用 酸性
酸性 标准溶液进行滴定,滴定结束后消耗
标准溶液进行滴定,滴定结束后消耗 溶液V mL。
溶液V mL。
(1)上述实验①所需玻璃仪器除烧杯、玻璃棒、胶头滴管之外,还需__________ ;在进行滴定操作时, 溶液盛装在如图中的
溶液盛装在如图中的__________ (填“甲”或“乙”)滴定管中。

(2)用 标准溶液滴定可分为如下几步,按实验操作先后顺序排序
标准溶液滴定可分为如下几步,按实验操作先后顺序排序__________ (填字母)。
A.用标准溶液润洗滴定管2~3次
B.固定盛有标准溶液的滴定管,赶出尖嘴处气泡
C.用标准溶液滴定至终点,读数
D.取标准溶液注入滴定管至“0”刻度线以上
E.调节液面至0刻度线以下,读数
(3)滴定过程中发生如下反应的离子方程式____ ,请补充完成。
____ ____
____ ____= ____
____= ____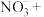 ____
____ ____
____
(4)当滴入最后半滴溶液,__________ ,即到达滴定终点。若滴定过程中刚出现颜色变化就停止滴定,则测定结果__________ 。(填“偏大”“偏小”或“无影响”)
(5)测得该样品中 的质量分数为
的质量分数为__________ 。
 是一种无色、无味晶体,具有防腐和抗氧化作用,常用作食品添加剂,但在使用时必须严格控制其用量。
是一种无色、无味晶体,具有防腐和抗氧化作用,常用作食品添加剂,但在使用时必须严格控制其用量。为了测定某样品中
 的含量,某同学进行如下实验:①称取样品a g,加水溶解配制成
的含量,某同学进行如下实验:①称取样品a g,加水溶解配制成 溶液;②取
溶液;②取 溶液于锥形瓶中,用
溶液于锥形瓶中,用 酸性
酸性 标准溶液进行滴定,滴定结束后消耗
标准溶液进行滴定,滴定结束后消耗 溶液V mL。
溶液V mL。(1)上述实验①所需玻璃仪器除烧杯、玻璃棒、胶头滴管之外,还需
 溶液盛装在如图中的
溶液盛装在如图中的
(2)用
 标准溶液滴定可分为如下几步,按实验操作先后顺序排序
标准溶液滴定可分为如下几步,按实验操作先后顺序排序A.用标准溶液润洗滴定管2~3次
B.固定盛有标准溶液的滴定管,赶出尖嘴处气泡
C.用标准溶液滴定至终点,读数
D.取标准溶液注入滴定管至“0”刻度线以上
E.调节液面至0刻度线以下,读数
(3)滴定过程中发生如下反应的离子方程式
____
 ____
____ ____= ____
____= ____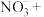 ____
____ ____
____(4)当滴入最后半滴溶液,
(5)测得该样品中
 的质量分数为
的质量分数为
您最近一年使用:0次



