侯德榜为我国化工事业的发展做出了卓越贡献,是我国近代化学工业的奠基人之一,他结合中国国情对氨碱法进行改进,确定了新的工艺流程——侯氏制碱法:将氨碱法和合成氨法两种工艺联合起来,方法流程如图所示。
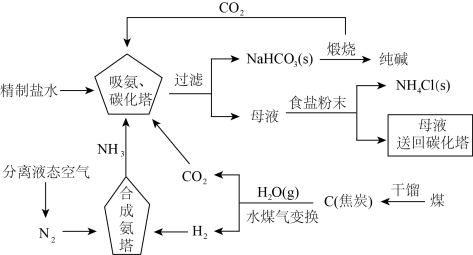
回答下列问题:
(1)向精制盐水中通入 、
、 的顺序及理由为
的顺序及理由为_______ (提示:从两种气体的溶解度进行分析)。
(2)写出 煅烧时发生反应的化学方程式:
煅烧时发生反应的化学方程式:_______ 。
(3)该流程中循环利用的物质为_______ (填化学式)。
(4)所得纯碱中可能含有少量NaCl杂质,可以通过如下方法测定纯碱中碳酸钠的质量分数:
i.称取ag样品,溶于水中;
ii.加入足量氯化钙溶液;
iii.过滤、洗涤、干燥、称量,所得沉淀质量为bg。
①证明步骤ⅱ中 已经沉淀完全的方法是
已经沉淀完全的方法是_______ 。
②该样品中碳酸钠的质量分数为_______ %(用含a、b的代数式表示)。

回答下列问题:
(1)向精制盐水中通入
 、
、 的顺序及理由为
的顺序及理由为(2)写出
 煅烧时发生反应的化学方程式:
煅烧时发生反应的化学方程式:(3)该流程中循环利用的物质为
(4)所得纯碱中可能含有少量NaCl杂质,可以通过如下方法测定纯碱中碳酸钠的质量分数:
i.称取ag样品,溶于水中;
ii.加入足量氯化钙溶液;
iii.过滤、洗涤、干燥、称量,所得沉淀质量为bg。
①证明步骤ⅱ中
 已经沉淀完全的方法是
已经沉淀完全的方法是②该样品中碳酸钠的质量分数为
更新时间:2024-03-04 00:20:16
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠)等产品,过程如下:
Ⅰ.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
Ⅱ.向Ⅰ所得固体中加入过量稀H2SO4,充分反应后过滤;
Ⅲ.向Ⅱ所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
Ⅳ.……
(1)步骤Ⅰ中发生反应的化学方程式为_________ 。
(2)步骤Ⅱ所得的滤液中一定含有的阳离子为________ 。
(3)步骤Ⅲ获得CuSO4溶液的离子方程式为________ 。
(4)步骤Ⅱ所得滤液经进一步处理可制得Na2FeO4,流程如图:
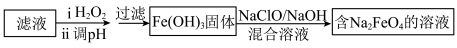
①测得滤液中c(Fe2+)为amol•L-1,若要处理1m3滤液,理论上需要消耗25%的H2O2溶液________ kg(用含a的代数式表示)。
②写出由Fe(OH)3制取Na2FeO4的化学方程式________ 。
Ⅰ.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
Ⅱ.向Ⅰ所得固体中加入过量稀H2SO4,充分反应后过滤;
Ⅲ.向Ⅱ所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
Ⅳ.……
(1)步骤Ⅰ中发生反应的化学方程式为
(2)步骤Ⅱ所得的滤液中一定含有的阳离子为
(3)步骤Ⅲ获得CuSO4溶液的离子方程式为
(4)步骤Ⅱ所得滤液经进一步处理可制得Na2FeO4,流程如图:

①测得滤液中c(Fe2+)为amol•L-1,若要处理1m3滤液,理论上需要消耗25%的H2O2溶液
②写出由Fe(OH)3制取Na2FeO4的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】胆矾(CuSO4·5H2O)有广泛的用途。某研究性学习小组利用某次实验后的稀硫酸、稀硝酸混合液制备胆矾。实验流程如下:
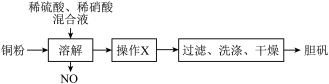
请回答下列问题:
(1)操作X为___ ,___ 。
(2)NO需要回收利用,写出NO与空气、H2O反应生成硝酸的化学方程式___ 。
(3)现有48g含CuO质量分数为20%的铜粉,与一定量的稀硫酸、稀硝酸混合液恰好完全反应生成CuSO4。试求:
①理论上生成胆矾的质量为___ g。
②原混合液中硫酸和硝酸的物质的量之比。___ (写出计算过程)

请回答下列问题:
(1)操作X为
(2)NO需要回收利用,写出NO与空气、H2O反应生成硝酸的化学方程式
(3)现有48g含CuO质量分数为20%的铜粉,与一定量的稀硫酸、稀硝酸混合液恰好完全反应生成CuSO4。试求:
①理论上生成胆矾的质量为
②原混合液中硫酸和硝酸的物质的量之比。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某种胃药的有效成分为碳酸钙,测定其中碳酸钙含量的操作如下(设该药片中的其他成分不与盐酸或氢氧化钠反应):
①配制0.10mol/L稀盐酸和0.10mol/LNaOH溶液;
②向一粒研碎后的药片(0.10g)中加入20.00mL蒸馏水;
③用0.10mol/LNaOH溶液中和过量稀盐酸,记录所消耗NaOH溶液的体积;
④加入25.00mL0.10mol/L稀盐酸。
请回答下列问题。
(1)正确的操作顺序是___ (填序号)。
(2)测定过程中发生反应的离子方程式为___ ;。
(3)该测定实验共进行了4次。实验室现有50mL、100mL、250mL、500mL4种规格的容量瓶,则配制盐酸应选用的容量瓶的规格为___ ,理由是___ 。
(4)某同学4次测定所消耗的NaOH溶液的体积如下:
根据这个同学的实验数据,计算这种药片中碳酸钙的质量分数___ 。
①配制0.10mol/L稀盐酸和0.10mol/LNaOH溶液;
②向一粒研碎后的药片(0.10g)中加入20.00mL蒸馏水;
③用0.10mol/LNaOH溶液中和过量稀盐酸,记录所消耗NaOH溶液的体积;
④加入25.00mL0.10mol/L稀盐酸。
请回答下列问题。
(1)正确的操作顺序是
(2)测定过程中发生反应的离子方程式为
(3)该测定实验共进行了4次。实验室现有50mL、100mL、250mL、500mL4种规格的容量瓶,则配制盐酸应选用的容量瓶的规格为
(4)某同学4次测定所消耗的NaOH溶液的体积如下:
| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| V[NaOH(aq)]/mL | 13.00 | 12.90 | 13.10 | 13.00 |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如下图所示(部分物质已略去)。
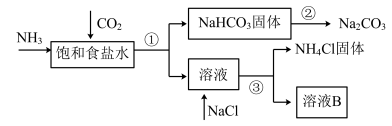
(1)根据上图,将化学方程式补充完整:________
NH3+CO2+___________+___________=NaHCO3↓+NH4Cl
(2)过程①对应的分离操作名称是___________ 。
(3)下列说法中,正确的是___________ (填字母)。
a.CO2可循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、 、Cl-
、Cl-

(1)根据上图,将化学方程式补充完整:
NH3+CO2+___________+___________=NaHCO3↓+NH4Cl
(2)过程①对应的分离操作名称是
(3)下列说法中,正确的是
a.CO2可循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、
 、Cl-
、Cl-
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某学校兴趣小组为研究某复合膨松剂(碳酸氢钠和碳酸氢铵的混合物),设计了以下实验.
实验Ⅰ:测定二氧化碳的质量
按下图所示连接装置并进行相关实验.
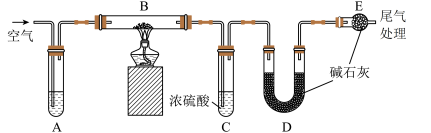
(1)仪器E的名称为______ 。
(2)试管A中所装试剂是______ 。
(3)下列操作步骤的正确顺序是______ 。
①连接好装置D、E后,加热
②停止加热后,应继续通入一段时间的空气
③将一定质量的膨松剂样品装入装置B中
④加热前,先对已连接好的装置A、B和C通入一段时间的空气
(4)测定实验前后装置______ (填装置对应的字母符号)的质量,其质量差即为样品产生的二氧化碳的质量。
实验Ⅱ:测定氨气的质量
调整上图装置的连接顺序为A→B→D→C→E.另取相同质量的膨松剂装入装置B中,测定实验前后装置C的质量,其质量差即为样品产生的氨气的质量;
(5)D的作用是______ 。
(6)实验过程中必须持续通入空气的目的有:
①产生的 便于被浓硫酸完全吸收;
便于被浓硫酸完全吸收;
②______ 。
(7)若实验Ⅰ和实验Ⅱ所取的膨松剂样品的质量一致,实验Ⅰ测得二氧化碳的质量为5.5g,实验Ⅱ测得氨气的质量为1.7g。
①装置B中产生 的方程式为
的方程式为______ 。
②通过计算分析该样品中碳酸氢钠和碳酸氢铵的物质的量之比为______ 。
实验Ⅰ:测定二氧化碳的质量
按下图所示连接装置并进行相关实验.

(1)仪器E的名称为
(2)试管A中所装试剂是
(3)下列操作步骤的正确顺序是
①连接好装置D、E后,加热
②停止加热后,应继续通入一段时间的空气
③将一定质量的膨松剂样品装入装置B中
④加热前,先对已连接好的装置A、B和C通入一段时间的空气
(4)测定实验前后装置
实验Ⅱ:测定氨气的质量
调整上图装置的连接顺序为A→B→D→C→E.另取相同质量的膨松剂装入装置B中,测定实验前后装置C的质量,其质量差即为样品产生的氨气的质量;
(5)D的作用是
(6)实验过程中必须持续通入空气的目的有:
①产生的
 便于被浓硫酸完全吸收;
便于被浓硫酸完全吸收;②
(7)若实验Ⅰ和实验Ⅱ所取的膨松剂样品的质量一致,实验Ⅰ测得二氧化碳的质量为5.5g,实验Ⅱ测得氨气的质量为1.7g。
①装置B中产生
 的方程式为
的方程式为②通过计算分析该样品中碳酸氢钠和碳酸氢铵的物质的量之比为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,实验班的某同学设计如图实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。(提示固体干燥剂主要有:碱石灰、无水CaCl2、P2O5等)
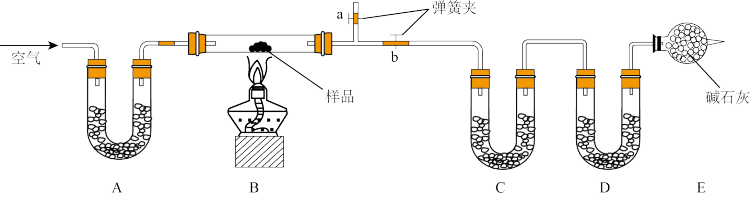
(1)装置A、C中盛放的试剂分别为A__ ,C___ 。
(2)E装置的作用是__ ,若无该装置,则测定结果中NaHCO3的含量将___ (填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将___ 。
(3)若样品质量为wg,反应后C、D增加的质量分别为m1g、m2g,由此可知混合物中NaHCO3质量分数为___ (用含w、m1g、m2g的代数式表示)

(1)装置A、C中盛放的试剂分别为A
(2)E装置的作用是
(3)若样品质量为wg,反应后C、D增加的质量分别为m1g、m2g,由此可知混合物中NaHCO3质量分数为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】为了综合利用副产品CaSO4,某化工厂与相邻的合成氨厂联合设计了下列(NH4)2SO4生产流程:

请回答以下问题:
(1)合成氨反应的化学方程式是________________________________ ,该反应在___________ (填设备名)中发生,反应所用催化剂一般用__________ 。
(2)沉淀池中发生的主要反应方程式是___________________________ ,该反应能够发生的原因是_________________________________________________ 。
(3)在上述流程中可以循环使用的物质是______ ,该生产过程中的副产品是__________ 。
(4)从绿色化学和资源综合利用的角度说明上述流程的主要优点是______________________ 。

请回答以下问题:
(1)合成氨反应的化学方程式是
(2)沉淀池中发生的主要反应方程式是
(3)在上述流程中可以循环使用的物质是
(4)从绿色化学和资源综合利用的角度说明上述流程的主要优点是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】我国化工专家侯德榜改革国外的纯碱生产工艺,他设计的生产流程可用下图表示。

(1)上述生产纯碱的方法被称为___________ 。
(2)食盐水中若含有MgCl2杂质,可滴加适量___________ 进行除杂。
(3)流程中的副产品为NH4Cl,是一种重要的氮肥,该物质在水溶液中的电离方程式为_____ 。
(4)上述流程中物质X的分子式为___________ 。
(5)沉淀池中发生反应的化学方程式是___________ 。从沉淀池中分离出沉淀的操作名称是___________ 。
(6)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,然后___________ 。

(1)上述生产纯碱的方法被称为
(2)食盐水中若含有MgCl2杂质,可滴加适量
(3)流程中的副产品为NH4Cl,是一种重要的氮肥,该物质在水溶液中的电离方程式为
(4)上述流程中物质X的分子式为
(5)沉淀池中发生反应的化学方程式是
(6)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,然后
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如下图所示(部分物质已略去)。__________ (填序号)。
(2)根据上图,将化学方程式补充完整:NH3+CO2+____ +______ =NaHCO3 ↓+ NH4Cl
(3)煅烧NaHCO3固体的化学方程式是____________ 。
(4)关于上述过程,下列说法中正确的是______ (填字母)。
a.CO2可循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、 、Cl-
、Cl-

(2)根据上图,将化学方程式补充完整:NH3+CO2+
(3)煅烧NaHCO3固体的化学方程式是
(4)关于上述过程,下列说法中正确的是
a.CO2可循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、
 、Cl-
、Cl-
您最近一年使用:0次



