电池在人类生产生活中具有十分重要的作用,单晶硅和铜、锗、镓等的化合物常作为制备太阳能电池的原料。回答下列问题:
(1)基态镓原子的价层电子排布图是___________ 。
(2)四氯化硅属于___________ 晶体,硅原子的杂化方式是___________ 。
(3)下列锗卤化物的熔点和沸点,产生该变化规律的原因是___________ 。
(4)比较键角∠HNH:H2N−NH2中的−NH2___________ H2N−NH 中的−NH
中的−NH (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由___________ 。
(5)下图为铜的某种氯化物晶胞示意图,试回答下列问题___________ 。原子坐标参数可表示晶胞内部各原子的相对位置,图中各原子标参数分别为A(0,0,0);B(0,1,1);C(1,1,0);则D原子的坐标参数为___________ 。
②晶胞中C、D两原子核间距为298pm,阿伏加德罗常数的值为NA,则该晶体的密度___________ g/cm3(列出计算式即可)。
(1)基态镓原子的价层电子排布图是
(2)四氯化硅属于
(3)下列锗卤化物的熔点和沸点,产生该变化规律的原因是
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(4)比较键角∠HNH:H2N−NH2中的−NH2
 中的−NH
中的−NH (填“>”、“<”或“=”),请说明理由
(填“>”、“<”或“=”),请说明理由(5)下图为铜的某种氯化物晶胞示意图,试回答下列问题
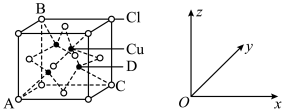
②晶胞中C、D两原子核间距为298pm,阿伏加德罗常数的值为NA,则该晶体的密度
更新时间:2024-03-01 09:12:46
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】铜及其化合物在生产、生活中有广泛应用。科学家开发新型单原子铜催化剂电化学还原 制备
制备 取得新进展。反应方程式为
取得新进展。反应方程式为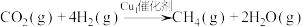 。回答下列问题:
。回答下列问题:
(1)铜的焰色呈___________ 色。基态铜原子的价层电子排布式为___________ 。
(2)上述反应涉及的物质中:
①既含σ键又含π键的非极性分子是___________ 。(填分子式,下同)
②中心原子采取 杂化的分子有
杂化的分子有_______ ,VSEPR模型和空间构型相同的分子有________ 。
(3)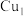 催化剂的结构如图所示。铜的配位数为
催化剂的结构如图所示。铜的配位数为___________ ,配位原子是___________ (填元素符号)。

(4)我国科学家开发出一种高效储存、分离、提纯 的新材料,晶胞结构如图所示。已知:图(a)中边长为xpm,图(c)中高为ypm,设
的新材料,晶胞结构如图所示。已知:图(a)中边长为xpm,图(c)中高为ypm,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
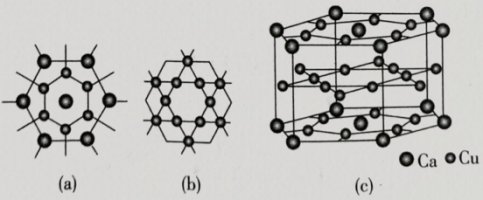
①该材料的化学式为___________ 。
②该晶体的密度为___________  。
。
 制备
制备 取得新进展。反应方程式为
取得新进展。反应方程式为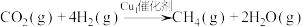 。回答下列问题:
。回答下列问题:(1)铜的焰色呈
(2)上述反应涉及的物质中:
①既含σ键又含π键的非极性分子是
②中心原子采取
 杂化的分子有
杂化的分子有(3)
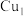 催化剂的结构如图所示。铜的配位数为
催化剂的结构如图所示。铜的配位数为
(4)我国科学家开发出一种高效储存、分离、提纯
 的新材料,晶胞结构如图所示。已知:图(a)中边长为xpm,图(c)中高为ypm,设
的新材料,晶胞结构如图所示。已知:图(a)中边长为xpm,图(c)中高为ypm,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
①该材料的化学式为
②该晶体的密度为
 。
。
您最近一年使用:0次
【推荐2】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构、熔点/℃角度分析,原因是______________ 。
(2)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因____________ 。
(3)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________ 。
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为__________ ,微粒之间存在的作用力是________ 。
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C(
);C( ,0,
,0, ),则D原子的坐标参数为
),则D原子的坐标参数为_________ 。
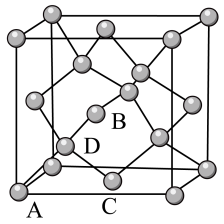
②晶胞参数:描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76pm,其密度为_______ g/cm3(列出计算式即可)。
(1)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构、熔点/℃角度分析,原因是
(2)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因
| GeCl4 | GeBr4 | Gel4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C(
);C( ,0,
,0, ),则D原子的坐标参数为
),则D原子的坐标参数为
②晶胞参数:描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76pm,其密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】含硼、氮、磷的化合物有许多重要用途,如:(CH3)3N、Cu3P、磷化硼等。回答下列问题:
(1)基态B原子电子占据最高能级的电子云轮廓图为________ ;基态Cu+的核外电子排布式为___________ 。
(2)化合物(CH3)3N分子中N原子杂化方式为________ ,该物质能溶于水的原因是______ 。
(3)PH3分子的键角小于NH3分子的原因是________________ ;亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,则H3PO3分子的结构式为______________________ 。
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:

①在一个晶胞中原子的配位数为_______________ 。
②已知磷化硼晶体的密度为p g/cm3,阿伏加 德罗常数为NA,则B-P键长为_________ 。
③磷化硼晶胞沿着体对角线方向的投影如图,请在答题卡上将表示B原子的圆圈涂黑_________ 。

(1)基态B原子电子占据最高能级的电子云轮廓图为
(2)化合物(CH3)3N分子中N原子杂化方式为
(3)PH3分子的键角小于NH3分子的原因是
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:

①在一个晶胞中原子的配位数为
②已知磷化硼晶体的密度为p g/cm3,阿伏加 德罗常数为NA,则B-P键长为
③磷化硼晶胞沿着体对角线方向的投影如图,请在答题卡上将表示B原子的圆圈涂黑

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
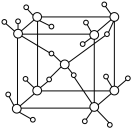
【推荐1】亚微米级Cu0/Fe3O4复合物多相催化过一硫酸盐降解有机污染物的过程如图所示:
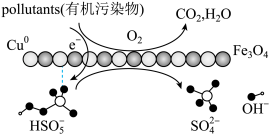
回答下列问题:
(1)基态铜原子的价层电子排布式为_____________ ,其位于元素周期表的___ 区。
(2)O、S、H 的电负性由大到小的顺序为____________ 。
(3) 的中心原子的价层电子对数为
的中心原子的价层电子对数为__________ ,其空间构型为_____________ 。
(4)冰的晶体结构如图所示,则1mol冰中含有_________ mol氢键。
(5) Cu0/Fe3O4复合物也是有机反应中的催化剂,如: +NH3+H2O2
+NH3+H2O2 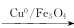
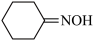 +2H2O
+2H2O
① 1mol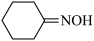 中含有σ键的数目为
中含有σ键的数目为________ NA(NA为阿伏加 德罗常数的值)。
②NH3的键角__________________ (填“大于”“小于”或“等于”) NF3的键角;理由是 _______________________________________________________ 。
(6)铜的晶胞结构如图,则铜的配位数为_________ ,若铜原子的半径为a pm,则铜晶胞的密度为___________ g•cm‑3(列出计算式)。


回答下列问题:
(1)基态铜原子的价层电子排布式为
(2)O、S、H 的电负性由大到小的顺序为
(3)
 的中心原子的价层电子对数为
的中心原子的价层电子对数为(4)冰的晶体结构如图所示,则1mol冰中含有

(5) Cu0/Fe3O4复合物也是有机反应中的催化剂,如:
 +NH3+H2O2
+NH3+H2O2 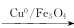
 +2H2O
+2H2O① 1mol
 中含有σ键的数目为
中含有σ键的数目为②NH3的键角
(6)铜的晶胞结构如图,则铜的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】近日,中国科学院深圳先进技术研究院某研究团队发现,二维铜铟磷硫(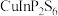 )能作纳米药物,用于未来安全有效的抗SARS-CoV-2治疗,以降低SARS-CoV-2的传染性。
)能作纳米药物,用于未来安全有效的抗SARS-CoV-2治疗,以降低SARS-CoV-2的传染性。
(1)已知铟(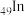 )与铝同主族,则基态In原子的价电子的轨道表示式为
)与铝同主族,则基态In原子的价电子的轨道表示式为___________ ;焰火中铜的焰色是绿色,该光谱属于___________ (填“发射”或“吸收”)光谱。
(2)第一电离能:P___________ S(填“>”或“<”,下同);键角:
___________  。
。
(3) 常作消毒剂,其合成途径之一为
常作消毒剂,其合成途径之一为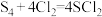 ,
,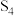 (
(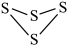 )中硫原子的杂化类型为
)中硫原子的杂化类型为___________ ; 分子的VSEPR模型是
分子的VSEPR模型是___________ 。
(4) 可用于制造火柴及火柴盒摩擦面,已知
可用于制造火柴及火柴盒摩擦面,已知 分子中各原子最外层均满足8电子结构,且该分子中只含有9个
分子中各原子最外层均满足8电子结构,且该分子中只含有9个 键,则
键,则 的结构式可能为
的结构式可能为___________ (写一种即可)。
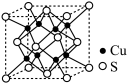
(5) 呈黑色或灰黑色,其晶胞结构如图所示,若晶胞的参数为
呈黑色或灰黑色,其晶胞结构如图所示,若晶胞的参数为 ,晶体的密度为
,晶体的密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为___________ (用含a和d的代数式表示)。
 )能作纳米药物,用于未来安全有效的抗SARS-CoV-2治疗,以降低SARS-CoV-2的传染性。
)能作纳米药物,用于未来安全有效的抗SARS-CoV-2治疗,以降低SARS-CoV-2的传染性。(1)已知铟(
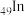 )与铝同主族,则基态In原子的价电子的轨道表示式为
)与铝同主族,则基态In原子的价电子的轨道表示式为(2)第一电离能:P

 。
。(3)
 常作消毒剂,其合成途径之一为
常作消毒剂,其合成途径之一为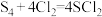 ,
,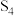 (
( )中硫原子的杂化类型为
)中硫原子的杂化类型为 分子的VSEPR模型是
分子的VSEPR模型是(4)
 可用于制造火柴及火柴盒摩擦面,已知
可用于制造火柴及火柴盒摩擦面,已知 分子中各原子最外层均满足8电子结构,且该分子中只含有9个
分子中各原子最外层均满足8电子结构,且该分子中只含有9个 键,则
键,则 的结构式可能为
的结构式可能为(5)
 呈黑色或灰黑色,其晶胞结构如图所示,若晶胞的参数为
呈黑色或灰黑色,其晶胞结构如图所示,若晶胞的参数为 ,晶体的密度为
,晶体的密度为 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】某同学设计了如图所示的装置,可比较HNO3、H2CO3、H2SiO3的酸性强弱,进而比较氮、碳、硅元素非金属性强弱。供选择的试剂:稀硝酸、稀硫酸、碳酸钙固体、碳酸钠固体、硅酸钠溶液、澄清石灰水、饱和碳酸氢钠溶液
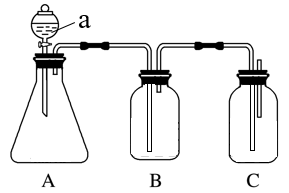
(1)仪器a的名称:___________ 。
(2)锥形瓶中装有某可溶性正盐,a中所盛试剂为___________ 。
(3)装置B所盛试剂是___________ ,其作用是___________ 。
(4)装置C所盛试剂是___________ ,C中反应的离子方程式是___________ 。
(5)通过实验证明碳、氮、硅的非金属性由强到弱的顺序是___________ 。
(6)写出碳、氮、硅三元素的简单气态氢化物的稳定性由强到弱的顺序是(写化学式)___________ 。
(7)写出碳、氮、硅三元素的简单气态氢化物的沸点由高到低的顺序是(写化学式)___________ 。

(1)仪器a的名称:
(2)锥形瓶中装有某可溶性正盐,a中所盛试剂为
(3)装置B所盛试剂是
(4)装置C所盛试剂是
(5)通过实验证明碳、氮、硅的非金属性由强到弱的顺序是
(6)写出碳、氮、硅三元素的简单气态氢化物的稳定性由强到弱的顺序是(写化学式)
(7)写出碳、氮、硅三元素的简单气态氢化物的沸点由高到低的顺序是(写化学式)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】铁、钴、镍为第四周期第Ⅷ族元素,它们的性质非常相似,也称为铁系元素。铁、钴、镍都是很好的配位化合物形成体。
(1)①铁元素在元素周期表中的位置是_______ 。
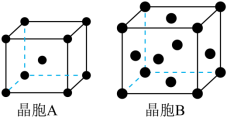
②用X射线衍射测定,得到Fe的两种晶胞A、B,其结构如图所示。晶胞A中每个Fe原子紧邻的原子数为_______ 。每个晶胞B中含Fe原子数为_______ 。_______ ,[Co(H2O)6]2+中 Co2+的配位数为_______ ;从轨道重叠方式看,NH3 分子中的化学键类型为_______ ,H2O 分子的立体构型为_______ 。
(3)铁、镍易与一氧化碳作用形成羰基配合物,中心原子价电子数与配位体提供的成键电子数遵循18e-规则。如:Fe(CO)5,则镍与CO形成的配合物化学式为_______ 。常温下Fe(CO)5为黄色油状液体,则Fe(CO)5固态为_______ 晶体。
(4)铁的晶胞A中,如果该晶胞参数为a cm,则相距最近的两个铁原子核间距为_______ cm (用含 a 的式子表示)。
(1)①铁元素在元素周期表中的位置是
②用X射线衍射测定,得到Fe的两种晶胞A、B,其结构如图所示。晶胞A中每个Fe原子紧邻的原子数为
(3)铁、镍易与一氧化碳作用形成羰基配合物,中心原子价电子数与配位体提供的成键电子数遵循18e-规则。如:Fe(CO)5,则镍与CO形成的配合物化学式为
(4)铁的晶胞A中,如果该晶胞参数为a cm,则相距最近的两个铁原子核间距为
您最近一年使用:0次
【推荐3】已知A、B、C、D、E、F都是元素周期表前四周期的元素,它们的核电荷数:B<A<C<D<E<F。B、C两种元素都能引起水体富营养化。E原子得到一个电子后3p轨道全充满。A+比E原子形成的离子少1个电子层。D可以形成两种氧化物,其中一种氧化物是形成酸雨的主要气体之一。F的原子序数为26。请回答下列问题:
(1)C、D、E的第一电离能由小到大的顺序为________ (用元素符号表示)。
(2)写出B的氢化物与水反应的离子方程式:________________ ,B的氢化物极易溶于水的原因是____________________________________________________________ 。
(3)化合物BE3的分子空间构型为________________ 。
(4)F元素原子的核外电子排布式为________ 。F的一种常见化合物F(CO)5在常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,则F(CO)5的晶体类型为__________________ 。
(5)将FE3的饱和溶液滴入沸水中,请写出有关反应的离子方程式:___________________________ 。
(6)比较B、C两种元素的氢化物稳定性并说明理由:____________________ 。
(1)C、D、E的第一电离能由小到大的顺序为
(2)写出B的氢化物与水反应的离子方程式:
(3)化合物BE3的分子空间构型为
(4)F元素原子的核外电子排布式为
(5)将FE3的饱和溶液滴入沸水中,请写出有关反应的离子方程式:
(6)比较B、C两种元素的氢化物稳定性并说明理由:
您最近一年使用:0次




