某化学兴趣小组的同学为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如表:
试根据表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极(正极或负极)______ (填“相同”或“不相同”)。
(2)对实验3完成下列填空:
①铝为_____ 极,电极反应式:______ 。
②石墨为_____ 极,电极反应式:______ 。
③电池总反应方程式:______ 。
(3)实验4中铝作______ ,理由是______ 。写出铝电极的电极反应式:______ 。
(4)解释实验5中电流计指针偏向铝的原因:______ 。
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:______ 。
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
(1)实验1、2中Al所作的电极(正极或负极)
(2)对实验3完成下列填空:
①铝为
②石墨为
③电池总反应方程式:
(3)实验4中铝作
(4)解释实验5中电流计指针偏向铝的原因:
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:
更新时间:2024-04-04 11:41:16
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】能源是现代文明的原动力,电池与我们的生活和生产密切相关。
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是___________ (填字母)。
A.C(s)+H2O(g)=CO(g)+H2(g) B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) C.2CO(g)+O2=2CO2(l)
(2)如图为原电池装置示意图:

①若A为Zn片,B为石墨棒,电解质溶液为稀硫酸,写出正极的电极反应式___________ ,反应过程中溶液的酸性___________ (填“变大”变小“或”不变“)。一段时间后,当在电池中放出1.68L(标准状况)气体时,电路中有___________ 个电子通过了导线(设NA为阿伏加德罗常数的值)。
②燃料电池是一种具有应用前景的绿色电源,氢气燃料电池和甲醇燃料电池在北京冬奥会上得到广泛应用。如图是碱性氢燃料电池的模拟示意图:

a电极是___________ 极,将上图中的H2改为甲醇就构成了碱性甲醇燃料电池,a电极发生的电极反应式是___________ 。若线路中转移2mol电子,则该燃科电池理论上消耗的O2在标准状况下的体积为___________ L。
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
A.C(s)+H2O(g)=CO(g)+H2(g) B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) C.2CO(g)+O2=2CO2(l)
(2)如图为原电池装置示意图:

①若A为Zn片,B为石墨棒,电解质溶液为稀硫酸,写出正极的电极反应式
②燃料电池是一种具有应用前景的绿色电源,氢气燃料电池和甲醇燃料电池在北京冬奥会上得到广泛应用。如图是碱性氢燃料电池的模拟示意图:

a电极是
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】化学反应速率与化学平衡原理等理论对于工业生产有着重要的指导意义。
(1)实验室在启普发生器中加入锌粒和稀硫酸制取氢气,可加快反应速率的措施是___________。
(2)已达到平衡的可逆反应,增大压强后,反应速率变化如图所示,该反应可能是___________。
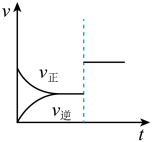
(1)实验室在启普发生器中加入锌粒和稀硫酸制取氢气,可加快反应速率的措施是___________。
| A.用浓硫酸代替稀硫酸 | B.给装置部分加热 |
| C.滴加少量硫酸铜溶液 | D.将锌粒改为锌粉 |

A. | B. |
C.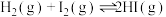 | D.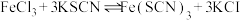 |
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】现代社会应用最广泛的能源之一。
(1)某原电池装置如图所示:
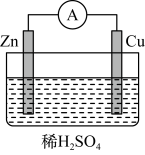
①负极反应是___________ 。
②电子由___________ 片通过导线流向___________ 片。(填化学式)
③一段时间后,溶液的pH___________ 。(填“增大”或“减小”)
④溶液中的H+向___________ 片移动。(填化学式)
(2)依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示:

请回答下列问题:
①电极X的材料是___________ (填化学式) ;正极上发生的电极反应式为___________ ;
②当导线中通过了0.1mol电子时,银棒增重___________ g
(1)某原电池装置如图所示:

①负极反应是
②电子由
③一段时间后,溶液的pH
④溶液中的H+向
(2)依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示:

请回答下列问题:
①电极X的材料是
②当导线中通过了0.1mol电子时,银棒增重
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】二氧化碳、甲烷的捕集、转化与利用对环境和能源具有重要意义。
Ⅰ. 的捕集
的捕集
(1)地球上最高效的碳捕捉过程是绿色植物的______ ,该过程中能量的转化形式为______ 。
(2)用碱液吸收 。
。
①用足量NaOH溶液吸收 ,该过程中溶液的温度
,该过程中溶液的温度______ (填“上升”或“下降”)。
②若用100 mL 5 mol⋅L 的NaOH溶液吸收
的NaOH溶液吸收 后,测得吸收液中的
后,测得吸收液中的 ,则吸收的
,则吸收的 在标准状况下的体积为
在标准状况下的体积为______ L。
Ⅱ. 、
、 的转化
的转化
(3)在一定条件下,在催化剂表面将 转化为
转化为 ,其原理如图所示:
,其原理如图所示: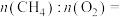
______ 。
Ⅲ. 、
、 的利用
的利用
(4)一种将 转化为合成气(
转化为合成气( 和CO)的原理如图所示:
和CO)的原理如图所示:____________ 。
②理论上,2.24 L (标准状况)通过以上两步反应最多可制得
(标准状况)通过以上两步反应最多可制得 的物质的量为
的物质的量为______ 。
(5)通过人工光合作用可实现对 的再利用,以
的再利用,以 和
和 为原料制备甲酸(HCOOH),工作原理如图所示:
为原料制备甲酸(HCOOH),工作原理如图所示: 的移动方向是左
的移动方向是左______ 右(填“→”或“←”)。
②电极b上的电极反应式为____________ 。
Ⅰ.
 的捕集
的捕集(1)地球上最高效的碳捕捉过程是绿色植物的
(2)用碱液吸收
 。
。①用足量NaOH溶液吸收
 ,该过程中溶液的温度
,该过程中溶液的温度②若用100 mL 5 mol⋅L
 的NaOH溶液吸收
的NaOH溶液吸收 后,测得吸收液中的
后,测得吸收液中的 ,则吸收的
,则吸收的 在标准状况下的体积为
在标准状况下的体积为Ⅱ.
 、
、 的转化
的转化(3)在一定条件下,在催化剂表面将
 转化为
转化为 ,其原理如图所示:
,其原理如图所示: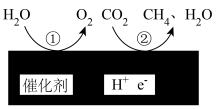
Ⅲ.
 、
、 的利用
的利用(4)一种将
 转化为合成气(
转化为合成气( 和CO)的原理如图所示:
和CO)的原理如图所示: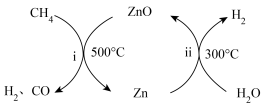
②理论上,2.24 L
 (标准状况)通过以上两步反应最多可制得
(标准状况)通过以上两步反应最多可制得 的物质的量为
的物质的量为(5)通过人工光合作用可实现对
 的再利用,以
的再利用,以 和
和 为原料制备甲酸(HCOOH),工作原理如图所示:
为原料制备甲酸(HCOOH),工作原理如图所示: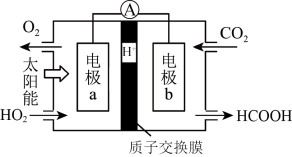
 的移动方向是左
的移动方向是左②电极b上的电极反应式为
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】某校化学研究性学习小组欲设计实验验证Zn、Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
(1)用三种金属与盐酸反应的现象来判断,实验中除选择大小相同的金属片外,还需要控制___________ 、___________ 相同。
(2)某小组同学采用Zn、Fe作为电极,只用一个原电池证明三种金属的活动性,则电解质溶液最好选用___________ 。
A.0.5mol/L盐酸 B.0.5mol/L氯化亚铁和0.5mol/L氯化铜混合溶液
C.0.5mol/L氯化铜溶液 D.0.5mol/L氯化亚铁溶液
(3) SO2空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置如下图:
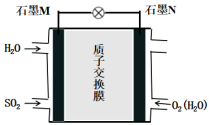
①质子向___________ 极迁移(填“M”或“N”)。
②负极的电极反应式为___________ ,每转移4 mol e-消耗的___________ L(标况下)SO2。
(1)用三种金属与盐酸反应的现象来判断,实验中除选择大小相同的金属片外,还需要控制
(2)某小组同学采用Zn、Fe作为电极,只用一个原电池证明三种金属的活动性,则电解质溶液最好选用
A.0.5mol/L盐酸 B.0.5mol/L氯化亚铁和0.5mol/L氯化铜混合溶液
C.0.5mol/L氯化铜溶液 D.0.5mol/L氯化亚铁溶液
(3) SO2空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置如下图:

①质子向
②负极的电极反应式为
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐1】如图所示,组成原电池,回答下列问题。
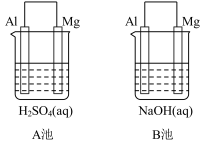
(1)该装置是把___________ 能转化为_________ 能的装置。
(2)A池中Mg电极是__________ (填“正”或“负”)极,其在反应中_____ (填“得到”或“失去”)电子,该极发生的反应是__________ (填“氧化”或“还原”)反应,其电极反应为________________________ ,该装置中电流的方向是由_____ 到 ______ 。
(3)B池中负极材料是_________ ,该装置中电子的移动方向是由_____ 到 ______ 。

(1)该装置是把
(2)A池中Mg电极是
(3)B池中负极材料是
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
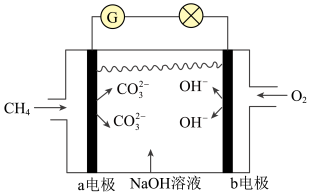
【推荐2】电化学在生活中的应用广泛,请根据电化学原理回答下列问题:
(1)将锌片、铜片置于稀硫酸中并以导线连接起来组成原电池,可以获得电流,则Zn电极上发生的电极反应式为________ 。
(2)如下图所示是甲烷燃料电池的原理示意图:
①电池的正极反应式为________ 。
②电池工作一段时间后,电解质溶液的pH________ (填“增大”、“减小”或“不变”)。
(3)按图所示装置,以石墨为电极电解氯化钠溶液,同时在两边各滴入几滴酚酞溶液,则电解时在X极附近观察到的现象是________ ,若将X电极材料换为Cu,则X电极上的电极反应式将________ (填“发生变化”或“不变”)。
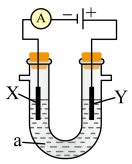
(4)某原电池装置初始状态如下图所示,电池总反应为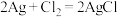 。
。
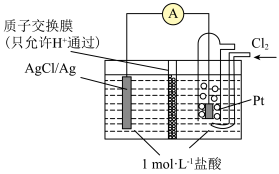
当电路中转移amol电子时,质子交换膜上通过________ mol离子,质子交换膜左侧的溶液中约减少________ mol离子(忽略溶液体积变化和 在水中的溶解)。
在水中的溶解)。
(1)将锌片、铜片置于稀硫酸中并以导线连接起来组成原电池,可以获得电流,则Zn电极上发生的电极反应式为
(2)如下图所示是甲烷燃料电池的原理示意图:
①电池的正极反应式为
②电池工作一段时间后,电解质溶液的pH

(3)按图所示装置,以石墨为电极电解氯化钠溶液,同时在两边各滴入几滴酚酞溶液,则电解时在X极附近观察到的现象是

(4)某原电池装置初始状态如下图所示,电池总反应为
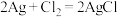 。
。
当电路中转移amol电子时,质子交换膜上通过
 在水中的溶解)。
在水中的溶解)。
您最近半年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】如图所示,某同学设计一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
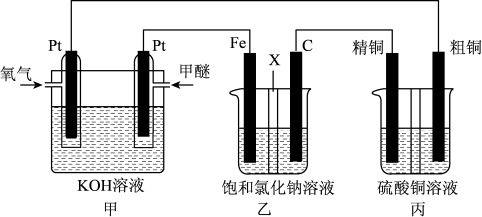
(1)通入氧气的电极为_______ 极,写出其电极反应式_______ 。
(2)铁电极为_______ 极,石墨电极(C)的电极反应式为_______ 。
(3)反应一段时间后,乙装置中生成NaOH主要在_______ 极区(填电极材料)。
(4)如果粗铜中含有锌、银等杂质,丙装置中阳极上电极反应式为_______ ,_______ 。反应一段时间,硫酸铜溶液浓度将_______ (填“增大”、“减小”或“不变”)。

(1)通入氧气的电极为
(2)铁电极为
(3)反应一段时间后,乙装置中生成NaOH主要在
(4)如果粗铜中含有锌、银等杂质,丙装置中阳极上电极反应式为
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】Ⅰ.拆开1mol气态物质中某种共价键需要吸收的能量,就是该共价键的键能。下表是某些共价键的键能:根据右图中能量变化图,回答下列问题:
(1)图中:a=___________ 。
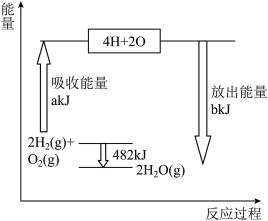
(2)表格中:X=__________ 。
Ⅱ.如图,A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
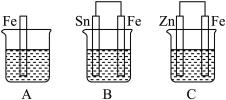
(1)A中反应的离子方程式为_____________________________ 。
(2)B中Sn极的电极反应式为____________________________ 。
(3)C中被腐蚀的金属是________ ,总反应的化学方程式为_________________________ ,
比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为__________ (填序号)。
(1)图中:a=

(2)表格中:X=
| 共价键 | H-H | O=O | H-O |
| 键能/kJ ·mol-1 | 436 | 498 | X |
Ⅱ.如图,A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。

(1)A中反应的离子方程式为
(2)B中Sn极的电极反应式为
(3)C中被腐蚀的金属是
比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】回答下列问题
(1)某公司开发了一种以甲醇为原料,以KOH为电解质的用于手机可充电的高效燃料电池,充一次电可连续使用一个月。其中B电极的电极材料为碳,如图是一个电化学过程的示意图。请填空:
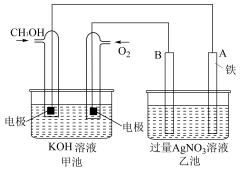
①放电时,甲醇在___________ (填“正”或“负”)极发生反应,正极的电极反应为___________ 。
②工作时,B极的电极反应式为___________ ,A极的电极反应式为___________ 。
(2)某同学设计了一种用电解法制取Fe(OH)2的实验装置(如图所示)通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法不正确的是___________(填序号)。

(3)如图所示将铁棒和石墨棒插入盛有饱和NaCl溶液的 型管中。
型管中。
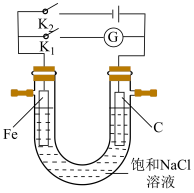
①K1闭合,铁电极的反应为___________ 。
②K2闭合,铁棒不会被腐蚀,属于___________ 保护法。
(1)某公司开发了一种以甲醇为原料,以KOH为电解质的用于手机可充电的高效燃料电池,充一次电可连续使用一个月。其中B电极的电极材料为碳,如图是一个电化学过程的示意图。请填空:

①放电时,甲醇在
②工作时,B极的电极反应式为
(2)某同学设计了一种用电解法制取Fe(OH)2的实验装置(如图所示)通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法不正确的是___________(填序号)。

A. 为电源正极, 为电源正极, 为电源负极 为电源负极 | B.可以用NaCl溶液作为电解质溶液 |
| C.A、B两端都必须用铁作电极 | D.阴极发生的反应为2H2O+2e-=2OH-+H2↑ |
(3)如图所示将铁棒和石墨棒插入盛有饱和NaCl溶液的
 型管中。
型管中。
①K1闭合,铁电极的反应为
②K2闭合,铁棒不会被腐蚀,属于
您最近半年使用:0次


 和
和 反应,其能量变化示意图如下。
反应,其能量变化示意图如下。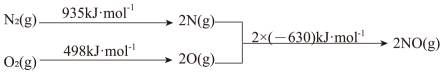
 气体在足量的氧气中完全燃烧后,恢复至原状态,每转移1mol电子放出热量190kJ,写出该反应的热化学方程式:
气体在足量的氧气中完全燃烧后,恢复至原状态,每转移1mol电子放出热量190kJ,写出该反应的热化学方程式:

