小明选择“铝丝和盐酸反应的快慢与什么因素有关”的课题开展探究。下表是他分别用相同质量的铝丝和足量稀盐酸反应的三组实验数据:
(1)写出铝和稀盐酸反应的化学方程式___________ 。
(2)实验②和③表明:该反应快慢与___________ 有关。
(3)能表明盐酸浓度对反应快慢有影响的实验编号是:___________ 和___________ 。
(4)如果把实验①中盐酸的质量分数改为4%,请你推出铝丝消失的时间(用t表示)取值范围___________ 。
| 试验编号 | 盐酸的质量分数/% | 反应温度/℃ | 铝丝消失的时间/s |
| ① | 3 | 20 | 500 |
| ② | 6 | 20 | 300 |
| ③ | 6 | 30 | 80 |
(2)实验②和③表明:该反应快慢与
(3)能表明盐酸浓度对反应快慢有影响的实验编号是:
(4)如果把实验①中盐酸的质量分数改为4%,请你推出铝丝消失的时间(用t表示)取值范围
更新时间:2024-03-28 09:37:51
|
【知识点】 外因对化学反应速率影响的综合分析解读
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】I.完成下列问题
(1)为比较Fe3+、Cu2+对H2O2分解的催化效果,某实验小组同学设计了如图的实验。
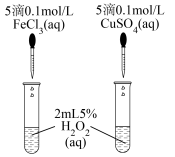
通过观察___________ (填实验现象),即可得出Fe3+、Cu2+的催化效果的差异。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是___________ 。
(2)某实验小组欲探究某一外界条件对酸性KMnO4和H2C2O4(草酸)反应速率的影响,设计实验方案如表:
上述反应的离子方程式为___________ ,该实验是探究___________ 对反应速率的影响。
II.水的电离平衡曲线如图所示,回答下列问题。
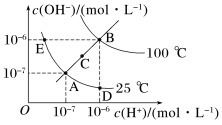
(3)图中A、B、C、D、E五点Kw间的关系:___________ 。
(4)在水中加少量酸,可实现A点向___________ 点移动。
(5)若在B点温度下,pH=2的硫酸溶液中,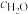 (H+)=
(H+)=___________ mol·L-1。
(1)为比较Fe3+、Cu2+对H2O2分解的催化效果,某实验小组同学设计了如图的实验。

通过观察
(2)某实验小组欲探究某一外界条件对酸性KMnO4和H2C2O4(草酸)反应速率的影响,设计实验方案如表:
| 序号 | 草酸溶液 | 酸性高锰酸钾溶液 |
| ① | 0.1mol•L-1、20mL | 0.01mol•L-1、30mL |
| ② | 0.2mol•L-1、20mL | 0.01mol•L-1、30mL |
II.水的电离平衡曲线如图所示,回答下列问题。

(3)图中A、B、C、D、E五点Kw间的关系:
(4)在水中加少量酸,可实现A点向
(5)若在B点温度下,pH=2的硫酸溶液中,
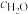 (H+)=
(H+)=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合引起的体积变化)
(1)通过实验A、B,可探究出浓度的改变对反应速率的影响,其中V1=___________ ,T1=___________ ,通过实验___________ 可探究出温度变化对化学反应速率的影响。
(2)C组实验中溶液褪色时间t1___________ (填“>”或“<”或“=”)8s,C组实验的反应速率v(KMnO4)=___________ 。(用含有t1的式子表示)
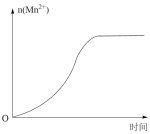
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示,并以此分析造成n(Mn2+)突变的可能的原因是___________ 。
(4)通过测定收集一定体积氢气所用的时间可以用于测定锌粒和稀硫酸反应的速率,于是某同学设计了如图所示的实验装置:
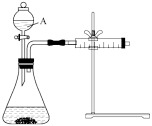
①装置中仪器A的名称为___________ 。
②定量分析:装置组装完成后需要先检查该装置的气密性。简述检查该装置气密性的方法
___________ ;实验时以收集到40mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是___________ 。
| 实验序号 | 实验温度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
| KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
| V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
| A | 293 | 2.0 | 0.02 | 4.0 | 0.1 | 0 | 6 |
| B | T1 | 2.0 | 0.02 | 3.0 | 0.1 | V1 | 8 |
| C | 313 | 2.0 | 0.02 | V2 | 0.1 | 1.0 | t1 |
(1)通过实验A、B,可探究出浓度的改变对反应速率的影响,其中V1=
(2)C组实验中溶液褪色时间t1
(3)该小组的一位同学通过查阅资料发现,上述实验过程中n(Mn2+)随时间变化的趋势如图所示,并以此分析造成n(Mn2+)突变的可能的原因是

(4)通过测定收集一定体积氢气所用的时间可以用于测定锌粒和稀硫酸反应的速率,于是某同学设计了如图所示的实验装置:

①装置中仪器A的名称为
②定量分析:装置组装完成后需要先检查该装置的气密性。简述检查该装置气密性的方法
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】某研究小组拟用定量的方法测量Al与酸反应的快慢。
(1)实验测得铝丝产生气体的速率(v)与时间(t)的关系如下图所示,则t1~t2时间段内反应速率逐渐加快的主要原因是__________ ;t2~t3时间段内反应速率逐渐减慢的主要原因是___________________________________
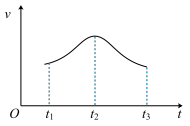
(2)某同学取等体积、等浓度的 a 稀硫酸、b 盐酸、c 醋酸 三种酸溶液分别加入足量的铝粉进行如上实验,开始时三种溶液中反应速率由快到慢的顺序是_________________ ;反应完毕产生气体体积的由大到小顺序是_________________ (相同条件)。(以上两空用序号排序回答)
(1)实验测得铝丝产生气体的速率(v)与时间(t)的关系如下图所示,则t1~t2时间段内反应速率逐渐加快的主要原因是

(2)某同学取等体积、等浓度的 a 稀硫酸、b 盐酸、c 醋酸 三种酸溶液分别加入足量的铝粉进行如上实验,开始时三种溶液中反应速率由快到慢的顺序是
您最近一年使用:0次



