I.某工业废水中含 、Fe3+、Al3+、Cu2+,为了减少环境污染,变废为宝,利用废铁屑和其他化学试剂进行如下操作,可以获得铁红、Al(OH)3、固体C等化学试剂。回答下列问题:
、Fe3+、Al3+、Cu2+,为了减少环境污染,变废为宝,利用废铁屑和其他化学试剂进行如下操作,可以获得铁红、Al(OH)3、固体C等化学试剂。回答下列问题:
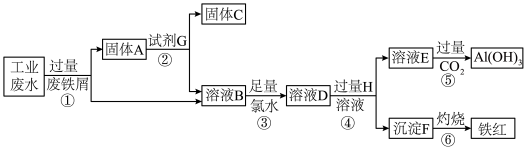
(1)溶液E焰色试验呈黄色,透过蓝色钴玻璃未见紫色。为了尽量减少杂质的引入,试剂G最好选择_______ (填序号,下同);试剂H是_______ 。
a.盐酸 b.硝酸 c.NaOH d.KOH
(2)反应②的离子方程式为_______ ;反应③的离子方程式为_______ 。
Ⅱ.以上流程中步骤③中所用氯水为氯气的水溶液,氯气的制备分为实验室制法和工业制法。
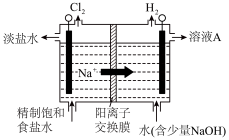
(3)实验室制氯气常用软锰矿(主要成分为MnO2)与浓盐酸混合加热,请用化学方程式表示涉及的化学反应_______ 。
(4)工业常用图装置制备氯气,产生氯气的电极应与电源_______ (选填“正极”或“负极”)相连,发生的电极反应为_______ 。
(5)氯气用途十分广泛,其中1984年北京地坛医院的前身北京第一传染病医院的医生们将氯气通入浓氢氧化钠溶液中,成功研制出了能迅速杀灭各类肝炎病毒的消毒液,请你用离子方程式表示这一过程中的主要反应_______ 。
 、Fe3+、Al3+、Cu2+,为了减少环境污染,变废为宝,利用废铁屑和其他化学试剂进行如下操作,可以获得铁红、Al(OH)3、固体C等化学试剂。回答下列问题:
、Fe3+、Al3+、Cu2+,为了减少环境污染,变废为宝,利用废铁屑和其他化学试剂进行如下操作,可以获得铁红、Al(OH)3、固体C等化学试剂。回答下列问题:
(1)溶液E焰色试验呈黄色,透过蓝色钴玻璃未见紫色。为了尽量减少杂质的引入,试剂G最好选择
a.盐酸 b.硝酸 c.NaOH d.KOH
(2)反应②的离子方程式为
Ⅱ.以上流程中步骤③中所用氯水为氯气的水溶液,氯气的制备分为实验室制法和工业制法。

(3)实验室制氯气常用软锰矿(主要成分为MnO2)与浓盐酸混合加热,请用化学方程式表示涉及的化学反应
(4)工业常用图装置制备氯气,产生氯气的电极应与电源
(5)氯气用途十分广泛,其中1984年北京地坛医院的前身北京第一传染病医院的医生们将氯气通入浓氢氧化钠溶液中,成功研制出了能迅速杀灭各类肝炎病毒的消毒液,请你用离子方程式表示这一过程中的主要反应
更新时间:2024-03-30 22:33:45
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】工业上电解制碱的技术是用阳离子交换膜法,主要原料是饱和食盐水。图一为阳离子交换膜法电解原理示意图。请回答下列问题:

(1)反应的离子方程式是___ 。A、B、C、D所对应物质化学式分别为__________ 、____ 、______ 、_______ ,每通过0.1mol电子,就有0.1mol____ (填离子符号)通过离子交换膜。
(2)若上述电解过程中用阴离子交换膜代替阳离子交换膜(已知:3Cl2 +6OH- = 5Cl-+ClO3-+3H2O),下列说法正确的组合是___________ 。
A.电解结束时,右侧溶液中含有ClO3—
B.电解槽内发生反应的总化学方程式为:NaCl + 3H2O NaClO3 + 3H2↑
NaClO3 + 3H2↑
C.用阴离子交换膜后,电解槽内两个电极发生的电极反应与原来一样
D.用阴离子交换膜后,阳离子的定向移动方向与原来相反
(3)如果用熔融碳酸盐CO燃料电池供电,图二为其工作原理,A、B极的电极反应分别是____ 、_______________ 。

(1)反应的离子方程式是
(2)若上述电解过程中用阴离子交换膜代替阳离子交换膜(已知:3Cl2 +6OH- = 5Cl-+ClO3-+3H2O),下列说法正确的组合是
A.电解结束时,右侧溶液中含有ClO3—
B.电解槽内发生反应的总化学方程式为:NaCl + 3H2O
 NaClO3 + 3H2↑
NaClO3 + 3H2↑C.用阴离子交换膜后,电解槽内两个电极发生的电极反应与原来一样
D.用阴离子交换膜后,阳离子的定向移动方向与原来相反
(3)如果用熔融碳酸盐CO燃料电池供电,图二为其工作原理,A、B极的电极反应分别是
您最近一年使用:0次
【推荐2】某小组电解K2Cr2O7溶液,研究过程如下:
实验一 电压不同时,用石墨电极电解硫酸酸化的pH=2.5的饱和K2Cr2O7 溶液,实验现象如下:
(1)阳极产生的气体是______________________ 。
(2)电压为2.0 V时,阴极区检出Cr3+,结合实验现象判断在阴极放电的主要离子是_______ 。
(3)电压高于5.0 V时,被电解的主要物质是______________ 。
实验二 探究其他因素对电解K2Cr2O7溶液的影响。用相同强度的稳恒电流(单位时间内转移的电子数始终相同),分别电解3份500 mL相同浓度的K2Cr2O7溶液,电解时间均为30 min。实验结果如下:
(4)对比Ⅰ、Ⅱ可知,阴极表面是否析出金属Cr,以及Ⅱ中Cr2O72−的还原率提高均与______ 填离子符号)有关。
(5)Ⅲ中Cr2O72−还原率较Ⅰ、Ⅱ有较大提高,分析其原因:
①阳极区:阳极反应:_______ ,进而使Cr2O72−被还原。
②阴极区:由于_______ ,进而促进了Cr2O72−在阴极区被还原,依据的实验现象是___________ 。
(6)工业上处理含Cr2O72−的废水,用铁作阳极,控制一定的电压,初始pH为3~4,将Cr2O72−最终转化为难溶的Cr(OH)3除去,结合上述实验,电压不宜过高、pH不宜过小的目的,除节约成本和防止腐蚀设备外,还有__________ 。
实验一 电压不同时,用石墨电极电解硫酸酸化的pH=2.5的饱和K2Cr2O7 溶液,实验现象如下:
| 电压/V | 实验现象 |
| 2.0 | 阳极缓慢产生少量气泡,阴极没有气泡 |
| 3.0 | 阳极产生较多气泡,阴极产生少量气泡 |
| >5.0 | 两极均快速产生大量气泡,阴极产生气泡的速率约为阳极的2倍 |
(2)电压为2.0 V时,阴极区检出Cr3+,结合实验现象判断在阴极放电的主要离子是
(3)电压高于5.0 V时,被电解的主要物质是
实验二 探究其他因素对电解K2Cr2O7溶液的影响。用相同强度的稳恒电流(单位时间内转移的电子数始终相同),分别电解3份500 mL相同浓度的K2Cr2O7溶液,电解时间均为30 min。实验结果如下:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 电极材料 | 阴极:石墨 阳极:石墨 | 阴极:石墨 阳极:石墨 | 阴极:石墨 阳极:铁 |
| 加入的物质 | 1 mL浓硫酸 | 1 mL浓硫酸、 少量硫酸铁 | 1 mL浓硫酸 |
| 电极表面是否产生气泡 | 两极均产生气泡 | 两极均产生气泡 | 阴极:产生气泡 阳极:无明显气泡产生 |
| Cr2O72−还原率/% | 12.7 | 20.8 | 57.3 |
| 阴极变化 | 实验结束后取出电极,仅Ⅰ中阴极上附着银白色固体,经检验为金属Cr | ||
(5)Ⅲ中Cr2O72−还原率较Ⅰ、Ⅱ有较大提高,分析其原因:
①阳极区:阳极反应:
②阴极区:由于
(6)工业上处理含Cr2O72−的废水,用铁作阳极,控制一定的电压,初始pH为3~4,将Cr2O72−最终转化为难溶的Cr(OH)3除去,结合上述实验,电压不宜过高、pH不宜过小的目的,除节约成本和防止腐蚀设备外,还有
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】海洋资源丰富,海水水资源的利用和海水化学资源(主要为NaCl 和MgSO4及K、Br 等元素)的利用具有非常广阔的前景。
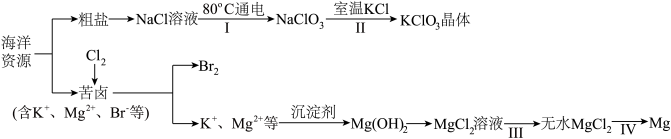
回答下列问题:
(1)NaCl 溶液由粗盐水精制而成,为除去Ca2+和Mg2+,要加入的试剂分别为__________________ 、__________________ 。
(2)写出步骤Ⅰ 中反应的总化学方程式为NaCl+ ═NaClO3+ 。_____
(3)已知MgCl2溶液受热时易水解(和水反应)生成Mg(OH)Cl,写出该过程的化学方程式__________________________________ 。
(4)步骤Ⅳ中,电解熔融MgCl2 得到的镁需要在保护气中冷却,下列气体可以作为保护气的是_______________。

回答下列问题:
(1)NaCl 溶液由粗盐水精制而成,为除去Ca2+和Mg2+,要加入的试剂分别为
(2)写出步骤Ⅰ 中反应的总化学方程式为NaCl+ ═NaClO3+ 。
(3)已知MgCl2溶液受热时易水解(和水反应)生成Mg(OH)Cl,写出该过程的化学方程式
(4)步骤Ⅳ中,电解熔融MgCl2 得到的镁需要在保护气中冷却,下列气体可以作为保护气的是_______________。
| A.N2 | B.H2 | C.CO2 | D.空气 |
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】利用电解饱和食盐水制备盐酸和漂白液的流程如下图:

已知A是一种无色的气体,在空气中燃烧发出淡蓝色的火焰,B是一种黄绿色的有毒气体,C溶液能使酚酞变红色。请回答下列问题:
(1)步骤Ⅰ用到的玻璃仪器有玻璃棒、_______ 。
(2)步骤Ⅱ反应的化学方程式为:_______ 。
(3)步骤Ⅴ反应的离子方程式为:_______ 。
(4)往装有KI溶液的试管通入B,发生反应的离子方程式为:_______ ;再加入CCl4,振荡、静置,下层溶液显_______ 。
(5)漂白液广泛用于漂白性、杀菌、消毒,是因为_______ 。

已知A是一种无色的气体,在空气中燃烧发出淡蓝色的火焰,B是一种黄绿色的有毒气体,C溶液能使酚酞变红色。请回答下列问题:
(1)步骤Ⅰ用到的玻璃仪器有玻璃棒、
(2)步骤Ⅱ反应的化学方程式为:
(3)步骤Ⅴ反应的离子方程式为:
(4)往装有KI溶液的试管通入B,发生反应的离子方程式为:
(5)漂白液广泛用于漂白性、杀菌、消毒,是因为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】某粗盐溶液中除泥沙外,还含有 、
、 、
、 等杂质离子,粗盐提纯后可以通过侯氏制碱法和氯碱工业制取多种重要工业产品。下图是有关工艺流程,A、B、C、D、E、F为中学化学常见物质。
等杂质离子,粗盐提纯后可以通过侯氏制碱法和氯碱工业制取多种重要工业产品。下图是有关工艺流程,A、B、C、D、E、F为中学化学常见物质。
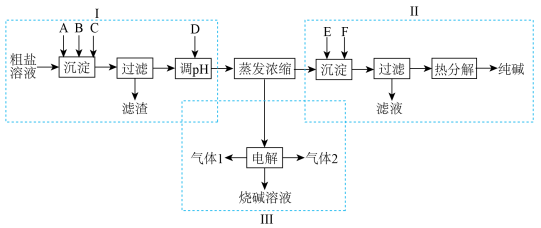
回答下列问题:
(1)环节I中A、B、C依次应加入的物质为NaOH、___________ 、___________ ,加入D发生反应的离子方程式为___________ 。
(2)环节Ⅱ中为了产生更多沉淀,应先通入过量的气体E为___________ ,再通入___________ (填“少量”、或“过量”)的F,这时发生反应的化学方程式为___________ 。热分解时需用到的仪器为___________ (填符号)
A.表面皿B.蒸发皿C.培养皿D.坩埚
(3)环节Ⅲ在阴极发生的电极反应为___________ ,产生的气体2可以与所得烧碱溶液发生反应制取消毒液,化学方程式为___________ 。
(4)该工艺流程中可以直接循环利用的物质为___________ 。
 、
、 、
、 等杂质离子,粗盐提纯后可以通过侯氏制碱法和氯碱工业制取多种重要工业产品。下图是有关工艺流程,A、B、C、D、E、F为中学化学常见物质。
等杂质离子,粗盐提纯后可以通过侯氏制碱法和氯碱工业制取多种重要工业产品。下图是有关工艺流程,A、B、C、D、E、F为中学化学常见物质。
回答下列问题:
(1)环节I中A、B、C依次应加入的物质为NaOH、
(2)环节Ⅱ中为了产生更多沉淀,应先通入过量的气体E为
A.表面皿B.蒸发皿C.培养皿D.坩埚
(3)环节Ⅲ在阴极发生的电极反应为
(4)该工艺流程中可以直接循环利用的物质为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
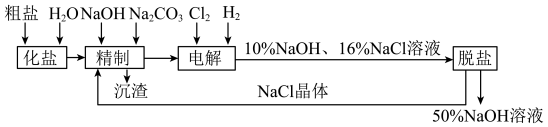
依据上图,回答:
(1)如果粗盐中含SO42-含量较高必须添加钡试剂除去SO42-,该钡试剂可以是___________
A. Ba(OH)2 B. Ba(NO3)2 C.BaCl2
(2)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序是________
A.NaOH、Na2CO3、钡试剂 B.NaOH、钡试剂、Na2CO3 C.钡试剂、NaOH、Na2CO3
(3)电解过程中,________ 极生成Cl2,写出检验该产物的方法__________ 。

依据上图,回答:
(1)如果粗盐中含SO42-含量较高必须添加钡试剂除去SO42-,该钡试剂可以是
A. Ba(OH)2 B. Ba(NO3)2 C.BaCl2
(2)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序是
A.NaOH、Na2CO3、钡试剂 B.NaOH、钡试剂、Na2CO3 C.钡试剂、NaOH、Na2CO3
(3)电解过程中,
您最近一年使用:0次



