工业废水中的氨氨(以NH3、 形式存在),可通过微生物法或氧化法处理,使水中氨氮达到国家规定的排放标准。
形式存在),可通过微生物法或氧化法处理,使水中氨氮达到国家规定的排放标准。
(1)微生物法:(酸性废水中的部分 在硝化细菌的作用下被氧气氧化为
在硝化细菌的作用下被氧气氧化为 ,
, 作用生成N2。
作用生成N2。
① 转化为
转化为 的离子方程式为
的离子方程式为___________ 。
② 与
与 在转化为N2的反应中消耗
在转化为N2的反应中消耗 与
与 的物质的量之比为
的物质的量之比为___________ 。
(2)次氯酸钠氧化法:向氨氮废水中加入NaClO,氨氮转化为N2而除去。NaClO氧化NH3的离子方程式为___________ 。
(3)活性炭-臭氧氧化法:活性炭-臭氧氧化氨氮的机理如图所示。*表示吸附在活性炭表面的物种,·OH为羟基自由基,其氧化性比O3更强。

活性炭奥氧氧化氨氮的机理可描述为___________ 。
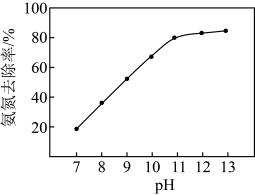
②其它条件不变调节废水的pH,废水中氨氮去除率随pH的变化如题17图-3所示。随pH增大氨氮去除率先明显增大,后变化较小,可能的原因是___________ 。
 形式存在),可通过微生物法或氧化法处理,使水中氨氮达到国家规定的排放标准。
形式存在),可通过微生物法或氧化法处理,使水中氨氮达到国家规定的排放标准。(1)微生物法:(酸性废水中的部分
 在硝化细菌的作用下被氧气氧化为
在硝化细菌的作用下被氧气氧化为 ,
, 作用生成N2。
作用生成N2。①
 转化为
转化为 的离子方程式为
的离子方程式为②
 与
与 在转化为N2的反应中消耗
在转化为N2的反应中消耗 与
与 的物质的量之比为
的物质的量之比为(2)次氯酸钠氧化法:向氨氮废水中加入NaClO,氨氮转化为N2而除去。NaClO氧化NH3的离子方程式为
(3)活性炭-臭氧氧化法:活性炭-臭氧氧化氨氮的机理如图所示。*表示吸附在活性炭表面的物种,·OH为羟基自由基,其氧化性比O3更强。

活性炭奥氧氧化氨氮的机理可描述为
②其它条件不变调节废水的pH,废水中氨氮去除率随pH的变化如题17图-3所示。随pH增大氨氮去除率先明显增大,后变化较小,可能的原因是

更新时间:2024-04-06 16:34:52
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】R、W、X、Y、M是原子序数依次增大的五种主族元素。R的最常见同位素的原子核中不含中子。W与X可形成两种稳定的化合物:WX和WX2。工业革命以来,人类使用的化石燃料在燃烧过程中将大量WX2排入大气,在一定程度上导致地球表而平均温度升高,Y与X是同一主族的元素,且在元素周期表中与X相邻。
(1)WX2的电子式是_______ 。
(2)R2X、R2Y中,稳定性较高的是_______ (填化学式)。
(3)Se与Y是同一主族元素,且在元素周期表中与Y相邻。
①根据元素周期律,下列推断正确的是_______ (填字母)。
A.Se的最高正化合价为+7 B. H2Se的还原性比H2Y强
C. H2SeO3的酸性比H2YO4强 D. SeO2在一定条件下可与NaOH溶液反应
②室温下向SeO2固体表面吹入NH3,可得到两种单质和H2O,该反应的化学方程式为_______ 。
(4)科研人员从矿石中分离出一种氧化物。化学式可表示为M2O3。为确定M元素的种类。进行了一系列实验,结果如下:
①M的相对原子质量介于K和Rb(铷)之间;
②0.01 mol M2O3在碱性溶液中与Zn充分反应可得到M的简单氢化物。反应完全时,被M2O3氧化的Zn为0.06 mol。
综合以上信息推断,M可能位于元素周期表第_______ 族。
(1)WX2的电子式是
(2)R2X、R2Y中,稳定性较高的是
(3)Se与Y是同一主族元素,且在元素周期表中与Y相邻。
①根据元素周期律,下列推断正确的是
A.Se的最高正化合价为+7 B. H2Se的还原性比H2Y强
C. H2SeO3的酸性比H2YO4强 D. SeO2在一定条件下可与NaOH溶液反应
②室温下向SeO2固体表面吹入NH3,可得到两种单质和H2O,该反应的化学方程式为
(4)科研人员从矿石中分离出一种氧化物。化学式可表示为M2O3。为确定M元素的种类。进行了一系列实验,结果如下:
①M的相对原子质量介于K和Rb(铷)之间;
②0.01 mol M2O3在碱性溶液中与Zn充分反应可得到M的简单氢化物。反应完全时,被M2O3氧化的Zn为0.06 mol。
综合以上信息推断,M可能位于元素周期表第
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
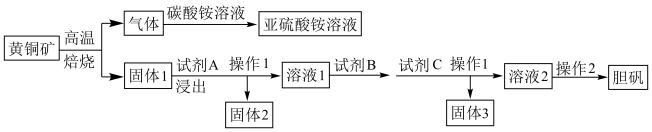
【推荐2】经多年勘测,2018年11月23日安徽省自然资源厅发布消息称在皖江地区发现特大铜矿床,具有重大实际意义。以黄铜矿(主要成分为CuFeS2,含有少量PbS、Al2O3、SiO2)为原料制取胆矾的流程如下图:
已知:常温下Ksp[Fe(OH)3]=8.0×10-38, Ksp[Al(OH)3]=3.0×10-33,Ksp[Cu(OH)2]=3.0×10-20。
(1)写出上述流程中生成亚硫酸铵的离子方程式:___________ ,试剂B为H2O2,写出相应的离子方程式:___________ ;
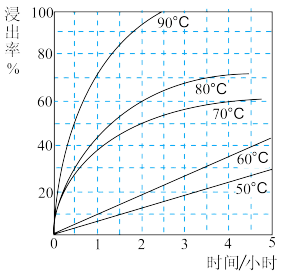
(2)最适合的试剂A是___________ (写化学式)溶液,固体2的成分为PbSO4和___________ (写化学式)。当试剂A的浓度为6mol·L-1时,“浸出”实验中,铜的浸出率结果如图所示。所采用的最佳实验条件(温度、时间)为___________ 。
(3)操作2的步骤为___________ 、___________ 过滤、洗涤。
(4)试剂C的作用是调节pH,可以选择的药品是___________ (写化学式),
(5)根据已知信息,请计算:当Fe3+完全沉淀时,溶液中Al3+理论最大浓度为___________ 。(提示:当离子浓度≤1×10-5mol·L时,认为该离子沉淀完)

已知:常温下Ksp[Fe(OH)3]=8.0×10-38, Ksp[Al(OH)3]=3.0×10-33,Ksp[Cu(OH)2]=3.0×10-20。
(1)写出上述流程中生成亚硫酸铵的离子方程式:
(2)最适合的试剂A是

(3)操作2的步骤为
(4)试剂C的作用是调节pH,可以选择的药品是
(5)根据已知信息,请计算:当Fe3+完全沉淀时,溶液中Al3+理论最大浓度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
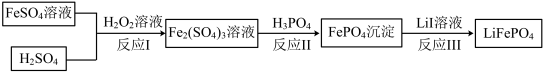
【推荐3】2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂(LiFePO4)。LiFePO4的一种制备方法如下。
已知:H3PO4能电离出 。
。
(1)Li在元素周期表中的位置是___________ 。
(2)LiFePO4中,Fe元素的化合价为___________ 。
(3)反应I的离子方程式是___________ 。
(4)反应III的化学方程式是___________ 。

已知:H3PO4能电离出
 。
。(1)Li在元素周期表中的位置是
(2)LiFePO4中,Fe元素的化合价为
(3)反应I的离子方程式是
(4)反应III的化学方程式是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】合成氨以及氨催化氧化制硝酸的流程如图所示。
(1)“氧化”时,产生的主要气体为___________ (填“ ”或“NO”)。
”或“NO”)。
(2)物质A不可能为___________ (填“ ”或“
”或“ ”)。
”)。
(3)浓硝酸见光易分解,通常应保存在___________ (填“棕色”或“无色”)试剂瓶中。
(4)在一定条件下发生反应: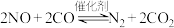 可以缓解大气中CO、NO污染问题。在1L密闭容器中加入2molNO、2molCO,在2min末测得
可以缓解大气中CO、NO污染问题。在1L密闭容器中加入2molNO、2molCO,在2min末测得 的物质的量为1mol。则:
的物质的量为1mol。则:
①2min末时NO的转化率为___________ ;
②催化剂___________ (填“可以”或“不可以”)提高反应物的转化率。

(1)“氧化”时,产生的主要气体为
 ”或“NO”)。
”或“NO”)。(2)物质A不可能为
 ”或“
”或“ ”)。
”)。(3)浓硝酸见光易分解,通常应保存在
(4)在一定条件下发生反应:
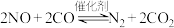 可以缓解大气中CO、NO污染问题。在1L密闭容器中加入2molNO、2molCO,在2min末测得
可以缓解大气中CO、NO污染问题。在1L密闭容器中加入2molNO、2molCO,在2min末测得 的物质的量为1mol。则:
的物质的量为1mol。则:①2min末时NO的转化率为
②催化剂
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】I.某化学自主实验小组利用如图所示装置探究 能否被
能否被 还原(
还原( 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。

(1)A装置发生的化学反应方程式为_______ 。E装置发生的化学反应方程式为_______ 。
(2)甲、乙分别是_______ (填标号)。
a.浓硫酸、浓硫酸 b.碱石灰、无水氯化钙 c.碱石灰、碱石灰 d.五氧化二磷、五氧化二磷
(3)若NO2能够被NH3还原,写出发生反应的化学方程式:_______ 。
(4)此实验装置存在一个明显的缺陷是_______ 。
II.硫酸可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如下:
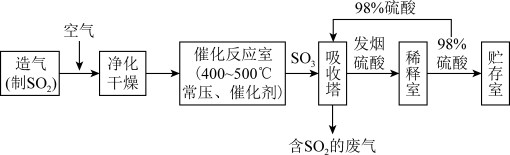
(5)工业上常以黄铁矿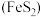 为原料来制备
为原料来制备 ,另外还生成了氧化铁,请写出该反应的化学方程式:
,另外还生成了氧化铁,请写出该反应的化学方程式:_______ 。
(6)写出催化反应室中 被氧化为
被氧化为 的化学方程式
的化学方程式_______ 。
(7)硫酸工业的尾气中含有少量 ,若直接排放会污染空气,并导致硫酸型酸雨。可用
,若直接排放会污染空气,并导致硫酸型酸雨。可用_______ 吸收。
 能否被
能否被 还原(
还原( 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。
(1)A装置发生的化学反应方程式为
(2)甲、乙分别是
a.浓硫酸、浓硫酸 b.碱石灰、无水氯化钙 c.碱石灰、碱石灰 d.五氧化二磷、五氧化二磷
(3)若NO2能够被NH3还原,写出发生反应的化学方程式:
(4)此实验装置存在一个明显的缺陷是
II.硫酸可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如下:

(5)工业上常以黄铁矿
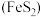 为原料来制备
为原料来制备 ,另外还生成了氧化铁,请写出该反应的化学方程式:
,另外还生成了氧化铁,请写出该反应的化学方程式:(6)写出催化反应室中
 被氧化为
被氧化为 的化学方程式
的化学方程式(7)硫酸工业的尾气中含有少量
 ,若直接排放会污染空气,并导致硫酸型酸雨。可用
,若直接排放会污染空气,并导致硫酸型酸雨。可用
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】氮及其化合物是重要的化工原料,研究其性质、用途和转化具有重要意义。
回答下列问题:___________ (填“离子”或“共价”)化合物;常温下,NO2为___________ (填颜色)气体。
(2)物质N2H4(肼)可作为火箭发动机的燃料,已知在298K、101kPa时1g液态肼燃烧生成氮气和液态水,释放19.44kJ的热量,写出表示其燃烧热的热化学方程式___________ 。
(3)农业上常用物质R作氮肥,实验室检验物质R中阳离子的方法为___________ (写出操作过程和现象)。
(4)硫可与Q的浓溶液反应,硫转化为___________ (化学式)。
(5)氮的氧化物(NOx)是常见的大气污染物之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。当物质Y与NO2的物质的量之比为1:1时,与足量氨气能在催化剂作用下发生反应,生成两种无污染的物质,该反应的化学方程式为___________ 。
回答下列问题:

(2)物质N2H4(肼)可作为火箭发动机的燃料,已知在298K、101kPa时1g液态肼燃烧生成氮气和液态水,释放19.44kJ的热量,写出表示其燃烧热的热化学方程式
(3)农业上常用物质R作氮肥,实验室检验物质R中阳离子的方法为
(4)硫可与Q的浓溶液反应,硫转化为
(5)氮的氧化物(NOx)是常见的大气污染物之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。当物质Y与NO2的物质的量之比为1:1时,与足量氨气能在催化剂作用下发生反应,生成两种无污染的物质,该反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】最近,宿城一中在校园内喷洒了“84消毒液”,它能有效杀灭新冠病毒。刘冠宇同学购买了一瓶“84消毒液”,用于自己家院落的消毒,该消毒液包装说明如图:
该“84消毒液”通常稀释100倍(体积之比)后使用。
回答下列问题:
(1)NaClO属于________ 类物质(填字母)
A.酸 B.碱 C.盐 D.氧化物 E.纯净物 F.混合物
(2)该“84消毒液”的物质的量浓度约为________ mol·L-1(保留1位小数)。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是________ (填序号)。

A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.需要称量NaClO固体的质量为143.0 g
C.容量瓶用蒸馏水洗净后,不用烘干便能用于溶液配制
(4)已知“84消毒液”和洁厕灵(主要成分为盐酸)不能混用,否则会产生有毒的黄绿色气体,请写出发生反应的离子方程式________________ 。
(5)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用18.4mol·L-1(质量分数为98%,密度为1.84 g·cm-3)的浓硫酸配制100 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①需用浓硫酸的体积为________ mL。
②为配制上述稀硫酸除烧杯、玻璃棒、胶头滴管、试剂瓶外,还缺少的玻璃仪器是________ 。
③将所配制的稀硫酸进行测定,发现实际浓度大于2.3mol·L-1。会引起所配溶液浓度偏高的操作有________ (填序号)。
A.用量筒量取浓硫酸时,仰视量筒的刻度线
B.容量瓶未干燥就用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移至容量瓶中
D.烧杯中稀溶液往容量瓶中转移时,有少量液体溅出
E.用量筒量取浓硫酸后未洗涤量筒
F.定容时俯视容量瓶刻度线
| 84消毒液 【有效成分】NaClO 【规格】1000mL 【质量分数】25% 【密度】1.19g•cm-3 |
回答下列问题:
(1)NaClO属于
A.酸 B.碱 C.盐 D.氧化物 E.纯净物 F.混合物
(2)该“84消毒液”的物质的量浓度约为
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是

A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.需要称量NaClO固体的质量为143.0 g
C.容量瓶用蒸馏水洗净后,不用烘干便能用于溶液配制
(4)已知“84消毒液”和洁厕灵(主要成分为盐酸)不能混用,否则会产生有毒的黄绿色气体,请写出发生反应的离子方程式
(5)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用18.4mol·L-1(质量分数为98%,密度为1.84 g·cm-3)的浓硫酸配制100 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①需用浓硫酸的体积为
②为配制上述稀硫酸除烧杯、玻璃棒、胶头滴管、试剂瓶外,还缺少的玻璃仪器是
③将所配制的稀硫酸进行测定,发现实际浓度大于2.3mol·L-1。会引起所配溶液浓度偏高的操作有
A.用量筒量取浓硫酸时,仰视量筒的刻度线
B.容量瓶未干燥就用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移至容量瓶中
D.烧杯中稀溶液往容量瓶中转移时,有少量液体溅出
E.用量筒量取浓硫酸后未洗涤量筒
F.定容时俯视容量瓶刻度线
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】“84消毒液”是家居常用的防疫用品,某小组同学查看包装说明,得到如下信息:
该小组同学进行了如下实验。回答下列问题:
(1)稀释:将“84消毒液”原液稀释配制成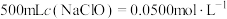 的溶液。
的溶液。
①稀释过程中,需要用到的玻璃仪器有烧杯、玻璃棒、量筒、__________ 、__________ 。
②稀释时,需要取用__________ mL“84消毒液”原液。
③下列操作会使溶液中 浓度偏高的是
浓度偏高的是__________ (填标号)。
A.取用久置的“84消毒液”原液进行稀释
B.定容时,俯视刻度线
C.量取“84消毒液”原液时,仰视读数
D.定容摇匀后,液面低于刻度线,再加水至刻度线
(2)利用如图所示装置探究“84消毒液”与洁厕灵的反应:
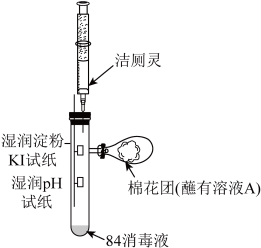
①将注射器中的洁厕灵注入试管中,可观察到试管内产生黄绿色气体,pH试纸__________ 。
②棉花团蘸取的溶液A是__________ ,其作用是__________ 。
③该小组查资料得:“84消毒液”也不能与双氧水混合,两者混合会产生一种无色无味气体,使其消毒能力大大降低,写出该反应的化学方程式__________ 。
84消毒液 【有效成分】  【规格】  【浓度】 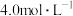 注:①按一定比例稀释后使用 ②不得与酸性产品(如洁厕灵)同时使用 |
(1)稀释:将“84消毒液”原液稀释配制成
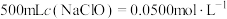 的溶液。
的溶液。①稀释过程中,需要用到的玻璃仪器有烧杯、玻璃棒、量筒、
②稀释时,需要取用
③下列操作会使溶液中
 浓度偏高的是
浓度偏高的是A.取用久置的“84消毒液”原液进行稀释
B.定容时,俯视刻度线
C.量取“84消毒液”原液时,仰视读数
D.定容摇匀后,液面低于刻度线,再加水至刻度线
(2)利用如图所示装置探究“84消毒液”与洁厕灵的反应:

①将注射器中的洁厕灵注入试管中,可观察到试管内产生黄绿色气体,pH试纸
②棉花团蘸取的溶液A是
③该小组查资料得:“84消毒液”也不能与双氧水混合,两者混合会产生一种无色无味气体,使其消毒能力大大降低,写出该反应的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】回答下列问题
(1)应对新冠肺炎疫情,“84消毒液”是生活中常用的消毒剂。某化学小组配制了500 mL“84消毒液”,并在试剂瓶上贴上如图所示标签。
①该“84消毒液”有效成分的物质的量浓度为______  。
。
②下列说法正确的有______ 。
A.配制过程只需要四种仪器即可完成
B.容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制
C.所配得的NaClO消毒液在空气中光照,久置后溶液中的NaClO的物质的量浓度减小
D.上下颠倒摇匀后发现溶液凹液面低于刻度线,应再加水至刻度线
E.定容时,若加水超过刻度线,应重新配制溶液
F.定容时,若俯视刻度线,会使所配制溶液浓度偏低
③“消毒液”中氯元素的存在形态与溶液pH的关系如表:
请写出pH降低时产生氯气的离子方程式____________ 。
(2)下列各组物质相互混合反应后,最终有白色沉淀生成的是______ (填序号)。
①金属钠投入到 溶液中 ②
溶液中 ② 和足量稀盐酸溶液混合
和足量稀盐酸溶液混合
③少量 投入过量
投入过量 溶液中 ④氯化钙溶液中通入少量的
溶液中 ④氯化钙溶液中通入少量的
⑤向饱和 溶液中通入足量
溶液中通入足量 ⑥向
⑥向 溶液中通入足量
溶液中通入足量 溶液
溶液
(3)某溶液可能含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的几种离子,已知各离子的物质的量浓度均相等,进行如下实验:
中的几种离子,已知各离子的物质的量浓度均相等,进行如下实验:
Ⅰ.取少量该溶液,加入足量稀硫酸,无明显现象。
Ⅱ.取实验Ⅰ反应后的溶液,加入足量浓NaOH溶液,最终得到红褐色沉淀,并伴有刺激性气味气体产生(该气体为 )。
)。
①该溶液中肯定存在的离子有______ 。
②若取原溶液进行焰色试验,焰色显黄色,则溶液中一定存在的离子有______ 种。
(1)应对新冠肺炎疫情,“84消毒液”是生活中常用的消毒剂。某化学小组配制了500 mL“84消毒液”,并在试剂瓶上贴上如图所示标签。
“84消毒液” |
有效成分:NaClO 规格:500 mL 质量分数:14.9% 密度: |
 。
。②下列说法正确的有
A.配制过程只需要四种仪器即可完成
B.容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制
C.所配得的NaClO消毒液在空气中光照,久置后溶液中的NaClO的物质的量浓度减小
D.上下颠倒摇匀后发现溶液凹液面低于刻度线,应再加水至刻度线
E.定容时,若加水超过刻度线,应重新配制溶液
F.定容时,若俯视刻度线,会使所配制溶液浓度偏低
③“消毒液”中氯元素的存在形态与溶液pH的关系如表:
溶液pH | >9 | 5~6 | 4~5 | 2~3 | <2 |
主要成分 | NaClO | HCl与NaClO(少量) | HCl与 | HClO与 |
|
(2)下列各组物质相互混合反应后,最终有白色沉淀生成的是
①金属钠投入到
 溶液中 ②
溶液中 ② 和足量稀盐酸溶液混合
和足量稀盐酸溶液混合③少量
 投入过量
投入过量 溶液中 ④氯化钙溶液中通入少量的
溶液中 ④氯化钙溶液中通入少量的
⑤向饱和
 溶液中通入足量
溶液中通入足量 ⑥向
⑥向 溶液中通入足量
溶液中通入足量 溶液
溶液(3)某溶液可能含有
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的几种离子,已知各离子的物质的量浓度均相等,进行如下实验:
中的几种离子,已知各离子的物质的量浓度均相等,进行如下实验:Ⅰ.取少量该溶液,加入足量稀硫酸,无明显现象。
Ⅱ.取实验Ⅰ反应后的溶液,加入足量浓NaOH溶液,最终得到红褐色沉淀,并伴有刺激性气味气体产生(该气体为
 )。
)。①该溶液中肯定存在的离子有
②若取原溶液进行焰色试验,焰色显黄色,则溶液中一定存在的离子有
您最近一年使用:0次

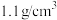
 (少量)
(少量)

