某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,加入CuO调至溶液pH=4,使Fe3+转化为Fe(OH)3沉淀。
(1)过滤后,为了得到CuCl2·2H2O晶体,应该选择_______ 结晶的方式。
(2)由CuCl2·2H2O晶体得到纯的无水CuCl2,需要进行的操作是_______ 。
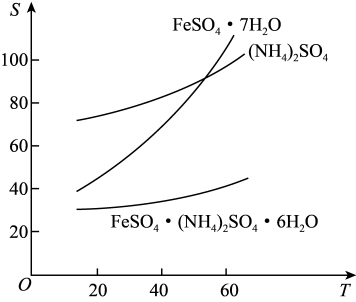
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800g试样溶于水,加入过量KI固体,充分反应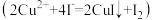 ,再用0.1000mol/LNa2S2O3标准溶液滴定,达到滴定终点时,消耗Na2S2O3标准溶液40.00mL。(已知:
,再用0.1000mol/LNa2S2O3标准溶液滴定,达到滴定终点时,消耗Na2S2O3标准溶液40.00mL。(已知: )
)
①滴定终点的现象是____ 。
②该试样中CuCl2·2H2O的质量分数为_____ 。
(1)过滤后,为了得到CuCl2·2H2O晶体,应该选择
(2)由CuCl2·2H2O晶体得到纯的无水CuCl2,需要进行的操作是
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800g试样溶于水,加入过量KI固体,充分反应
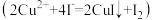 ,再用0.1000mol/LNa2S2O3标准溶液滴定,达到滴定终点时,消耗Na2S2O3标准溶液40.00mL。(已知:
,再用0.1000mol/LNa2S2O3标准溶液滴定,达到滴定终点时,消耗Na2S2O3标准溶液40.00mL。(已知: )
)①滴定终点的现象是
②该试样中CuCl2·2H2O的质量分数为
更新时间:2024-04-27 13:03:03
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】草酸亚铁晶体(FeC2O4·xH2O)是一种淡黄色晶体,难溶于水。某小组以工业废铁屑为原料制备草酸亚铁晶体,并测定其结晶水含量。
I.制备FeC2O4·xH2O晶体
步骤一:取适量工业废铁屑,用试剂A煮沸并水洗以除去油污,再加入稍过量H2SO4至反应完全;
步骤二:向步骤一中溶液加入适量(NH4)2SO4溶液,调pH范围为1~2,反应一段时间;
步骤三:蒸发溶液至出现较多晶体时,经操作B,得到FeSO4(NH4)2SO4·6H2O晶体;
步骤四:称取6gFeSO4·(NH4)2SO4·6H2O晶体于200mL烧杯中,加入30mL水和2mL稀硫酸,加热溶解,随后加入40mL1mol·L-1的H2C2O4溶液,加热至沸腾,不断搅拌,待有黄色沉淀析出后,静置,过滤,洗涤,晾干,得到FeC2O4·xH2O晶体。
已知:i.当pH>4时,Fe2+易被氧气氧化;
ii.几种物质的溶解度S(g/100gH2O)随温度T(C)变化的曲线如下图所示;
iii.氧化性:MnO >Fe3+>CO2。
>Fe3+>CO2。
(1)步骤一中试剂A的名称是___________
(2)步骤二中用稀硫酸调溶液pH至1~2的目的是抑制Fe2+与NH 水解和
水解和___________
(3)步骤三中操作B是___________
(4)步骤四中生成晶体的离子方程式为___________
II.测定草酸亚铁晶体(FeC2O4·xH2O)中的x值
(5)溶液配制:称取mg样品,用新煮沸并冷却的稀硫酸在___________ (填仪器名称,下同)中溶解,完全溶解后,全部转移至100mL___________ 中,定容。
(6)取25.00mL溶液,用KMnO4酸性溶液滴定,当________ 时为滴定终点。平行滴定3次,消耗cmol·L-1酸性KMnO4溶液的平均用量为VmL,则FeC2O4·xH2O中x的值为______ (用含m、c、V的式子表示)。
I.制备FeC2O4·xH2O晶体
步骤一:取适量工业废铁屑,用试剂A煮沸并水洗以除去油污,再加入稍过量H2SO4至反应完全;
步骤二:向步骤一中溶液加入适量(NH4)2SO4溶液,调pH范围为1~2,反应一段时间;
步骤三:蒸发溶液至出现较多晶体时,经操作B,得到FeSO4(NH4)2SO4·6H2O晶体;
步骤四:称取6gFeSO4·(NH4)2SO4·6H2O晶体于200mL烧杯中,加入30mL水和2mL稀硫酸,加热溶解,随后加入40mL1mol·L-1的H2C2O4溶液,加热至沸腾,不断搅拌,待有黄色沉淀析出后,静置,过滤,洗涤,晾干,得到FeC2O4·xH2O晶体。
已知:i.当pH>4时,Fe2+易被氧气氧化;
ii.几种物质的溶解度S(g/100gH2O)随温度T(C)变化的曲线如下图所示;
iii.氧化性:MnO
 >Fe3+>CO2。
>Fe3+>CO2。
(1)步骤一中试剂A的名称是
(2)步骤二中用稀硫酸调溶液pH至1~2的目的是抑制Fe2+与NH
 水解和
水解和(3)步骤三中操作B是
(4)步骤四中生成晶体的离子方程式为
II.测定草酸亚铁晶体(FeC2O4·xH2O)中的x值
(5)溶液配制:称取mg样品,用新煮沸并冷却的稀硫酸在
(6)取25.00mL溶液,用KMnO4酸性溶液滴定,当
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某小组在实验室制备NaClO溶液,并进行性质探究和成分测定。
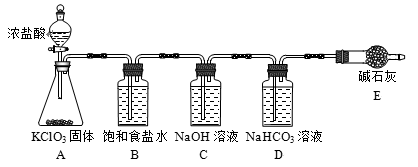
(1)该小组按上图装置进行实验,反应一段时间后,分别取B、C、D瓶的溶液进行实验,实验现象如下表。(已知饱和NaClO溶液pH为11)
①装置A中反应的化学方程式为________ 。
②B瓶溶液中H+的主要来源是________ 。
③C瓶溶液的溶质是________ (填化学式)。
④结合平衡移动原理解释D瓶溶液中石蕊立即褪色的原因________ 。
(2)测定C瓶溶液中NaClO含量(单位:g·L-1)的实验步骤如下:
Ⅰ.取C瓶溶液20mL于锥形瓶,加足量盐酸酸化,迅速加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol·L-1Na2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点时共用去20.00mLNa2S2O3溶液。(I2+2S2O =2I-+S4O62-)
=2I-+S4O62-)
①步骤Ⅰ总反应的离子方程式为_______ ,盖紧瓶塞并在暗处反应的原因是________ 。
②C瓶溶液中NaClO的含量为________ g·L-1。(保留1位小数。NaClO式量为74.5)

(1)该小组按上图装置进行实验,反应一段时间后,分别取B、C、D瓶的溶液进行实验,实验现象如下表。(已知饱和NaClO溶液pH为11)
| 实验步骤 | 实验现象 | ||
| B瓶 | C瓶 | D瓶 | |
| 实验1:取样,滴加紫色石蕊溶液 | 变红,不褪色 | 变蓝,不褪色 | 立即褪色 |
| 实验2:取样,测定溶液的pH | 3 | 12 | 7 |
②B瓶溶液中H+的主要来源是
③C瓶溶液的溶质是
④结合平衡移动原理解释D瓶溶液中石蕊立即褪色的原因
(2)测定C瓶溶液中NaClO含量(单位:g·L-1)的实验步骤如下:
Ⅰ.取C瓶溶液20mL于锥形瓶,加足量盐酸酸化,迅速加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000mol·L-1Na2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点时共用去20.00mLNa2S2O3溶液。(I2+2S2O
 =2I-+S4O62-)
=2I-+S4O62-)①步骤Ⅰ总反应的离子方程式为
②C瓶溶液中NaClO的含量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】一种用软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2)制取MnSO4·H2O并回收单质硫的工艺流程如下:
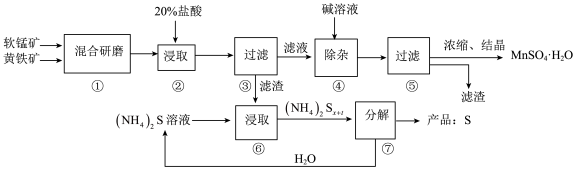
回答下列问题:
(1)步骤②浸取时若生成S、MnSO4及Fe2(SO4)3的化学方程式为_________ 。
(2)步骤③所得酸性滤液可能含有Fe2+,除去Fe2+可用的物质是________ ;步骤④需将溶液加热至沸然后在不断搅拌下加入碱调节pH4~5,再继续煮沸一段时间,“继续煮沸”的目的是_____ 。步骤⑤所得滤渣为_____ (填化学式)。
(3)步骤⑦需在90~100℃下进行,该反应的化学方程式为____________ 。
(4)测定产品MnSO4·H2O的方法之一是:准确称取ag产品于锥形瓶中,加入适量ZnO及H2O煮沸,然后用 c mol·L-1 KMnO4标准溶液滴定至浅红色且半分钟不褪,消耗标准溶液VmL,滴定反应的离子方程式为______ ,产品中Mn2+的质量分数为w(Mn2+)=_________ 。

回答下列问题:
(1)步骤②浸取时若生成S、MnSO4及Fe2(SO4)3的化学方程式为
(2)步骤③所得酸性滤液可能含有Fe2+,除去Fe2+可用的物质是
(3)步骤⑦需在90~100℃下进行,该反应的化学方程式为
(4)测定产品MnSO4·H2O的方法之一是:准确称取ag产品于锥形瓶中,加入适量ZnO及H2O煮沸,然后用 c mol·L-1 KMnO4标准溶液滴定至浅红色且半分钟不褪,消耗标准溶液VmL,滴定反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】回答下列问题:
(1)氯化铁是常见的水处理剂,工业上制备无水 的一种工艺如图:
的一种工艺如图:___________ (用离子方程式表示)。
②试写出吸收塔中吸收剂Q是 溶液,反应的离子方程式:
溶液,反应的离子方程式:___________ 。
③温度超过400度,捕集器中收集到的物质的相对分子质量为325,该物质的分子式为___________ 。
④ 的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容后取出10.00mL于锥形瓶中,加入稍过量的KI溶液,充分反应后,滴入淀粉指示剂,用
的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容后取出10.00mL于锥形瓶中,加入稍过量的KI溶液,充分反应后,滴入淀粉指示剂,用 溶液滴定,用去
溶液滴定,用去 溶液VmL。(已知:
溶液VmL。(已知: )滴定终点的现象是:
)滴定终点的现象是:___________ ,样品中氯化铁的质量分数为___________ (用字母m、c、V来表示)。
(2)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入 和
和 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。
,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。___________ 。
②电解NaCl溶液的总反应为___________ 。
(1)氯化铁是常见的水处理剂,工业上制备无水
 的一种工艺如图:
的一种工艺如图: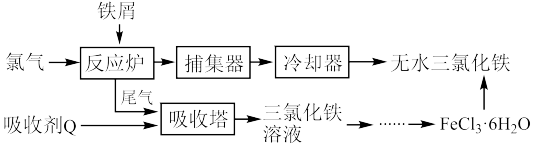
②试写出吸收塔中吸收剂Q是
 溶液,反应的离子方程式:
溶液,反应的离子方程式:③温度超过400度,捕集器中收集到的物质的相对分子质量为325,该物质的分子式为
④
 的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容后取出10.00mL于锥形瓶中,加入稍过量的KI溶液,充分反应后,滴入淀粉指示剂,用
的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容后取出10.00mL于锥形瓶中,加入稍过量的KI溶液,充分反应后,滴入淀粉指示剂,用 溶液滴定,用去
溶液滴定,用去 溶液VmL。(已知:
溶液VmL。(已知: )滴定终点的现象是:
)滴定终点的现象是:(2)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入
 和
和 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。
,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。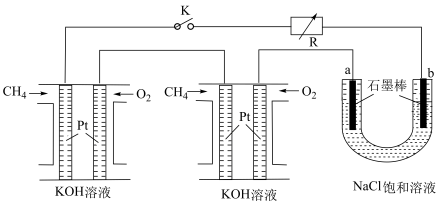
②电解NaCl溶液的总反应为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】(1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态水时放热55.6kJ热量,写出该反应的热化学方程式_________________________ 。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ·mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ·mol-1
则CO(g)+FeO(s)=Fe(s)+CO2(g)△H=_______
(3)酸碱中和滴定时双眼应注意观察_________________ (填“锥形瓶中颜色的变化”或“滴定管中液面变化”)
(4)在酸碱中和滴定过程中,不慎将数滴标准酸液滴在锥形瓶外,锥形瓶内待测碱溶液的浓度__________ (填“偏高”或“偏低”)
(5)泡沫灭火器的原理(NaHCO3与Al2(SO4)3)(写离子方程式_________________ 。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ·mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47.2kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ·mol-1
则CO(g)+FeO(s)=Fe(s)+CO2(g)△H=
(3)酸碱中和滴定时双眼应注意观察
(4)在酸碱中和滴定过程中,不慎将数滴标准酸液滴在锥形瓶外,锥形瓶内待测碱溶液的浓度
(5)泡沫灭火器的原理(NaHCO3与Al2(SO4)3)(写离子方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】镁是一种重要的金属材料。某化学兴趣小组探究镁与水的反应及影响因素。
(1)探究温度对镁与水反应速率的影响:取一小段镁条,用砂纸除去表面的氧化膜,放于试管中。向试管中加入2mL蒸馏水,并滴入2滴酚酞溶液。观察到镁条表面有少量气泡,反应缓慢。过一会加热试管至水沸腾,镁条表面产生大量气泡,溶液变红。
①写出镁与水反应的化学方程式___________ 。
②镁与沸水反应速率加快的原因是温度升高,反应速率加快以及___________ 。
(2)探究NH 和HCO
和HCO 对镁与水反应速率的影响
对镁与水反应速率的影响
取四根经打磨的相同镁条,分别插入四种盐溶液中进行对比实验,其结果如下。
①以上实验结果表明NH
___________ (填“促进”、“抑制”或“不影响”)镁与水的反应。
②能够说明HCO 对Mg与水反应起促进作用的证据是
对Mg与水反应起促进作用的证据是___________ 。
③b、d所得固体中还检验出碱式碳酸镁[用Mg2(OH)2CO3表示],写出生成该固体的离子方程式___________ 。
(1)探究温度对镁与水反应速率的影响:取一小段镁条,用砂纸除去表面的氧化膜,放于试管中。向试管中加入2mL蒸馏水,并滴入2滴酚酞溶液。观察到镁条表面有少量气泡,反应缓慢。过一会加热试管至水沸腾,镁条表面产生大量气泡,溶液变红。
①写出镁与水反应的化学方程式
②镁与沸水反应速率加快的原因是温度升高,反应速率加快以及
(2)探究NH
 和HCO
和HCO 对镁与水反应速率的影响
对镁与水反应速率的影响取四根经打磨的相同镁条,分别插入四种盐溶液中进行对比实验,其结果如下。
| 实验序号 | a | b | c | d |
| 浓度均为0.1mol·L-1盐溶液 | NH4NO3 | NaHCO3 | NaNO3 | NH4HCO3 |
| 溶液起始pH | 5.1 | 8.3 | 7.0 | 7.8 |
| 10min后产生气体体积(mL) | 1.5 | 0.7 | <0.1 | 1.4 |
| 气体主要成分 | H2 | |||
| 10min后镁条表面情况 | 大量固体附着(固体可溶于盐酸) | |||

②能够说明HCO
 对Mg与水反应起促进作用的证据是
对Mg与水反应起促进作用的证据是③b、d所得固体中还检验出碱式碳酸镁[用Mg2(OH)2CO3表示],写出生成该固体的离子方程式
您最近一年使用:0次
【推荐1】小苏打是一种常用的食品添加剂。
(1)精制食盐是制备小苏打的原料之一。粗盐中含有少量Ca2+、Mg2+、SO42-,粗盐精制的步骤顺序是:溶解→→→→(填字母编号)。_____________
a.加盐酸调pH b.加Ba(OH)2溶液c.加Na2CO3溶液d.过滤
(2)NH3、CO2先后通入饱和食盐水中,反应的离子方程式________________ 。
(3)侯氏制碱法中,母液的处理方法是通入氨气,再加入细小食盐颗粒,最后冷却析出的副产品是_______ ;简述通氨气的作用____________________________________ 。
(4)称取2.640 g小苏打样品(含少量NaCl),配置成250 mL溶液,准确取出20.00 mL溶液于锥形瓶中,滴加_______ 作指示剂,滴定时消耗0.1000 mol/L盐酸的体积为20.67 mL。则该样品中碳酸氢钠的质量分数为_________ (保留两位小数)。若装标准溶液的滴定管没有润洗,则测得的结果会____ (填“偏大”、“偏小”或“不变”)。
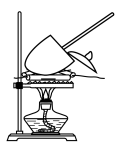
(5)测定上述样品中碳酸氢钠的质量分数还可通过如图装置进行测定。实验需使用的定量仪器是_____ ;写出涉及的化学方程式__________________ 。
(1)精制食盐是制备小苏打的原料之一。粗盐中含有少量Ca2+、Mg2+、SO42-,粗盐精制的步骤顺序是:溶解→→→→(填字母编号)。
a.加盐酸调pH b.加Ba(OH)2溶液c.加Na2CO3溶液d.过滤
(2)NH3、CO2先后通入饱和食盐水中,反应的离子方程式
(3)侯氏制碱法中,母液的处理方法是通入氨气,再加入细小食盐颗粒,最后冷却析出的副产品是
(4)称取2.640 g小苏打样品(含少量NaCl),配置成250 mL溶液,准确取出20.00 mL溶液于锥形瓶中,滴加
(5)测定上述样品中碳酸氢钠的质量分数还可通过如图装置进行测定。实验需使用的定量仪器是

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。
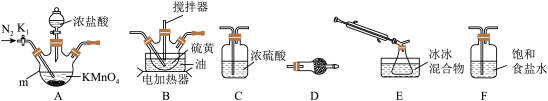
①仪器m的名称为___ ,装置F中试剂的作用是___ 。
②装置连接顺序:A→___ →E→D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是___ 。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和___ 。
(2)①S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式___ 。
②甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH 溶液,该方案___ (填“可行”或“不可行”),原因是___ 。
(3)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数,设计了如下实验方案:
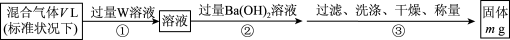
①W溶液可以是___ (填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中气体X的体积分数为____ (用含V、m的式子表示)。
| 物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
| 剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
| 化学性质 | ①300℃以上完全分解; ②S2Cl2+Cl2  2SCl2; 2SCl2;③遇高热或与明火接触,有引起燃烧的危险; ④受热或遇水分解放热,放出腐蚀性烟气; | ||||
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。

①仪器m的名称为
②装置连接顺序:A→
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是
④为了提高S2Cl2的纯度,实验的关键是控制好温度和
(2)①S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式
②甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH 溶液,该方案
(3)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数,设计了如下实验方案:
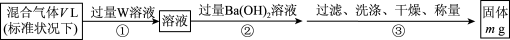
①W溶液可以是
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中气体X的体积分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】 可用作橡胶的低温硫化剂和粘结剂,向熔融的硫中通入限量氯气反应制得,进一步氯化可得SCl2。
可用作橡胶的低温硫化剂和粘结剂,向熔融的硫中通入限量氯气反应制得,进一步氯化可得SCl2。
 、
、 的某些性质如下:
的某些性质如下:
用如图所示装置制备 ,回答下列问题:
,回答下列问题:
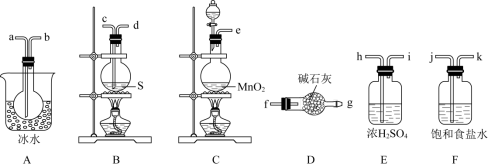
(1)制取 应选用的装置是
应选用的装置是___________ (填大写字母编号);反应的离子方程式为___________
(2)欲得到较纯净的 ,上述仪器装置的连接顺序为e→___________→___________→___________→___________→c→d→___________→___________→___________→g(按气流方向,用小写字母表示)。
,上述仪器装置的连接顺序为e→___________→___________→___________→___________→c→d→___________→___________→___________→g(按气流方向,用小写字母表示)。___________
(3)仪器D的名称是___________ ;D中碱石灰的作用是①___________ ;②___________
(4)为了获得更纯净的 ,需要对产品进行的操作是
,需要对产品进行的操作是___________ 。
(5)若将 放入水中,同时产生沉淀和气体,写出反应的化学方程式
放入水中,同时产生沉淀和气体,写出反应的化学方程式___________ ;该反应中被氧化和被还原的元素的物质的量之比为___________ 。
 可用作橡胶的低温硫化剂和粘结剂,向熔融的硫中通入限量氯气反应制得,进一步氯化可得SCl2。
可用作橡胶的低温硫化剂和粘结剂,向熔融的硫中通入限量氯气反应制得,进一步氯化可得SCl2。 、
、 的某些性质如下:
的某些性质如下:| 水溶性 | 密度(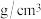 ) ) | 颜色 | 熔点 | 沸点 | |
 | 空气中发烟雾,遇水即水解 |  | 金黄色 |  | 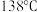 |
 | 溶于水且剧烈反应 |  | 樱桃红 |  | 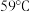 |
 ,回答下列问题:
,回答下列问题:
(1)制取
 应选用的装置是
应选用的装置是(2)欲得到较纯净的
 ,上述仪器装置的连接顺序为e→___________→___________→___________→___________→c→d→___________→___________→___________→g(按气流方向,用小写字母表示)。
,上述仪器装置的连接顺序为e→___________→___________→___________→___________→c→d→___________→___________→___________→g(按气流方向,用小写字母表示)。(3)仪器D的名称是
(4)为了获得更纯净的
 ,需要对产品进行的操作是
,需要对产品进行的操作是(5)若将
 放入水中,同时产生沉淀和气体,写出反应的化学方程式
放入水中,同时产生沉淀和气体,写出反应的化学方程式
您最近一年使用:0次



