电化学原理在电池制造、能量转换、物质合成等方面应用广泛。
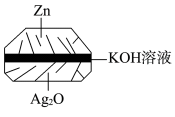
(1)微型纽扣银锌电池(如下图)在生活中有广泛应用,其电极分别是 和
和 ,电解质为
,电解质为 溶液,电极反应分别为:
溶液,电极反应分别为: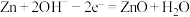 ;
;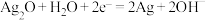 。
。 是电池的
是电池的___________ 极,电池的总反应方程式为___________ 。在使用过程中,电解质溶液的
___________ (填“增大”、“减小”或“不变”)。
(2)燃料电池必须从电池外部不断地向电池提供燃料。如甲烷 -空气燃料电池,工作原理如下图甲。ab均为惰性电极。a为
-空气燃料电池,工作原理如下图甲。ab均为惰性电极。a为___________ 极,正极的电极反应式为___________ 。当通入 (标准状况下)甲烷气体完全反应时,测得电路中转移
(标准状况下)甲烷气体完全反应时,测得电路中转移 电子,则甲烷的利用率为
电子,则甲烷的利用率为___________ 。
写出该装置负极的电极反应式___________ ,若此过程中转移了 电子,则理论上质子膜两侧电解液的质量变化差[
电子,则理论上质子膜两侧电解液的质量变化差[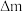 左
左 右]为
右]为___________  (忽略气体的溶解)。
(忽略气体的溶解)。
(1)微型纽扣银锌电池(如下图)在生活中有广泛应用,其电极分别是
 和
和 ,电解质为
,电解质为 溶液,电极反应分别为:
溶液,电极反应分别为: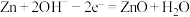 ;
;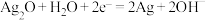 。
。
 是电池的
是电池的
(2)燃料电池必须从电池外部不断地向电池提供燃料。如甲烷
 -空气燃料电池,工作原理如下图甲。ab均为惰性电极。a为
-空气燃料电池,工作原理如下图甲。ab均为惰性电极。a为 (标准状况下)甲烷气体完全反应时,测得电路中转移
(标准状况下)甲烷气体完全反应时,测得电路中转移 电子,则甲烷的利用率为
电子,则甲烷的利用率为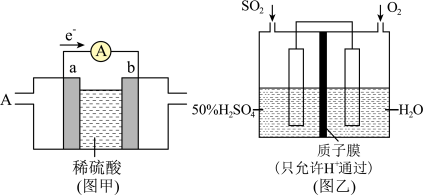
写出该装置负极的电极反应式
 电子,则理论上质子膜两侧电解液的质量变化差[
电子,则理论上质子膜两侧电解液的质量变化差[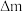 左
左 右]为
右]为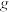 (忽略气体的溶解)。
(忽略气体的溶解)。
更新时间:2024-04-30 09:29:14
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
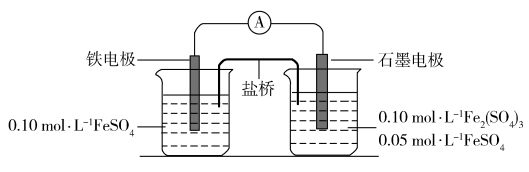
回答下列问题:
(1)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择___________ 作为电解质。
(2)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入_______ 电极溶液中,电池工作过程中左边电解质溶液质量增加,右边电解质溶液质量_______ 。(填“增大”“不变”或“减小”)
(3)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02mol·L−1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=______ 。
(4)根据(2)、(3)实验结果,可知石墨电极的电极反应式为___ ,铁电极的电极反应式为____ 。
(5)实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是_____ 。

回答下列问题:
(1)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择
| 阳离子 | u∞×108/(m2·s−1·V−1) | 阴离子 | u∞×108/(m2·s−1·V−1) |
| Li+ | 4.07 |  | 4.61 |
| Na+ | 5.19 |  | 7.40 |
| Ca2+ | 6.59 | Cl− | 7.91 |
| K+ | 7.62 |  | 8.27 |
(3)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02mol·L−1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=
(4)根据(2)、(3)实验结果,可知石墨电极的电极反应式为
(5)实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
根据上表中的实验现象完成下列问题:
(1)实验1、2中Al所作的电极是否相同,并说明原因?_______ 。
(2)指出铝和石墨的电极并写出实验3中的电极反应式和电池总反应方程式。铝为___ 极,2Al-6e-=2Al3+;石墨为___ 极,6H++6e-=3H2↑;电池总反应:____ 。
(3)实验4中的铝作正极还是负极?_______ ,为什么? _______ 。
(4)根据实验结果总结:在原电池中金属铝作正极还是负极受到哪些因素的影响?_____ 。
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | NaOH溶液 | 偏向Mg |
(1)实验1、2中Al所作的电极是否相同,并说明原因?
(2)指出铝和石墨的电极并写出实验3中的电极反应式和电池总反应方程式。铝为
(3)实验4中的铝作正极还是负极?
(4)根据实验结果总结:在原电池中金属铝作正极还是负极受到哪些因素的影响?
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】完成下列问题。
(1)银锌电池是一种常见的化学电源,其反应原理:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其工作原理如图所示。
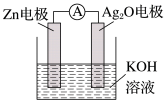
①在装置中Ag2O作______ (填“正”或“负”)极发生_____ (填“还原反应”或“氧化反应”),电极反应式为______ 。
②在装置中Zn作_____ (填“正”或“负”)极,发生____ (填“还原反应”或“氧化反应”),电极反应式为_____ 。
(2)将用导线相连的两个铂电极插入KOH溶液中,然后向两极分别通入CO和O2,则发生了原电池反应,该原电池中的负极反应式为________ ;正极反应式为________ 。
(1)银锌电池是一种常见的化学电源,其反应原理:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其工作原理如图所示。

①在装置中Ag2O作
②在装置中Zn作
(2)将用导线相连的两个铂电极插入KOH溶液中,然后向两极分别通入CO和O2,则发生了原电池反应,该原电池中的负极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】汽车尾气中含有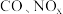 等有害气体。
等有害气体。
(1) 能形成酸雨,写出
能形成酸雨,写出 转化为
转化为 的化学方程式:
的化学方程式:______ .
(2)汽车尾气中 生成过程的能量变化示意图如下:
生成过程的能量变化示意图如下:____________ .
(3)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示: 电极上发生的是
电极上发生的是______ 反应(填“氧化”或“还原”)。
②外电路中,电子的流动方向是从______ 电极流出(填 或Pt);Pt电极上的电极反应式为
或Pt);Pt电极上的电极反应式为______ .
(4)一种新型催化剂能使 和
和 发生反应:
发生反应: 。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
①请将表中数据补充完整:A______ ;B______ .
②能验证温度对化学反应速率影响规律的实验是______ (填实验编号)。
③实验Ⅰ和实验Ⅱ中,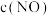 随时间
随时间 的变化曲线如图所示,其中表示实验Ⅱ的曲线是
的变化曲线如图所示,其中表示实验Ⅱ的曲线是______ (填“甲”或“乙”)。 。一定温度下,在容积不变的密闭容器中,下列可以说明该反应达到平衡状态的是
。一定温度下,在容积不变的密闭容器中,下列可以说明该反应达到平衡状态的是______ 。(从A-D项中选择)
A.容器内 的质量分数不再变化。
的质量分数不再变化。
B.相同时间内,消耗 同时生成
同时生成
C.容器内压强不再变化
D.容器内气体的平均密度不再发生变化
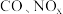 等有害气体。
等有害气体。(1)
 能形成酸雨,写出
能形成酸雨,写出 转化为
转化为 的化学方程式:
的化学方程式:(2)汽车尾气中
 生成过程的能量变化示意图如下:
生成过程的能量变化示意图如下:
(3)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:

 电极上发生的是
电极上发生的是②外电路中,电子的流动方向是从
 或Pt);Pt电极上的电极反应式为
或Pt);Pt电极上的电极反应式为(4)一种新型催化剂能使
 和
和 发生反应:
发生反应: 。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。| 实验编号 | 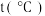 |  初始浓度 初始浓度 |  初始浓度 初始浓度 | 催化剂的比表面积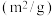 |
| Ⅰ | 280 | 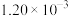 |  | 82 |
| Ⅱ | 280 | 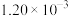 |  | 124 |
| Ⅲ | 350 |  |  | 82 |
②能验证温度对化学反应速率影响规律的实验是
③实验Ⅰ和实验Ⅱ中,
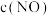 随时间
随时间 的变化曲线如图所示,其中表示实验Ⅱ的曲线是
的变化曲线如图所示,其中表示实验Ⅱ的曲线是
 。一定温度下,在容积不变的密闭容器中,下列可以说明该反应达到平衡状态的是
。一定温度下,在容积不变的密闭容器中,下列可以说明该反应达到平衡状态的是A.容器内
 的质量分数不再变化。
的质量分数不再变化。B.相同时间内,消耗
 同时生成
同时生成
C.容器内压强不再变化
D.容器内气体的平均密度不再发生变化
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】我国首创以铝组成的金属—海水—空气电池作为新型海水标志灯的能源,它以海水为电解质溶液,靠空气中的氧气使铝组成的金属不断氧化而产生电流。
(1)只要把灯放入海水中数分钟,就会发出耀眼的白光,则该电池的负极反应式为__________ ;
(2)电解法可制取碳的一种气态氢化物C2H4(如图所示)电极a接电源的__________ 极,该电极反应式为__________ ;
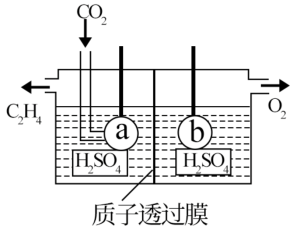
(3)将SO2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体NO,有关反应的离子方程式为__________ ;
(4)处理NOx的一种方法是利用甲烷催化还原NOx,
已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574kJ•mol-1;
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为__________ ;
(5)H2O2在工业、农业、医药上都有广泛的用途。用碱性氢氧燃料电池可合成H2O2,具有效率高、无污染等特点。电池总反应式为H2+O2+OH-=H2O+ ,写出正极反应式
,写出正极反应式__________ 。
(1)只要把灯放入海水中数分钟,就会发出耀眼的白光,则该电池的负极反应式为
(2)电解法可制取碳的一种气态氢化物C2H4(如图所示)电极a接电源的

(3)将SO2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体NO,有关反应的离子方程式为
(4)处理NOx的一种方法是利用甲烷催化还原NOx,
已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574kJ•mol-1;
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为
(5)H2O2在工业、农业、医药上都有广泛的用途。用碱性氢氧燃料电池可合成H2O2,具有效率高、无污染等特点。电池总反应式为H2+O2+OH-=H2O+
 ,写出正极反应式
,写出正极反应式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】任何化学反应都伴随着能量的变化,通过化学反应化学能可转化为热能、电能等不同形式的能量。
(1) 可用于工业合成氨气,已知常温常压下拆开
可用于工业合成氨气,已知常温常压下拆开 键、
键、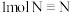 键分别需要吸收的能量为436kJ、946kJ,形成
键分别需要吸收的能量为436kJ、946kJ,形成 键会放出391kJ能量。
键会放出391kJ能量。
①根据上述数据判断工业合成氨的反应是___________ (填“吸热”或“放热”)反应。
②若消耗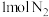 和
和 ,理论上放出或吸收热量为
,理论上放出或吸收热量为 ,则
,则 为
为___________ kJ。
(2)用图甲、乙所示装置进行实验,回答以下问题。
(3)某同学利用生活或实验室中常用的物品,设计了一个原电池,如图所示。 。
。
实验用品:电极(铁钉、铜钉)、稀硫酸、烧杯、导线、耳机(或电流表)。
①如果将装置中的耳机改为电流表,则铁钉应连接电流表的___________ 极,其电极反应式为___________ ;该电极上发生了___________ (填“氧化”或“还原”)反应。
②反应结束后,测得铁钉质量减轻了2.8克,则转移电子的物质的量为___________ 。
(1)
 可用于工业合成氨气,已知常温常压下拆开
可用于工业合成氨气,已知常温常压下拆开 键、
键、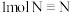 键分别需要吸收的能量为436kJ、946kJ,形成
键分别需要吸收的能量为436kJ、946kJ,形成 键会放出391kJ能量。
键会放出391kJ能量。①根据上述数据判断工业合成氨的反应是
②若消耗
 和
和 ,理论上放出或吸收热量为
,理论上放出或吸收热量为 ,则
,则 为
为(2)用图甲、乙所示装置进行实验,回答以下问题。
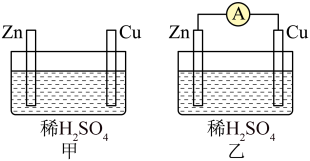
| A.甲中铜片是正极,乙中锌片是负极 |
| B.两烧杯中溶液的pH均增大 |
| C.两烧杯中铜片表面均有气泡产生 |
| D.若反应过程中有0.2mol电子转移,生成的氢气在标况下的体积均为2.24L |
(3)某同学利用生活或实验室中常用的物品,设计了一个原电池,如图所示。
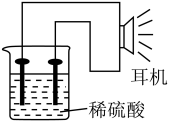
 。
。实验用品:电极(铁钉、铜钉)、稀硫酸、烧杯、导线、耳机(或电流表)。
①如果将装置中的耳机改为电流表,则铁钉应连接电流表的
②反应结束后,测得铁钉质量减轻了2.8克,则转移电子的物质的量为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】化学电源在生产生活中有着广泛的应用,电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。放电时总反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O
(1)写出放电时负极的电极反应式:______________________________ ;
(2)铅蓄电池放电时,溶液的pH将_________ (填“增大”、“减小”或“不变”)。当外电路上有0.5mol电子通过时,溶液中消耗H2SO4的物质的量为___________ 。
(3)放电完后,对该电池进行充电,在连接电源的负极一端生成________ 。(填“Pb”或“PbO2”)
(1)写出放电时负极的电极反应式:
(2)铅蓄电池放电时,溶液的pH将
(3)放电完后,对该电池进行充电,在连接电源的负极一端生成
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】人们应用原电池原理制作了多种电池,以满足不同的需要。以下各种电池广泛使用于日常生活.生产和科学技术等方面,请根据题中提供的信息填空:
(1)如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中央滴入浓CuSO4溶液,(实验过程中,不考虑铁丝反应及两球的浮力变化)一段时间后,当杠杆为绝缘体时,___ 端高;当杠杆为导体时,____ 端高(填“A”或“B”)。

(2)铁、铜、铝是生活中使用广泛的金属, 溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为
溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为______ ,若将此反应设计成原电池,则负极所用电极材料为____ ,正极反应式为_____ 。
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为_____ 。
A.铝片、铜片B.铜片、铝片C.铝片、铝片D.铜片、铜片
写出插入烧碱溶液中形成原电池的负极反应式:_______ 。
(4)某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl,当电路中转移amole-时,交换膜左侧溶液中约减少_______ mol离子。交换膜右侧溶液中c(HCl)_______ (填“>”“<”或“=”)1mol·L-1(忽略溶液体积变化)。
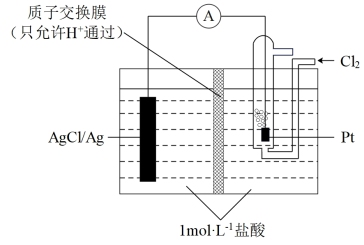
(1)如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中央滴入浓CuSO4溶液,(实验过程中,不考虑铁丝反应及两球的浮力变化)一段时间后,当杠杆为绝缘体时,

(2)铁、铜、铝是生活中使用广泛的金属,
 溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为
溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为
A.铝片、铜片B.铜片、铝片C.铝片、铝片D.铜片、铜片
写出插入烧碱溶液中形成原电池的负极反应式:
(4)某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl,当电路中转移amole-时,交换膜左侧溶液中约减少

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
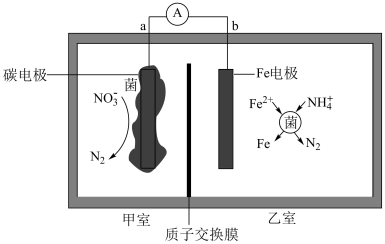
【推荐3】I.铁碳微电池法在弱酸性条件下处理含氮废水技术的研究获得突破性进展,其工作原理如图所示。___________
(2)工作时 透过质子交换膜的移动方向由
透过质子交换膜的移动方向由___________ (填“乙→甲”或“甲→乙”)
(3)碳电极上的电极反应式为___________
(4)处理含 的废水,若处理
的废水,若处理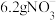 ,则有
,则有___________ 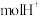 透过质子交换膜。
透过质子交换膜。
II.一种新型微生物电池可将有机废水中的 转化为
转化为 ,其工作原理如图所示(a、b极均为惰性电极)。
,其工作原理如图所示(a、b极均为惰性电极)。___________ (填“a到b”或“b到a”);a极反应式为___________
(6)已知该装置能实现海水的淡化,图中NaCl溶液就是在模拟海水。阴离子交换膜只允许阴离子通过,阳离子交换膜只允许阳离子通过,隔膜1和隔膜2一个是阴离子交换膜,一个为阳离子交换膜,则隔膜___________ 是阳离子交换膜(填“1”或“2”)。
(2)工作时
 透过质子交换膜的移动方向由
透过质子交换膜的移动方向由(3)碳电极上的电极反应式为
(4)处理含
 的废水,若处理
的废水,若处理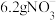 ,则有
,则有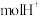 透过质子交换膜。
透过质子交换膜。II.一种新型微生物电池可将有机废水中的
 转化为
转化为 ,其工作原理如图所示(a、b极均为惰性电极)。
,其工作原理如图所示(a、b极均为惰性电极)。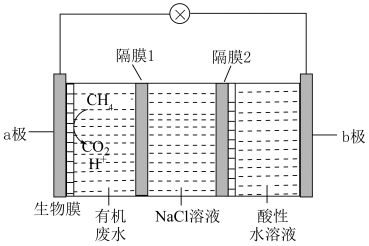
(6)已知该装置能实现海水的淡化,图中NaCl溶液就是在模拟海水。阴离子交换膜只允许阴离子通过,阳离子交换膜只允许阳离子通过,隔膜1和隔膜2一个是阴离子交换膜,一个为阳离子交换膜,则隔膜
您最近一年使用:0次



