化学反应中常伴随着能量变化。
I.将Al条打磨后,插入6 mol/L盐酸中。
(1)如果Al条不打磨,开始一段时间没有气泡冒出,用离子方程式说明其原因___________ 。
(2)该反应的能量变化可用下图中的___________ 表示(填序号)。___________ 。t2~t3速率变化的主要原因是___________ 。
(4)铝与某些金属氧化物在高热条件下发生的反应,同时放出巨大的热,铁路工人经常用铝热剂焊接铁轨,写出化学方程式___________ 。
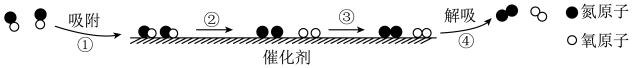
Ⅱ. 利用固体表面催化工艺进行NO分解的过程如下图所示。___________ 键断裂,此过程___________ (放出或者吸收)能量。
I.将Al条打磨后,插入6 mol/L盐酸中。
(1)如果Al条不打磨,开始一段时间没有气泡冒出,用离子方程式说明其原因
(2)该反应的能量变化可用下图中的


(4)铝与某些金属氧化物在高热条件下发生的反应,同时放出巨大的热,铁路工人经常用铝热剂焊接铁轨,写出化学方程式
Ⅱ. 利用固体表面催化工艺进行NO分解的过程如下图所示。
更新时间:2024-05-11 13:34:52
|
相似题推荐
填空题
|
较易
(0.85)
解题方法
【推荐1】能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率,请回答下列问题。
(1)某实验小组同学进行如下实验,以检验化学反应中的能量变化,实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是_______ 热反应,Ba(OH)2·8H2O与NH4Cl的反应是_______ 热反应。反应过程_______ (填“①”或“②”)的能量变化可用图2表示。
(2)已知:断裂1molH-H、1molO=O,1molH-O键吸收的能量依次为436kJ、498kJ、467kJ。在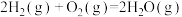 反应中,44.8L
反应中,44.8L (标准状况)完全反应放出的能量为
(标准状况)完全反应放出的能量为_______ 。

(1)某实验小组同学进行如下实验,以检验化学反应中的能量变化,实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是
(2)已知:断裂1molH-H、1molO=O,1molH-O键吸收的能量依次为436kJ、498kJ、467kJ。在
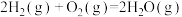 反应中,44.8L
反应中,44.8L (标准状况)完全反应放出的能量为
(标准状况)完全反应放出的能量为
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】某氮肥厂氨氮废水中的氮元素多以NH 和NH3·H2O的形式存在,该废水的处理流程如下:
和NH3·H2O的形式存在,该废水的处理流程如下:
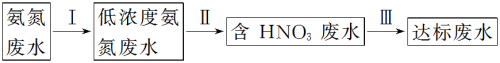
(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,再通空气将氨赶出并回收。用离子方程式表示加NaOH溶液的作用:___________ 。
(2)过程Ⅱ:在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
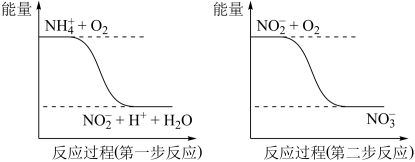
①第一步反应是___________ 反应(选题“放热”或“吸热”),判断理由是___________ 。
②NH 全部氧化成NO
全部氧化成NO 的离子方程式是
的离子方程式是___________ 。
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2.若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是___________ 。
 和NH3·H2O的形式存在,该废水的处理流程如下:
和NH3·H2O的形式存在,该废水的处理流程如下:
(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30℃,再通空气将氨赶出并回收。用离子方程式表示加NaOH溶液的作用:
(2)过程Ⅱ:在微生物作用的条件下,NH
 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
①第一步反应是
②NH
 全部氧化成NO
全部氧化成NO 的离子方程式是
的离子方程式是(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2.若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐3】(1)能源是现代社会发展的支柱之一、化学反应中的能量变化,通常主要表现为热量的变化。下列反应中,属于放热反应的是___________ (填序号)。
a.Ba(OH)2·8H2O与NH4Cl混合搅拌
b.高温煅烧石灰石
c.铝与盐酸反应
(2)某同学进行如图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化。实验表明:反应温度升高,由此判断该反应是___________ 。(填“吸热”或“放热”)反应,其离子方程式为 ___________ 。

(3)如图是锌锰干电池的构造示意图,其负极电极反应式为___________
 。
。
(4)燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:

①氢氧燃料电池的a电极为___________ 极(填“正”或“负”);
②氢氧燃料电池的负极反应式:___________ ;
③氢氧燃料电池的总反应化学方程式是:___________ 。
a.Ba(OH)2·8H2O与NH4Cl混合搅拌
b.高温煅烧石灰石
c.铝与盐酸反应
(2)某同学进行如图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化。实验表明:反应温度升高,由此判断该反应是

(3)如图是锌锰干电池的构造示意图,其负极电极反应式为
 。
。(4)燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:

①氢氧燃料电池的a电极为
②氢氧燃料电池的负极反应式:
③氢氧燃料电池的总反应化学方程式是:
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】请参考题中图表,已知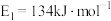 、
、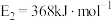 ,根据要求回答问题。
,根据要求回答问题。
(1)下图是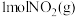 和
和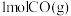 反应生成
反应生成 和
和 的过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,
的过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,
_______ (填“增大”“减小”或“不变”,下同), 的变化是
的变化是_______ 。请写出 和
和 反应的热化学方程式:
反应的热化学方程式:_______ 。
(2)下表是部分化学键的键能数据:
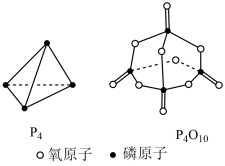
已知 白磷
白磷 完全燃烧放热
完全燃烧放热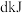 ,白磷及其完全燃烧的生成物结构如图所示,则上表中
,白磷及其完全燃烧的生成物结构如图所示,则上表中
_______ (用含有a、b、c、d的代数式表示)。
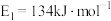 、
、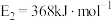 ,根据要求回答问题。
,根据要求回答问题。(1)下图是
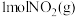 和
和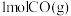 反应生成
反应生成 和
和 的过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,
的过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,
 的变化是
的变化是 和
和 反应的热化学方程式:
反应的热化学方程式:
(2)下表是部分化学键的键能数据:
| 化学键 |  |  |  | 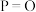 |
键能/( ) ) | a | b | c | x |
 白磷
白磷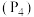 完全燃烧放热
完全燃烧放热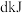 ,白磷及其完全燃烧的生成物结构如图所示,则上表中
,白磷及其完全燃烧的生成物结构如图所示,则上表中

您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
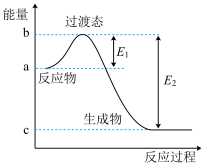
【推荐2】在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子。使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ·mol-1表示。请认真观察下图,然后回答问题。

(1)图中反应是________ (填“吸热”或“放热”)反应,该反应的ΔH=________ (用含E1、E2的代数式表示)。
(2)已知:H2(g)+ O2(g)===H2O(g)ΔH=-241.8kJ·mol-1,该反应的活化能为167.2kJ·mol-1,则其逆反应的活化能为
O2(g)===H2O(g)ΔH=-241.8kJ·mol-1,该反应的活化能为167.2kJ·mol-1,则其逆反应的活化能为________________ 。
(3)对于同一反应,图中虚线(II)与实线(I)相比,活化能________ (填“升高”“降低”或“不变”),对反应热是否有影响?________ ,原因是____________________________________________

(1)图中反应是
(2)已知:H2(g)+
 O2(g)===H2O(g)ΔH=-241.8kJ·mol-1,该反应的活化能为167.2kJ·mol-1,则其逆反应的活化能为
O2(g)===H2O(g)ΔH=-241.8kJ·mol-1,该反应的活化能为167.2kJ·mol-1,则其逆反应的活化能为(3)对于同一反应,图中虚线(II)与实线(I)相比,活化能
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐3】I.某探究性学习小组利用 溶液和酸性
溶液和酸性 溶液之间的反应来探究外界条件改变对化学反应速率的影响,实验如下。
溶液之间的反应来探究外界条件改变对化学反应速率的影响,实验如下。
(1)通过实验A、B可探究_______ (填外部因素)的改变对反应速率的影响,其中 =
=_______ ;通过实验_______ 可探究温度变化对化学反应速率的影响。
(2)若 ,则由此实验可以得出的结论是
,则由此实验可以得出的结论是_______ ;利用实验B中数据计算,用 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为_______ 。
Ⅱ.在2L密闭容器中进行反应: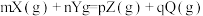 ,式中m、n、p、q为化学计量数。在0~3min内,各物质物质的量的变化如下表所示:
,式中m、n、p、q为化学计量数。在0~3min内,各物质物质的量的变化如下表所示:
已知 内
内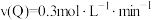 ,
, 。
。
(3)试确定以下物质的量:起始时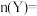
_______ ,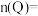
_______ 。
(4)化学方程式中m=_______ ,n=_______ ,p=_______ ,q=_______ 。
 溶液和酸性
溶液和酸性 溶液之间的反应来探究外界条件改变对化学反应速率的影响,实验如下。
溶液之间的反应来探究外界条件改变对化学反应速率的影响,实验如下。| 实验序号 | 实验温度/K |  溶液(含硫酸) 溶液(含硫酸) |  溶液 溶液 |  | 溶液颜色褪至无色时 所需时间/s | ||
| V/mL | 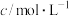 | V/mL | 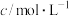 | V/mL | |||
| A | 293 | 2 | 0.02 | 5 | 0.1 | 5 |  |
| B |  | 2 | 0.02 | 4 | 0.1 |  | 8 |
| C | 313 | 2 | 0.02 |  | 0.1 | 6 |  |
(1)通过实验A、B可探究
 =
=(2)若
 ,则由此实验可以得出的结论是
,则由此实验可以得出的结论是 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为Ⅱ.在2L密闭容器中进行反应:
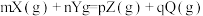 ,式中m、n、p、q为化学计量数。在0~3min内,各物质物质的量的变化如下表所示:
,式中m、n、p、q为化学计量数。在0~3min内,各物质物质的量的变化如下表所示:| X | Y | Z | Q | |
| 起始/mol | 1.2 | 0 | ||
| 2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末/mol | 0.8 |
已知
 内
内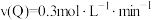 ,
, 。
。(3)试确定以下物质的量:起始时
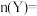
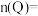
(4)化学方程式中m=
您最近一年使用:0次



