次氯酸盐是常用的水处理剂。有效氯含量(COAC)指与含氯消毒剂氧化能力相当的氯气量,单位为 mol/L;物质氧化性越强,氧化还原电位(ORP)越高;相同条件下,次氯酸的氧化性大于次氯酸盐。温度及pH对Ca(ClO)2溶液有效氯含量(COAC)及氧化还原电位的影响。
(1)在不同温度下,用0.2 mol/L乙酸溶液调节pH得到Ca(ClO)2溶液COAC、ORP的关系如图1室温(25 ℃)、图2(70 ℃)所示。___________ (填“增大”或“减小”)。
②Ca(ClO)2溶液用于消毒时适宜的条件:温度为___________ (填字母,下同)、pH为___________ 。
A. 25 ℃ B. 70 ℃ C. 5.75 D. 6.85
(2)某小组探究70 ℃时,pH及稳定剂对NaClO溶液有效氯含量的影响。甲同学设计实验方案如下:
①设计实验1和2的目的是___________ 。
②实验5中的a___________ 0.935(填“大于”“小于”或“等于”)。
③根据实验3~5,可得出的结论是___________ 。
④下列物质中最适宜作为NaClO溶液稳定剂的是___________ (填字母)。
A. MgCl2 B. NaCl C. Na2S D. CH3COONa
资料:ⅰ.Mn2+在一定条件下被ClO-氧化成MnO2(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。
ⅱ.浓碱条件下, 可被OH-还原为
可被OH-还原为 。
。
ⅲ.NaClO的氧化性随碱性增强而减弱。
实验记录如下:
(3)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因。
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将 氧化为
氧化为 。
。
①离子方程式表示可能导致溶液碱性减弱的原因:_______________ ,但通过实验测定溶液的碱性变化很小。
②取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40% NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为___________ ,溶液绿色缓慢加深,原因是MnO2被___________ (填化学式)氧化,可证明Ⅲ的悬浊液中氧化剂过量。
③从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:___________ 。
(1)在不同温度下,用0.2 mol/L乙酸溶液调节pH得到Ca(ClO)2溶液COAC、ORP的关系如图1室温(25 ℃)、图2(70 ℃)所示。
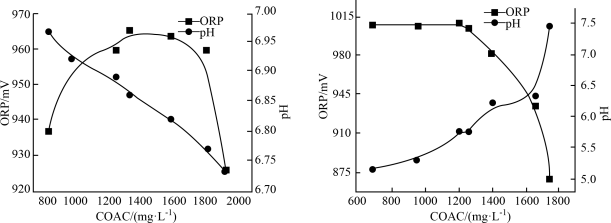
图1 图2
①由图1可知,随着少量乙酸的滴入,Ca(ClO)2溶液的pH在②Ca(ClO)2溶液用于消毒时适宜的条件:温度为
A. 25 ℃ B. 70 ℃ C. 5.75 D. 6.85
(2)某小组探究70 ℃时,pH及稳定剂对NaClO溶液有效氯含量的影响。甲同学设计实验方案如下:
| 序号 | 硅酸钠的质量分数 | 碳酸钠的质量分数 | 初始COAC | pH | 12 h后COAC | 12 h后COAC/初始COAC |
| 1 | 0 | 0 | 1 794 | 8.53 | 1 218 | 0.679 |
| 2 | 0 | 0 | 1 794 | 8.63 | 1 288 | 0.718 |
| 3 | 0.9% | 0.6% | 1 794 | 13.44 | 1 676 | 0.935 |
| 4 | 1.5% | 0 | 1 834 | 13.76 | 1 597 | 0.871 |
| 5 | 0 | 1.5% | 1 834 | 13.66 | - | a |
②实验5中的a
③根据实验3~5,可得出的结论是
④下列物质中最适宜作为NaClO溶液稳定剂的是
A. MgCl2 B. NaCl C. Na2S D. CH3COONa
资料:ⅰ.Mn2+在一定条件下被ClO-氧化成MnO2(棕黑色)、
 (绿色)、
(绿色)、 (紫色)。
(紫色)。ⅱ.浓碱条件下,
 可被OH-还原为
可被OH-还原为 。
。ⅲ.NaClO的氧化性随碱性增强而减弱。
实验记录如下:
| 序号 | Cl2的吸收液 | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 10mL水+5滴0.1mol/L MnSO4溶液 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 10mL5% NaOH溶液+5滴0.1mol/L MnSO4溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 10mL40% NaOH溶液+5滴0.1mol/L MnSO4溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(3)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因。
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将
 氧化为
氧化为 。
。①离子方程式表示可能导致溶液碱性减弱的原因:
②取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40% NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
更新时间:2024-05-27 21:45:35
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】砷化镓是一种半导体化合物,可用于太阳能电池。一种砷化镓废料(主要成分为GaAs,含 、
、 、
、 等杂质)中回收单质镓和砷的化合物的工艺流程如图所示。
等杂质)中回收单质镓和砷的化合物的工艺流程如图所示。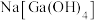 的形式进入溶液。
的形式进入溶液。
②离子完全沉淀时的pH: 为8,
为8, 为5.6。
为5.6。
(1)第一电离能比较:As________ Ga(填“<”“>”或“=”,下同),原子半径比较:As________ Ga。
(2)下图为砷化镓晶胞,白球所代表原子的配位数是________ 。已知:晶胞参数为apm,密度为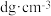 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为________ (用含a、d的式子表示)。________ 。
(4)“调pH①”时,pH=________ 最合适;滤液②的溶质成分为________ (写化学式)。
(5)写出用惰性电极电解制备镓单质的电极反应方程式:________ 。
 、
、 、
、 等杂质)中回收单质镓和砷的化合物的工艺流程如图所示。
等杂质)中回收单质镓和砷的化合物的工艺流程如图所示。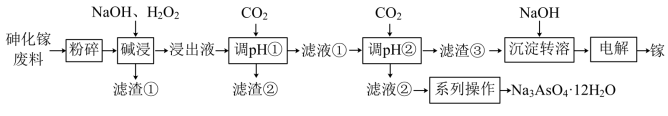
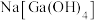 的形式进入溶液。
的形式进入溶液。②离子完全沉淀时的pH:
 为8,
为8, 为5.6。
为5.6。(1)第一电离能比较:As
(2)下图为砷化镓晶胞,白球所代表原子的配位数是
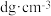 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为
(4)“调pH①”时,pH=
(5)写出用惰性电极电解制备镓单质的电极反应方程式:
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】贵重金属的回收利用是当今科学研究的重要课题。图1是实验室模拟工业浸取电路板中金的过程,图2为浸取原理。

回答下列问题:
(1)打开 ,关闭
,关闭 ,向A中烧瓶加水,制取
,向A中烧瓶加水,制取 。安全漏斗的作用除加水外,还有
。安全漏斗的作用除加水外,还有_______ ,湿棉花的作用_______ 。
(2)三颈瓶中蓝色沉淀消失后,关闭 ,打开
,打开 ,滴入
,滴入 溶液。为使分液漏斗内的
溶液。为使分液漏斗内的 溶液顺利滴下,可将分液漏斗上部的玻璃塞打开或
溶液顺利滴下,可将分液漏斗上部的玻璃塞打开或_______ 。根据图2原理可知, 在浸金过程中起
在浸金过程中起_______ 作用。三颈瓶中 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(3)为了验证图2原理中 的作用,进行如下实验:关闭
的作用,进行如下实验:关闭 ,反应一段时间后,温度无明显变化,U形管内液柱左高右低,三颈瓶中溶液蓝色变浅。然后
,反应一段时间后,温度无明显变化,U形管内液柱左高右低,三颈瓶中溶液蓝色变浅。然后_______ (填操作和现象),对应反应的离子方程式是_______ ,此现象证实了上述原理中 的作用。
的作用。

回答下列问题:
(1)打开
 ,关闭
,关闭 ,向A中烧瓶加水,制取
,向A中烧瓶加水,制取 。安全漏斗的作用除加水外,还有
。安全漏斗的作用除加水外,还有(2)三颈瓶中蓝色沉淀消失后,关闭
 ,打开
,打开 ,滴入
,滴入 溶液。为使分液漏斗内的
溶液。为使分液漏斗内的 溶液顺利滴下,可将分液漏斗上部的玻璃塞打开或
溶液顺利滴下,可将分液漏斗上部的玻璃塞打开或 在浸金过程中起
在浸金过程中起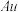 发生反应的离子方程式为
发生反应的离子方程式为(3)为了验证图2原理中
 的作用,进行如下实验:关闭
的作用,进行如下实验:关闭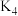 ,反应一段时间后,温度无明显变化,U形管内液柱左高右低,三颈瓶中溶液蓝色变浅。然后
,反应一段时间后,温度无明显变化,U形管内液柱左高右低,三颈瓶中溶液蓝色变浅。然后 的作用。
的作用。
您最近一年使用:0次
【推荐3】硫酸铝是一种具有广泛用途的重要化工产品,以高岭土(含 、
、 、少量
、少量 等)为原料制备硫酸铝晶体[
等)为原料制备硫酸铝晶体[ ]的实验流程如图所示。
]的实验流程如图所示。
(1)为加快酸溶速率,可采取的措施_______ (写出一条,合理即可)。
(2)滤渣1经过处理可作为制备水玻璃( 水溶液)的原料,写出滤渣1与烧碱溶液反应的离子方程式
水溶液)的原料,写出滤渣1与烧碱溶液反应的离子方程式_______ 。
(3)加入试剂除铁前,滤液1中的阳离子除了 、
、 外还有的阳离子是
外还有的阳离子是_______ (填离子符号)。滤渣2主要成分为 ,由于条件控制不当,常使
,由于条件控制不当,常使 中混有
中混有 影响其回收利用,用离子方程式表示除去
影响其回收利用,用离子方程式表示除去 的原理
的原理_______ 。
(4)向滤液1中加入的试剂可以是 ,试结合平衡移动原理说明其原因
,试结合平衡移动原理说明其原因_______ 。
(5)已知常温时:Ksp[Fe(OH)3] =1×10-37.4、Kw=1×10-14;当溶液中Fe3+浓度低于10-5mol/L时即认为Fe3+沉淀完全,实验中为确保Fe3+完全沉淀需控制PH不低于_______ (保留小数点一位)。
(6)某兴趣小组为了测定晶体中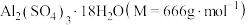 的质量分数,进行如下实验:
的质量分数,进行如下实验:
①准确称取1.00g晶体样品,溶于一定量水中;
②滴入 EDTA溶液,与
EDTA溶液,与 反应所消耗EDTA溶液的体积25.00mL。(已知:EDTA与
反应所消耗EDTA溶液的体积25.00mL。(已知:EDTA与 以物质的量之比1:1反应,假设杂质不与EDTA反应)。
以物质的量之比1:1反应,假设杂质不与EDTA反应)。
则晶体中 的质量分数是
的质量分数是_______ 。
 、
、 、少量
、少量 等)为原料制备硫酸铝晶体[
等)为原料制备硫酸铝晶体[ ]的实验流程如图所示。
]的实验流程如图所示。
(1)为加快酸溶速率,可采取的措施
(2)滤渣1经过处理可作为制备水玻璃(
 水溶液)的原料,写出滤渣1与烧碱溶液反应的离子方程式
水溶液)的原料,写出滤渣1与烧碱溶液反应的离子方程式(3)加入试剂除铁前,滤液1中的阳离子除了
 、
、 外还有的阳离子是
外还有的阳离子是 ,由于条件控制不当,常使
,由于条件控制不当,常使 中混有
中混有 影响其回收利用,用离子方程式表示除去
影响其回收利用,用离子方程式表示除去 的原理
的原理(4)向滤液1中加入的试剂可以是
 ,试结合平衡移动原理说明其原因
,试结合平衡移动原理说明其原因(5)已知常温时:Ksp[Fe(OH)3] =1×10-37.4、Kw=1×10-14;当溶液中Fe3+浓度低于10-5mol/L时即认为Fe3+沉淀完全,实验中为确保Fe3+完全沉淀需控制PH不低于
(6)某兴趣小组为了测定晶体中
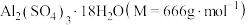 的质量分数,进行如下实验:
的质量分数,进行如下实验:①准确称取1.00g晶体样品,溶于一定量水中;
②滴入
 EDTA溶液,与
EDTA溶液,与 反应所消耗EDTA溶液的体积25.00mL。(已知:EDTA与
反应所消耗EDTA溶液的体积25.00mL。(已知:EDTA与 以物质的量之比1:1反应,假设杂质不与EDTA反应)。
以物质的量之比1:1反应,假设杂质不与EDTA反应)。则晶体中
 的质量分数是
的质量分数是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐1】一种从废铅膏(含PbSO453.2%,PbO229.5%,PbO11.3%,其他6%)中回收铅和氧化铅的流程如下: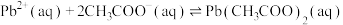
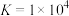 ,
,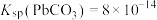 。
。
请回答:
(1)已知Pb位于第六周期,与C同族,基态Pb原子的价层电子轨道表示式为____________ 。
(2)“还原”时PbO2会转化为PbSO4,发生反应的化学方程式为___________ 。
(3)将滤液与SO2、Ca(OH)2混合反应,可实现原料NaHSO3的再生。理论上SO2与Ca(OH)2的物质的量之比为___________ ,此过程中会产生一种副产物,其化学式为_____________ 。
(4)“脱硫”时发生的主要反应的离子方程式为___________ 。
(5)“沉淀”时,发生反应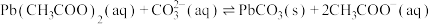 ,该反应的平衡常数
,该反应的平衡常数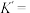
____________ 。
(6)“电解”时,阴极的电极反应式为_______________ 。
(7)“灼烧”时会有中间产物xPbCO3·yPbO生成,固体残留率 与温度的关系如图所示,则358℃时对应固体的成分为
与温度的关系如图所示,则358℃时对应固体的成分为______________ (填化学式)。
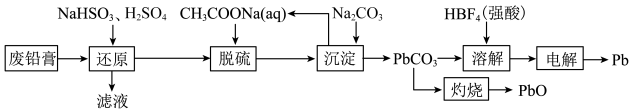
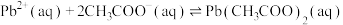
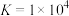 ,
,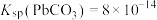 。
。请回答:
(1)已知Pb位于第六周期,与C同族,基态Pb原子的价层电子轨道表示式为
(2)“还原”时PbO2会转化为PbSO4,发生反应的化学方程式为
(3)将滤液与SO2、Ca(OH)2混合反应,可实现原料NaHSO3的再生。理论上SO2与Ca(OH)2的物质的量之比为
(4)“脱硫”时发生的主要反应的离子方程式为
(5)“沉淀”时,发生反应
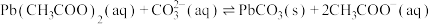 ,该反应的平衡常数
,该反应的平衡常数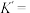
(6)“电解”时,阴极的电极反应式为
(7)“灼烧”时会有中间产物xPbCO3·yPbO生成,固体残留率
 与温度的关系如图所示,则358℃时对应固体的成分为
与温度的关系如图所示,则358℃时对应固体的成分为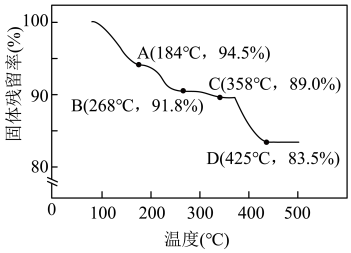
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐2】A、B、C、D、E、F为常见的原子序数依次增大的短周期元素,B、C、D、E、F的简单离子的电子层结构相同,A和E同主族,且原子的最外层电子数的关系为A+D=B+F=8。请回答:
(1)试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式_______ 。
(2)含F的阳离子溶液中加过量E的最高价氧化物对应水化物的溶液,其离子方程式是_______ 。
(3)已知B2A4与BA3具有相似的性质,B2A4通过炽热的氧化铜粉末,粉末由黑色变为红色,且产物对大气无污染,其化学反应方程式是_______ 。
(4)已知某化合物EB3与水可以反应生成两种气体单质和一种碱,试写出其化学方程式_______ ;若0.1mol该化合物完全反应,转移电子的物质的量为_______ 。
(1)试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式
(2)含F的阳离子溶液中加过量E的最高价氧化物对应水化物的溶液,其离子方程式是
(3)已知B2A4与BA3具有相似的性质,B2A4通过炽热的氧化铜粉末,粉末由黑色变为红色,且产物对大气无污染,其化学反应方程式是
(4)已知某化合物EB3与水可以反应生成两种气体单质和一种碱,试写出其化学方程式
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】钛在医疗领域、航空航天材料方面的使用非常广泛。TiCl4是制备纳米级TiO2的重要中间体。某小组利用如图所示装置在实验室制备并收集TiCl4,并用TiCl4制备纳米TiO2(夹持装置略去)。

【实验一】制备无水TiCl4
已知:
①TiCl4高温时能与O2反应,遇水极易水解;
②瓷舟中物质反应后除生成TiCl4、FeCl3外,同时还生成一种有毒氧化物气体和少量副产物CCl4;
③相关物质的部分物理性质如表:
(1)瑞典化学家舍勒将软锰矿与浓盐酸混合制备Cl2的离子方程式为_____ 。
(2)实验过程中需要先后通入N2两次,第一次通入N2作用是_____ 。设置装置单元X的作用为_____ 。
(3)控温箱的温度在150~200℃,目的是_____ 。欲分离上述锥形瓶中的液态混合物,所采用操作的名称是_____ 。
(4)将管式炉加热至900℃时,瓷舟中主要发生的化学反应方程式为_____ 。
【实验二】用TiCl4制备纳米TiO2
(5)可由TiCl4直接水解产生TiO2•xH2O,再经焙烧得TiO2。请写出TiCl4直接水解产生TiO2•xH2O的化学方程式:_____ 。
(6)也可以N2为载体,用TiCl4和水蒸气反应生成Ti(OH)4,再控制温度生成纳米xTiO2•yH2O。实验室可用电位滴定法测定纳米xTiO2•yH2O组成,方法如下:
步骤一:取样品纳米xTiO2•yH2O3.47g用稀硫酸充分溶解得到TiOSO4,再用足量单质Al将TiO2+还原为Ti3+,过滤并洗涤,将所得滤液和洗涤液合并注入500mL容量瓶,定容得到待测液。
步骤二:取待测液50.00mL于烧杯中,用如图所示装置进行电位滴定,在待测溶液中插入一个指示电极(电极A)和一个参比电极(电极B)组成一个工作电池。用NH4Fe(SO4)2标准溶液滴定,将Ti3+氧化为TiO2+时,溶液中Ti3+浓度不断变化,指示电极的电位发生相应变化,根据测量工作电池电动势的变化就可确定滴定终点。

①用E表示指示电极的电位,V表示标准溶液体积,△E表示指示电极的电位改变量,△V表示标准溶液体积增量,以下所示滴定终点附近的图像正确的是_____ (填序号)。
A. B.
B.
C. D.
D.
②用0.1000mol•L-1的NH4Fe(SO4)2标准溶液滴定时,三次滴定消耗标准溶液的平均值为40.00mL。通过分析、计算,该样品的组成为_____ 。

【实验一】制备无水TiCl4
已知:
①TiCl4高温时能与O2反应,遇水极易水解;
②瓷舟中物质反应后除生成TiCl4、FeCl3外,同时还生成一种有毒氧化物气体和少量副产物CCl4;
③相关物质的部分物理性质如表:
| 熔点/℃ | 沸点/℃ | 水溶性 | |
| TiCl4 | -23.2 | 136.4 | 极易水解生成白色沉淀,能溶于CCl4等有机溶剂 |
| FeCl3 | 306 | 315 | 易水解生成红褐色沉淀 |
| CCl4 | -23 | 76.8 | 难溶于水 |
(2)实验过程中需要先后通入N2两次,第一次通入N2作用是
(3)控温箱的温度在150~200℃,目的是
(4)将管式炉加热至900℃时,瓷舟中主要发生的化学反应方程式为
【实验二】用TiCl4制备纳米TiO2
(5)可由TiCl4直接水解产生TiO2•xH2O,再经焙烧得TiO2。请写出TiCl4直接水解产生TiO2•xH2O的化学方程式:
(6)也可以N2为载体,用TiCl4和水蒸气反应生成Ti(OH)4,再控制温度生成纳米xTiO2•yH2O。实验室可用电位滴定法测定纳米xTiO2•yH2O组成,方法如下:
步骤一:取样品纳米xTiO2•yH2O3.47g用稀硫酸充分溶解得到TiOSO4,再用足量单质Al将TiO2+还原为Ti3+,过滤并洗涤,将所得滤液和洗涤液合并注入500mL容量瓶,定容得到待测液。
步骤二:取待测液50.00mL于烧杯中,用如图所示装置进行电位滴定,在待测溶液中插入一个指示电极(电极A)和一个参比电极(电极B)组成一个工作电池。用NH4Fe(SO4)2标准溶液滴定,将Ti3+氧化为TiO2+时,溶液中Ti3+浓度不断变化,指示电极的电位发生相应变化,根据测量工作电池电动势的变化就可确定滴定终点。

①用E表示指示电极的电位,V表示标准溶液体积,△E表示指示电极的电位改变量,△V表示标准溶液体积增量,以下所示滴定终点附近的图像正确的是
A.
 B.
B.
C.
 D.
D.
②用0.1000mol•L-1的NH4Fe(SO4)2标准溶液滴定时,三次滴定消耗标准溶液的平均值为40.00mL。通过分析、计算,该样品的组成为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】物质的类别和核心元素的化合价是研究物质性质的两个重要角度。“价类二维图”是研究物质性质的重要手段。下图所示是氮及其部分化合物的“价类二维图”,根据图示回答下列问题。
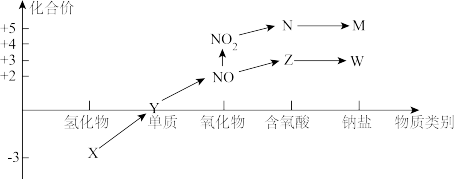
某化学兴趣小组利用如图装置制备X并探究其相关性质。

(1)从物质的性质分析,B中盛放的试剂名称为:_______ 。
(2)将D与a相连,在E中产生白色沉淀,其沉淀的化学式为:_______ ,若向a处分别通入_______ (填标号),在E中也会产生白色沉淀。
A. B.
B. C.
C. D.
D.
(3)实验发现C中粉末完全变红,D中无水硫酘铜变蓝,还产生单质Y。若C中红色固体为单质,实验后将C中固体与稀硝酸混合,充分反应后红色固体有剩余,再加入下列的_______(填标号)试剂,固体又可以继续溶解。
(4)人体正常的血红蛋白含有 ,但若误食W,会导致血红蛋白含有的
,但若误食W,会导致血红蛋白含有的 转化为
转化为 而中毒,服用维生素C可解毒。解毒时维生素C的作用是
而中毒,服用维生素C可解毒。解毒时维生素C的作用是_______ (填“还原性”或“氧化性”)。

某化学兴趣小组利用如图装置制备X并探究其相关性质。

(1)从物质的性质分析,B中盛放的试剂名称为:
(2)将D与a相连,在E中产生白色沉淀,其沉淀的化学式为:
A.
 B.
B. C.
C. D.
D.
(3)实验发现C中粉末完全变红,D中无水硫酘铜变蓝,还产生单质Y。若C中红色固体为单质,实验后将C中固体与稀硝酸混合,充分反应后红色固体有剩余,再加入下列的_______(填标号)试剂,固体又可以继续溶解。
A. 溶液 溶液 | B. 溶液 溶液 | C.稀 | D. 溶液 溶液 |
(4)人体正常的血红蛋白含有
 ,但若误食W,会导致血红蛋白含有的
,但若误食W,会导致血红蛋白含有的 转化为
转化为 而中毒,服用维生素C可解毒。解毒时维生素C的作用是
而中毒,服用维生素C可解毒。解毒时维生素C的作用是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】某化学学习小组设计下图实验装置(夹带装置略去)制备Cl2,并探究氯气的相关性质。
已知: 硫代硫酸钠(Na2S2O3)溶液在工业上可作脱氯剂。

(1)若A装置中固体药品为KMnO4,产生标况下3.36L氯气时,被氧化的HCl的物质的量为___ 。
(2)装置B的作用是_____________ 。
(3)装置C的作用是探究氯气与Na2S溶液反应。反应开始后,观察到C中产生黄色沉淀。写出该反应的化学方程式_____________ 。
(4)装置D的作用是验证氯气是否具有漂白性,I处是湿润的有色布条,则II、III处应加入的物质分别是__________ 、____________ 。
【探究与反思】
按图中设计装置进行实验,甲同学观察到C中先产生黄色沉淀。但是长时间通入氯气后,溶液又变澄清,该同学思考后设计如下实验检验C中生成物的成分。
实验操作步骤:
①取少量原Na2S溶液于小试管中,滴加BaCl2溶液,无明显现象;
②取少量反应后C中澄清溶液于小试管中,滴加过量的盐酸,无气泡冒出,再滴加BaCl2溶液,产生白色沉淀。
(5)该同学根据实验现象得出结论:装置C 中生成的含硫元素的物质是______ (填化学式)。推测过量的氯气与Na2S溶液反应的离子方程式为________________ 。
(6)请用离子方程式说明装置E的作用______________ 。
(7)乙同学认真思考后认为装置E中的试剂不合理。请用离子方程式和必要的文字解释原因:________________________________ 。
已知: 硫代硫酸钠(Na2S2O3)溶液在工业上可作脱氯剂。

(1)若A装置中固体药品为KMnO4,产生标况下3.36L氯气时,被氧化的HCl的物质的量为
(2)装置B的作用是
(3)装置C的作用是探究氯气与Na2S溶液反应。反应开始后,观察到C中产生黄色沉淀。写出该反应的化学方程式
(4)装置D的作用是验证氯气是否具有漂白性,I处是湿润的有色布条,则II、III处应加入的物质分别是
【探究与反思】
按图中设计装置进行实验,甲同学观察到C中先产生黄色沉淀。但是长时间通入氯气后,溶液又变澄清,该同学思考后设计如下实验检验C中生成物的成分。
实验操作步骤:
①取少量原Na2S溶液于小试管中,滴加BaCl2溶液,无明显现象;
②取少量反应后C中澄清溶液于小试管中,滴加过量的盐酸,无气泡冒出,再滴加BaCl2溶液,产生白色沉淀。
(5)该同学根据实验现象得出结论:装置C 中生成的含硫元素的物质是
(6)请用离子方程式说明装置E的作用
(7)乙同学认真思考后认为装置E中的试剂不合理。请用离子方程式和必要的文字解释原因:
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】某校学生课外活动小组的同学设计如图所示实验装置,用来验证一氧化碳具有还原性,回答下列问题:【提示:C+CO2 2CO C+H2O(g)
2CO C+H2O(g) CO+H2】
CO+H2】

(1)写出装置A中所发生反应的离子方程式:____________ 。
(2)装置B中最适宜的试剂是________________ 。
(3)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是________ 。
(4)按照如图装置进行实验时,首先进行的操作是__________ 。
(5)根据实验中的___________ 现象,可证明CO具有还原性,有关反应的化学方程式是:__________ 。
(6)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在图中装置_____ 与________ 之间连接图中的________ 装置(填序号)。
① NaHCO3溶液 ②
NaHCO3溶液 ② 碱石灰 ③
碱石灰 ③ NaOH溶液 ④
NaOH溶液 ④ 浓H2SO4
浓H2SO4
 2CO C+H2O(g)
2CO C+H2O(g) CO+H2】
CO+H2】
(1)写出装置A中所发生反应的离子方程式:
(2)装置B中最适宜的试剂是
(3)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是
(4)按照如图装置进行实验时,首先进行的操作是
(5)根据实验中的
(6)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在图中装置
①
 NaHCO3溶液 ②
NaHCO3溶液 ② 碱石灰 ③
碱石灰 ③ NaOH溶液 ④
NaOH溶液 ④ 浓H2SO4
浓H2SO4
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】某同学在实验室研究Fe与H2SO4的反应
【实验分析】
(1)实验Ⅰ中,铁与稀硫酸反应的离子方程式为__ .
(2)实验Ⅱ中,铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止,
这一现象被称为__ .
(3)实验Ⅲ,已知:浓H2SO4的沸点为338.2℃,加热试管A,温度保持在250℃~300℃,产生大量气体,B中品红褪色,D处始终未检测到可燃性气体. A中产生的气体是__ ,装置C的作用是__ .
(4)实验Ⅲ结束后,
甲同学认为装置C中产生Na2SO3,
乙同学认为SO2过量,产物中还可能含有_________ ,
丙同学认为可能还含有Na2SO4,设计简单实验验证是否含有SO42-,正确的是( )
A.先加入稀硝酸,没有产生沉淀,然后再加硝酸钡,产生白色沉淀,证明有SO42-存在
B.先加入硝酸钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存在
C.先加入稀盐酸,没有产生沉淀,然后再加氯化钡,产生白色沉淀,证明有SO42-存在
(5)对比实验Ⅰ、Ⅱ和Ⅲ,同学们得出以下结论:
①浓硫酸和稀硫酸都具有氧化性,但原因不同,浓硫酸的氧化性源于+6价的S元素,稀硫酸的氧化性源于________ .
②影响反应产物多样性的因素有_____________________ (至少填两个).

【实验分析】
(1)实验Ⅰ中,铁与稀硫酸反应的离子方程式为
(2)实验Ⅱ中,铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止,
这一现象被称为
(3)实验Ⅲ,已知:浓H2SO4的沸点为338.2℃,加热试管A,温度保持在250℃~300℃,产生大量气体,B中品红褪色,D处始终未检测到可燃性气体. A中产生的气体是
(4)实验Ⅲ结束后,
甲同学认为装置C中产生Na2SO3,
乙同学认为SO2过量,产物中还可能含有
丙同学认为可能还含有Na2SO4,设计简单实验验证是否含有SO42-,正确的是
A.先加入稀硝酸,没有产生沉淀,然后再加硝酸钡,产生白色沉淀,证明有SO42-存在
B.先加入硝酸钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存在
C.先加入稀盐酸,没有产生沉淀,然后再加氯化钡,产生白色沉淀,证明有SO42-存在
(5)对比实验Ⅰ、Ⅱ和Ⅲ,同学们得出以下结论:
①浓硫酸和稀硫酸都具有氧化性,但原因不同,浓硫酸的氧化性源于+6价的S元素,稀硫酸的氧化性源于
②影响反应产物多样性的因素有
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
真题
解题方法
【推荐2】纳米CdSe(硒化镉)可用作光学材料。在一定条件下,由Na2SO3和Se(硒,与S为同族元素)反应生成Na2SeSO3(硒代硫酸钠);再由CdCl2形成的配合物与Na2SeSO3反应制得CdSe纳米颗粒。流程图如下:
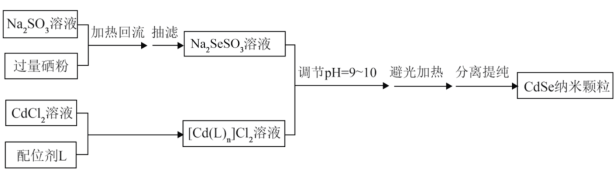
注:①CdCl2能与配位剂L形成配合物[Cd(L)n]Cl2
[Cd(L)n]Cl2=[Cd(L)n]2++2Cl-;[Cd(L)n]2+ Cd2++nL
Cd2++nL
②纳米颗粒通常指平均粒径为1~100nm的粒子。
请回答:
(1)图1加热回流装置中,仪器a的名称是________ ,进水口为________ (填1或2)
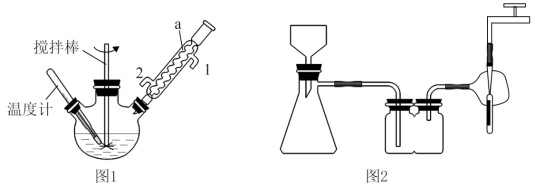
(2)①分离CdSe纳米颗粒不宜采用抽滤的方法,理由是___________________________ 。
②有关抽滤,下列说法正确的是______________ 。
A.滤纸应比漏斗内径略小,且能盖住所有小孔
B.图2抽滤装置中只有一处错误,即漏斗颈口斜面没有对着吸滤瓶的支管口
C.抽滤得到的滤液应从吸滤瓶的支管口倒出
D.抽滤完毕后,应先拆下连接抽气泵和吸滤瓶的橡皮管,再关水龙头,以防倒吸
(3)研究表明,CdSe的生成分两步:①SeSO32-在碱性条件下生成HSe-;②HSe-与Cd2+反应生成CdSe。
完成第①步反应的离子方程式 SeSO32-+_________ =HSe-+__________ 。
写出第②步反应的离子方程式_________________________________________ 。
(4)CdSe纳米颗粒的大小影响其发光性质。某研究小组在一定配位剂浓度下,探究了避光加热步骤中反应时间和温度对纳米颗粒平均粒径的影响,如图3所示;同时探究了某温度下配位剂浓度对纳米颗粒平均粒径的影响,如图4所示。
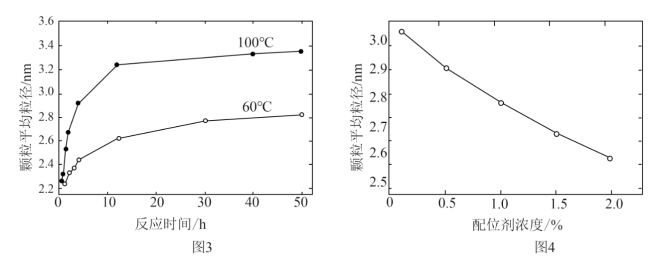
下列说法正确的是__________ 。
A.改变反应温度和反应时间,可以得到不同发光性质的CdSe纳米颗粒
B.在图3所示的两种温度下,只有60℃反应条件下可得到2.7 nm的CdSe纳米颗粒
C.在其它条件不变时,若要得到较大的CdSe纳米颗粒,可采用降低温度的方法
D.若要在60℃得到3.0 nm的CdSe纳米颗粒,可尝试降低配位剂浓度的方法

注:①CdCl2能与配位剂L形成配合物[Cd(L)n]Cl2
[Cd(L)n]Cl2=[Cd(L)n]2++2Cl-;[Cd(L)n]2+
 Cd2++nL
Cd2++nL②纳米颗粒通常指平均粒径为1~100nm的粒子。
请回答:
(1)图1加热回流装置中,仪器a的名称是

(2)①分离CdSe纳米颗粒不宜采用抽滤的方法,理由是
②有关抽滤,下列说法正确的是
A.滤纸应比漏斗内径略小,且能盖住所有小孔
B.图2抽滤装置中只有一处错误,即漏斗颈口斜面没有对着吸滤瓶的支管口
C.抽滤得到的滤液应从吸滤瓶的支管口倒出
D.抽滤完毕后,应先拆下连接抽气泵和吸滤瓶的橡皮管,再关水龙头,以防倒吸
(3)研究表明,CdSe的生成分两步:①SeSO32-在碱性条件下生成HSe-;②HSe-与Cd2+反应生成CdSe。
完成第①步反应的离子方程式 SeSO32-+
写出第②步反应的离子方程式
(4)CdSe纳米颗粒的大小影响其发光性质。某研究小组在一定配位剂浓度下,探究了避光加热步骤中反应时间和温度对纳米颗粒平均粒径的影响,如图3所示;同时探究了某温度下配位剂浓度对纳米颗粒平均粒径的影响,如图4所示。

下列说法正确的是
A.改变反应温度和反应时间,可以得到不同发光性质的CdSe纳米颗粒
B.在图3所示的两种温度下,只有60℃反应条件下可得到2.7 nm的CdSe纳米颗粒
C.在其它条件不变时,若要得到较大的CdSe纳米颗粒,可采用降低温度的方法
D.若要在60℃得到3.0 nm的CdSe纳米颗粒,可尝试降低配位剂浓度的方法
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】实验室以菱锰矿(含 及少量Fe、Si的氧化物等)为原料制备高纯
及少量Fe、Si的氧化物等)为原料制备高纯 和
和 的流程如下图所示。已知:室温下
的流程如下图所示。已知:室温下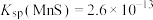 、
、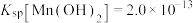 、
、 电离常数
电离常数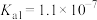 、
、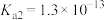 。
。

(1)该流程中可循环使用的物质有___________ 。
(2)“沉铁”过程需加氨水调节溶液pH,使溶液中 转化为
转化为 沉淀同时得到
沉淀同时得到 溶液。检验
溶液。检验 溶液中是否含有
溶液中是否含有 的实验方法是
的实验方法是___________ 。
(3)沉铁过程中也会产生少量 沉淀。
沉淀。 在工业上可用于去除溶液中
在工业上可用于去除溶液中 ,反应为:
,反应为: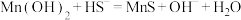 ,其平衡常数K=
,其平衡常数K=___________ 。
(4)制取 。在题图1所示的实验装置中,搅拌下使一定量的
。在题图1所示的实验装置中,搅拌下使一定量的 溶液与氨水—
溶液与氨水— 混合溶液充分反应。
混合溶液充分反应。
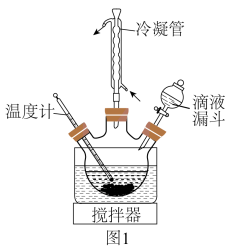
①滴液漏斗中添加的药品是___________ 。
②混合溶液中氨水的作用是___________ 。
(5)制取 。固定其他条件不变,反应物物质的量浓度比值、温度、空气流量对
。固定其他条件不变,反应物物质的量浓度比值、温度、空气流量对 溶液制取
溶液制取 纯度的影响如题图2、题图3、题图4所示。
纯度的影响如题图2、题图3、题图4所示。

补充完整制取纯净 的实验方案:取150mL 0.7
的实验方案:取150mL 0.7 的
的 溶液,
溶液,___________ ,控制搅拌速率1500 反应8h,
反应8h,___________ ,110℃干燥2h,得到纯净的 (须使用的试剂:1.4
(须使用的试剂:1.4 NaOH溶液、1.0
NaOH溶液、1.0
 溶液)。
溶液)。
 及少量Fe、Si的氧化物等)为原料制备高纯
及少量Fe、Si的氧化物等)为原料制备高纯 和
和 的流程如下图所示。已知:室温下
的流程如下图所示。已知:室温下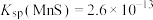 、
、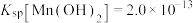 、
、 电离常数
电离常数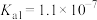 、
、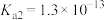 。
。
(1)该流程中可循环使用的物质有
(2)“沉铁”过程需加氨水调节溶液pH,使溶液中
 转化为
转化为 沉淀同时得到
沉淀同时得到 溶液。检验
溶液。检验 溶液中是否含有
溶液中是否含有 的实验方法是
的实验方法是(3)沉铁过程中也会产生少量
 沉淀。
沉淀。 在工业上可用于去除溶液中
在工业上可用于去除溶液中 ,反应为:
,反应为: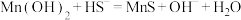 ,其平衡常数K=
,其平衡常数K=(4)制取
 。在题图1所示的实验装置中,搅拌下使一定量的
。在题图1所示的实验装置中,搅拌下使一定量的 溶液与氨水—
溶液与氨水— 混合溶液充分反应。
混合溶液充分反应。
①滴液漏斗中添加的药品是
②混合溶液中氨水的作用是
(5)制取
 。固定其他条件不变,反应物物质的量浓度比值、温度、空气流量对
。固定其他条件不变,反应物物质的量浓度比值、温度、空气流量对 溶液制取
溶液制取 纯度的影响如题图2、题图3、题图4所示。
纯度的影响如题图2、题图3、题图4所示。
补充完整制取纯净
 的实验方案:取150mL 0.7
的实验方案:取150mL 0.7 的
的 溶液,
溶液, 反应8h,
反应8h, (须使用的试剂:1.4
(须使用的试剂:1.4 NaOH溶液、1.0
NaOH溶液、1.0
 溶液)。
溶液)。
您最近一年使用:0次



