(1)FeCl3的水溶液呈_________ “酸”、“中”、“碱”)性,常温时的pH_____ 7(填“>”、“=”、“<”),原因是(用离子方程式表示):_______________________ 。
(2)实验室在配制 FeCl3的溶液时,常将FeCl3固体先溶于________ 中,然后再用蒸馏水稀释到所需的浓度。
(3)把FeCl3溶液蒸干,灼烧,最后得到的主要产物是____________________ 。
(4)普通泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒中盛碳酸氢钠溶液,其化学反应的原理是(用离子方程式解释)_________________________________________ 。碳酸氢钠溶液中的电荷守恒式为 _____________________________________________ ,溶液中离子浓度由大到小的顺序为_____________________________________ 。
(2)实验室在配制 FeCl3的溶液时,常将FeCl3固体先溶于
(3)把FeCl3溶液蒸干,灼烧,最后得到的主要产物是
(4)普通泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒中盛碳酸氢钠溶液,其化学反应的原理是(用离子方程式解释)
更新时间:2016-12-09 07:04:00
|
【知识点】 盐类的水解
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】按要求填空:
(1)试解释碳酸氢钠水溶液显碱性的原因_____________________________ 。(用离子方程式和文字叙述解释)
(2)CuSO4的水溶液呈酸性的原因是:________ (用离子方程式表示);实验室在配制CuSO4溶液时,需向CuSO4的溶液中加入少量硫酸,其目的是________ 。
(3)在25℃时,在浓度均为0.1mol/L的下列溶液中:①(NH4)2SO4②(NH4)2CO3③(NH4)2Fe(SO4)2④氨水,其中NH4+的物质的量浓度由小到大的顺序是________ (填序号)。
(4)用0.1mol·L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
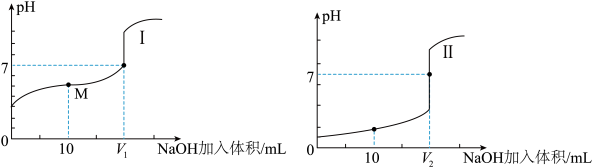
①滴定醋酸的曲线是___________ (填“I”或“Ⅱ”)。
②滴定开始前,0.1mol·L-1NaOH、0.1mol·L-1的盐酸和0.1mol·L-1醋酸三种溶液中由水电离出的c(H+)最大的是_______ 溶液。
③图I中,V=10时,溶液中的c(H+)_________ c(OH-)(填“>”、“=”或“<”,下同),c(Na+)_________ c(CH3COO-)。
(5)常温下两种溶液:a.pH=4NH4Cl,b.pH=4盐酸溶液,其中水电离出c(H+)之比为______ 。
(6)已知:25℃时KSP[Cu(OH)2]=2×10-20。常温下:某CuSO4溶液中c(Cu2+)=0.02mol∙L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH最小为________ 。
(1)试解释碳酸氢钠水溶液显碱性的原因
(2)CuSO4的水溶液呈酸性的原因是:
(3)在25℃时,在浓度均为0.1mol/L的下列溶液中:①(NH4)2SO4②(NH4)2CO3③(NH4)2Fe(SO4)2④氨水,其中NH4+的物质的量浓度由小到大的顺序是
(4)用0.1mol·L-1NaOH溶液分别滴定体积均为20mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是
②滴定开始前,0.1mol·L-1NaOH、0.1mol·L-1的盐酸和0.1mol·L-1醋酸三种溶液中由水电离出的c(H+)最大的是
③图I中,V=10时,溶液中的c(H+)
(5)常温下两种溶液:a.pH=4NH4Cl,b.pH=4盐酸溶液,其中水电离出c(H+)之比为
(6)已知:25℃时KSP[Cu(OH)2]=2×10-20。常温下:某CuSO4溶液中c(Cu2+)=0.02mol∙L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH最小为
您最近一年使用:0次
【推荐2】酸碱盐在水溶液中反应以离子反应为特征,以化学平衡理论为基础。回答下列问题
(1)298K时,在20.0mL0.10mol·L-1氨水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10mol·L-1氨水的电离度为1.32%,下列叙述正确的是_____。

(2)弱电解质的电离是微弱的,电离产生的微粒非常少,并且还要考虑水的电离,而多元弱酸是分步电离的。弱电解质离子的水解损失也是微量的(双水解除外)。比较下列几组溶液中指定微粒浓度的大小。相同浓度的下列溶液①CH3COONH4②CH3COONa③CH3COOH。c(CH3COO-)由大到小的顺序是_____ 。
(3)十二水合硫酸铝钾又称:明矾、白矾、钾矾、钾铝矾、钾明矾,是含有结晶水的硫酸钾和硫酸铝的复盐。主要产地有安徽省,温州矾矿素有“世界矾都”之称。请你用一个离子方程式表示明矾水溶液与NaHCO3溶液混合时发生的离子反应:_____ 。
(4)水解反应的逆反应是中和反应,盐溶液水解一般得到对应的弱酸或者弱碱。氯化铝为无色透明晶体或白色而微带浅黄色的结晶性粉末,易溶于水并强烈水解。将AlCl3溶液蒸干并灼热得到的固体物质是_____ 。
(5)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5mol·L-1)时,此时溶液中c(
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5mol·L-1)时,此时溶液中c( )等于
)等于_____ mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)
(1)298K时,在20.0mL0.10mol·L-1氨水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10mol·L-1氨水的电离度为1.32%,下列叙述正确的是_____。

| A.该滴定过程应该选择酚酞作为指示剂 |
| B.M点对应的盐酸体积为20.0mL |
C.M点处的溶液中c( )=c(Cl-)=c(H+)=c(OH-) )=c(Cl-)=c(H+)=c(OH-) |
| D.N点处的溶液中pH<12 |
(3)十二水合硫酸铝钾又称:明矾、白矾、钾矾、钾铝矾、钾明矾,是含有结晶水的硫酸钾和硫酸铝的复盐。主要产地有安徽省,温州矾矿素有“世界矾都”之称。请你用一个离子方程式表示明矾水溶液与NaHCO3溶液混合时发生的离子反应:
(4)水解反应的逆反应是中和反应,盐溶液水解一般得到对应的弱酸或者弱碱。氯化铝为无色透明晶体或白色而微带浅黄色的结晶性粉末,易溶于水并强烈水解。将AlCl3溶液蒸干并灼热得到的固体物质是
(5)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与
 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5mol·L-1)时,此时溶液中c(
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5mol·L-1)时,此时溶液中c( )等于
)等于
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB- H++B2-,回答下列问题:
H++B2-,回答下列问题:
(1)NaHB溶液显___ (填“酸性”、“中性”或“碱性”或“无法确定”),理由是_______ 。
(2)某温度下,向0.1 mol·L-1 的NaHB溶液中滴入0.1 mol·L-1 KOH溶液至中性,此时溶液中以下关系一定正确的是________ (填序号)。
a.c(H+)·c(OH-)=1×10-14 b.c(Na+)+c(K+)=c(HB-)+2c(B2-)
c.c(Na+)>c(K+) d.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知0.1 mol·L-1NaHB溶液的pH=2,则0.1 mol·L-1H2B溶液中氢离子的物质的量浓度可能是________ 0.11 mol·L-1(填“<”、“>”或“=”); 理由是__________ 。
 H++B2-,回答下列问题:
H++B2-,回答下列问题:(1)NaHB溶液显
(2)某温度下,向0.1 mol·L-1 的NaHB溶液中滴入0.1 mol·L-1 KOH溶液至中性,此时溶液中以下关系一定正确的是
a.c(H+)·c(OH-)=1×10-14 b.c(Na+)+c(K+)=c(HB-)+2c(B2-)
c.c(Na+)>c(K+) d.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知0.1 mol·L-1NaHB溶液的pH=2,则0.1 mol·L-1H2B溶液中氢离子的物质的量浓度可能是
您最近一年使用:0次



