水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题:
(1)纯水在 100℃时,pH=6,该温度下 0.1mol•L﹣1 的 NaOH 溶液中,溶液的 pH=_____ 。
(2)25℃时,向水中加入少量碳酸钠固体,得到 pH 为 11 的溶液,其水解的离子方程式为_____ , 由水电离出的 c(OH﹣)=_____ mol•L﹣1。
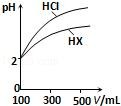
(3)体积均为 100mL、pH 均为 2 的盐酸与一元酸 HX,加水稀释过程中 pH 与溶液体积的关系如图所示,则 HX 是_____ (填“强酸”或“弱酸”),理由是_____ 。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。
①25℃时,等浓度的 NaCN 溶液、Na2CO3 溶液和 CH3COONa 溶液,pH 由大到小的顺序为________ (填化学式)。
②25℃时,在 0.5mol/L 的醋酸溶液中由醋酸电离出的 c(H+)约是由水电离出的 c(H+)的_________ 倍。
(1)纯水在 100℃时,pH=6,该温度下 0.1mol•L﹣1 的 NaOH 溶液中,溶液的 pH=
(2)25℃时,向水中加入少量碳酸钠固体,得到 pH 为 11 的溶液,其水解的离子方程式为
(3)体积均为 100mL、pH 均为 2 的盐酸与一元酸 HX,加水稀释过程中 pH 与溶液体积的关系如图所示,则 HX 是

(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10﹣10 |
| CH3COOH | K=1.8×10﹣5 |
| H2CO3 | K1=4.3×10﹣7、K2=5.6×10﹣11 |
①25℃时,等浓度的 NaCN 溶液、Na2CO3 溶液和 CH3COONa 溶液,pH 由大到小的顺序为
②25℃时,在 0.5mol/L 的醋酸溶液中由醋酸电离出的 c(H+)约是由水电离出的 c(H+)的
更新时间:2016-12-09 07:07:29
|
相似题推荐
填空题
|
较难
(0.4)
【推荐1】一定温度下,用水吸收SO2气体时,溶液中水的电离平衡________ 移动(填“向左”“向右”或“不”);若得到pH=4的H2SO3溶液,试计算溶液中 =
=________ ;SO2可用足量小苏打溶液吸收,反应的离子方程式是_________ 。(已知该温度下,H2SO3的电离常数:Ka1=4.5×10-2,Ka2=2.5×10-7,H2CO3的电离常数:Ka1=8.4×10-7,Ka2=1.2×10-10)
 =
=
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH 、HCl、NH4HSO4中的一种。常温下进行下列实验:
①将1 L pH=3的A溶液分别与0.001mol·L-1 xL B溶液、0.001mol·L-1 yL D溶液充分反应至中性,x、y大小关系为: y<x;
②浓度均为0.1mol·L-1A和E溶液,pH:A<E;
③浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)C是______ 溶液,D是______ 溶液。
(2)100mL0.01mol•L﹣1的B溶液与10mL 0.1mol•L﹣1的B溶液相比较,下列数值中,前者大于后者的是______ (填写序号)
① ②
② ③ c(H+)和c(OH-)的乘积 ④ OH-的物质的量
③ c(H+)和c(OH-)的乘积 ④ OH-的物质的量
(3)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________ (填写序号)
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌粉物质的量A=E ④反应过程的平均速率 E>A
⑤A溶液里有锌粉剩余 ⑥E溶液里有锌粉剩余
①将1 L pH=3的A溶液分别与0.001mol·L-1 xL B溶液、0.001mol·L-1 yL D溶液充分反应至中性,x、y大小关系为: y<x;
②浓度均为0.1mol·L-1A和E溶液,pH:A<E;
③浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)C是
(2)100mL0.01mol•L﹣1的B溶液与10mL 0.1mol•L﹣1的B溶液相比较,下列数值中,前者大于后者的是
①
 ②
② ③ c(H+)和c(OH-)的乘积 ④ OH-的物质的量
③ c(H+)和c(OH-)的乘积 ④ OH-的物质的量(3)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌粉物质的量A=E ④反应过程的平均速率 E>A
⑤A溶液里有锌粉剩余 ⑥E溶液里有锌粉剩余
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐3】室温下,某一元弱酸HA的电离常数K=1.6×10-6。向20.00 mL 浓度约为0.1 mol·L-1 HA溶液中逐滴加入0.1000 mol·L-1的标准KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:(已知lg4=0.6)

(1)a点溶液中pH约为________ ,此时溶液中H2O电离出的c(H+)为________ 。
(2)a、b、c、d四点中水的电离程度最大的是________ 点,滴定过程中宜选用__________ 作指示剂,滴定终点在________ (填“c点以上”或“c点以下”)。
(3)滴定过程中部分操作如下,下列各操作使测量结果偏高的是__________ (填字母序号)。
A.滴定前碱式滴定管未用标准KOH溶液润洗
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定
C.滴定过程中,溶液出现变色后,立即停止滴定
D.滴定结束后,仰视液面,读取KOH溶液体积
(4)若重复三次滴定实验的数据如下表所示,计算滴定所测HA溶液的物质的量浓度为____ mol/L(注意有效数字)。

(1)a点溶液中pH约为
(2)a、b、c、d四点中水的电离程度最大的是
(3)滴定过程中部分操作如下,下列各操作使测量结果偏高的是
A.滴定前碱式滴定管未用标准KOH溶液润洗
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定
C.滴定过程中,溶液出现变色后,立即停止滴定
D.滴定结束后,仰视液面,读取KOH溶液体积
(4)若重复三次滴定实验的数据如下表所示,计算滴定所测HA溶液的物质的量浓度为
| 实验序号 | KOH溶液体积/mL | 待测HA溶液体积/mL |
| 1 | 21.01 | 20.00 |
| 2 | 20.99 | 20.00 |
| 3 | 21.60 | 20.00 |
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】按要求填空
(1)KAl(SO4)2·12H2O可做净水剂,其原理是(用离子方程式表示)___________ 。
(2)将体积相等的NaOH稀溶液和CH3COOH稀溶液充分混合后,若溶液中c(Na+)=c(CH3COO-),则混合前c(NaOH)___________ (填“ ”“
”“ ”或“
”或“ ”)c(CH3COOH)。
”)c(CH3COOH)。
(3)将AgCl分别放入①5mL H2O、②10mL 0.2mol/L MgCl2溶液、③20mL 0.5mol/L AgNO3溶液、④40mL 0.1mol/L HCl溶液中溶解至饱和,各溶液中Ag+的浓度由大到小的顺序是___________ (用序号填空)。
(4)常温下a mol/L CH3COOH稀溶液和b mol/L KOH稀溶液等体积混合,若溶液呈中性则CH3COOH的电离平衡常数Ka=___________ 。
(5)室温下,1mol/L相同体积的下列四种溶液①BaCl2、②FeCl3、③HF、④Na2CO3所含阳离子数由少到多的顺序是(用序号填空)___________ 。
(6)标准状况下,将2.24L CO2通入100mL浓度为1.5mol/L的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:2c(Na+)=___________ 。
(1)KAl(SO4)2·12H2O可做净水剂,其原理是(用离子方程式表示)
(2)将体积相等的NaOH稀溶液和CH3COOH稀溶液充分混合后,若溶液中c(Na+)=c(CH3COO-),则混合前c(NaOH)
 ”“
”“ ”或“
”或“ ”)c(CH3COOH)。
”)c(CH3COOH)。(3)将AgCl分别放入①5mL H2O、②10mL 0.2mol/L MgCl2溶液、③20mL 0.5mol/L AgNO3溶液、④40mL 0.1mol/L HCl溶液中溶解至饱和,各溶液中Ag+的浓度由大到小的顺序是
(4)常温下a mol/L CH3COOH稀溶液和b mol/L KOH稀溶液等体积混合,若溶液呈中性则CH3COOH的电离平衡常数Ka=
(5)室温下,1mol/L相同体积的下列四种溶液①BaCl2、②FeCl3、③HF、④Na2CO3所含阳离子数由少到多的顺序是(用序号填空)
(6)标准状况下,将2.24L CO2通入100mL浓度为1.5mol/L的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:2c(Na+)=
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】(1)体积相同,浓度均为0.2 mol·L-1的盐酸和CH3COOH溶液,分别加水稀释10倍,溶液的pH分别变成m和n,则m与n的关系为_______ 。
(2)体积相同,浓度均为0.2 mol·L-1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为_______ 。
(3)体积相同,pH均等于1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为_______ 。
(4)体积相同,pH均等于13的氨水和NaOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为_______ 。
(5)将等体积等物质的量浓度的盐酸和氨水混合后,溶液呈______ 性(填“酸”、“中”或“碱”,下同),溶液中c(NH )
)_______ c(Cl-)(“>”、“=”或“<”)。
(6)pH=3的盐酸和pH=11的氨水等体积混合后,溶液呈_______ 性(填“酸”、“中”或“碱”),溶液中c(NH )
)________ c(Cl-)(“>”、“=”或“<”)。
(7)写出NaHCO3在水溶液中的电离方程式___________________________________________ 。
(2)体积相同,浓度均为0.2 mol·L-1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为
(3)体积相同,pH均等于1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为
(4)体积相同,pH均等于13的氨水和NaOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为
(5)将等体积等物质的量浓度的盐酸和氨水混合后,溶液呈
 )
)(6)pH=3的盐酸和pH=11的氨水等体积混合后,溶液呈
 )
)(7)写出NaHCO3在水溶液中的电离方程式
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】现有25 ℃时0.1 mol·L-1的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中
________ (填“增大”、“减小”
或“不变”)。
(2)若向氨水中加入稀盐酸,使其恰好中和,写出反应的离子方程式:___________________ ;所得溶液的pH_____ 7(填“>”、“<”或“=”),用离子方程式表示其原因:_________________ 。
(3)若向该氨水中加入pH=1的盐酸,且氨水与盐酸的体积比为1∶1,则所得溶液中各离子物质的量浓度由大到小的顺序是_____________________________________________ 。
(1)若向氨水中加入少量硫酸铵固体,此时溶液中

或“不变”)。
(2)若向氨水中加入稀盐酸,使其恰好中和,写出反应的离子方程式:
(3)若向该氨水中加入pH=1的盐酸,且氨水与盐酸的体积比为1∶1,则所得溶液中各离子物质的量浓度由大到小的顺序是
您最近一年使用:0次



