氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟工业原理制备氨基甲酸铵,反应的化学方程式如下:
2NH3(g)+CO2(g) NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0
(1)如用下图装置制取氨气,你所选择的试剂是_________________ 。

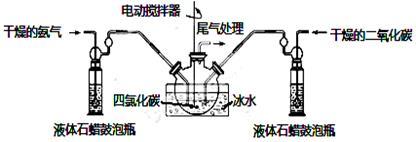
(2)制备氨基甲酸铵的装置如上图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是:______________________ 、___________________ 。
液体石蜡鼓泡瓶的作用是:_________________________________________ 。
②从反应后的混合物中分离出产品,为了得到干燥产品,应采取的方法是_____ (填写选项序号)。a.常压加热烘干 b.高压加热烘干 c.真空40 ℃以下烘干
③尾气处理装置如图所示。
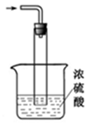
双通玻璃管的作用:___________ ;浓硫酸的作用:____________ 、____________ 。
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品11.73 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为15.00 g。
则样品中氨基甲酸铵的物质的量分数为______________ 。
2NH3(g)+CO2(g)
 NH2COONH4(s) ΔH<0
NH2COONH4(s) ΔH<0(1)如用下图装置制取氨气,你所选择的试剂是


(2)制备氨基甲酸铵的装置如上图所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中。当悬浮物较多时,停止制备。
注:四氯化碳与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是:
液体石蜡鼓泡瓶的作用是:
②从反应后的混合物中分离出产品,为了得到干燥产品,应采取的方法是
③尾气处理装置如图所示。

双通玻璃管的作用:
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品11.73 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为15.00 g。
则样品中氨基甲酸铵的物质的量分数为
更新时间:2016-12-09 07:46:13
|
相似题推荐
【推荐1】铋及其化合物广泛应用于电子材料、医药等领域.一种以含铋烧渣(主要成分为 ,还含有少量
,还含有少量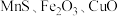 及
及 等)制取
等)制取 并回收锰的工艺流程如下:
并回收锰的工艺流程如下: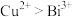 ;
;
② 易水解成
易水解成 沉淀;常温下,
沉淀;常温下, 存在的
存在的 范围约为
范围约为 ;回答下列问题:
;回答下列问题:
(1)基态锰原子的价电子排布式为____________ ;
(2)“水浸提锰”时,另加入少量稀硫酸可促进____________ (填化学式)溶解,进一步提高锰的浸取率;
(3)“浸出”时需要加入过量浓盐酸,其目的是____________ ;
(4)“滤渣2”的主要成分为Bi和____________ (填化学式);
(5)常温下,用铁氰化钾溶液检验“含 滤液”的现象为
滤液”的现象为____________ ;
(6)“脱氯”过程中发生主要反应的离子方程式为____________ ;
(7) 是一种性能优良的光催化剂,可催化降解有机污染物对硝基苯酚(
是一种性能优良的光催化剂,可催化降解有机污染物对硝基苯酚(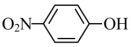 )等.对硝基苯酚的熔点高于邻硝基苯酚(
)等.对硝基苯酚的熔点高于邻硝基苯酚(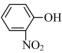 )的熔点,其原因是
)的熔点,其原因是____________________ ;
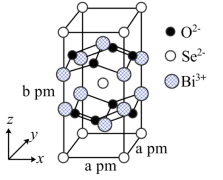
(8)我国科学家在新型二维半导体芯片材料——硒氧化铋的研究中取得突破性进展.硒氧化铋的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞参数为apm,apm,bpm;____________ (填标号); 周围紧邻的
周围紧邻的 共有
共有____________ 个;
③该晶体的密度为____________  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 ,还含有少量
,还含有少量 及
及 等)制取
等)制取 并回收锰的工艺流程如下:
并回收锰的工艺流程如下: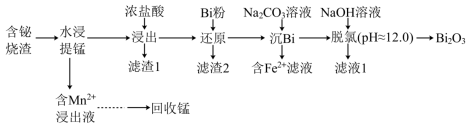
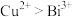 ;
;②
 易水解成
易水解成 沉淀;常温下,
沉淀;常温下, 存在的
存在的 范围约为
范围约为 ;回答下列问题:
;回答下列问题:(1)基态锰原子的价电子排布式为
(2)“水浸提锰”时,另加入少量稀硫酸可促进
(3)“浸出”时需要加入过量浓盐酸,其目的是
(4)“滤渣2”的主要成分为Bi和
(5)常温下,用铁氰化钾溶液检验“含
 滤液”的现象为
滤液”的现象为(6)“脱氯”过程中发生主要反应的离子方程式为
(7)
 是一种性能优良的光催化剂,可催化降解有机污染物对硝基苯酚(
是一种性能优良的光催化剂,可催化降解有机污染物对硝基苯酚( )等.对硝基苯酚的熔点高于邻硝基苯酚(
)等.对硝基苯酚的熔点高于邻硝基苯酚( )的熔点,其原因是
)的熔点,其原因是(8)我国科学家在新型二维半导体芯片材料——硒氧化铋的研究中取得突破性进展.硒氧化铋的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞参数为apm,apm,bpm;
A.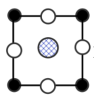 B.
B.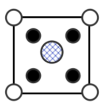 C.
C.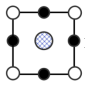 D.
D.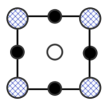
 周围紧邻的
周围紧邻的 共有
共有③该晶体的密度为
 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
【推荐2】现有下列仪器或用品:①铁架台(含铁圈、各种铁夹);②锥形瓶;③滴定管(酸式与碱式);④烧杯(若干个);⑤玻璃棒;⑥天平(含砝码);⑦滤纸;⑧量筒;⑨漏斗。有下列药品:①NaOH固体;②0.1000mol/L的标准NaOH溶液;③未知浓度的盐酸;④Na2CO3溶液。试回答以下问题。
(1)做酸碱中和滴定时,还缺少的试剂是 。
(2)小明在做“研究温度对反应速率的影响”实验时,他往两支试管均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中, B试管置于冷水中,记录溶液褪色所需的时间。褪色所需时间tA tB(填“>”、“=”或“<”)。
写出该反应的离子方程式 。
(3)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250 mL溶液:准确称量5.000g乙二酸样品,配成250mL溶液。
②滴定:准确量取25.00 mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000 mol·L-1 KMnO4溶液装入 (填“酸式”或“碱式”)滴定管,进行滴定操作。
在实验中发现,刚滴下少量KMnO4溶液时,溶液紫红色并没有马上退去。将锥形瓶摇动一段时间后,紫红色才慢慢消失;再继续滴加时,紫红色就很快褪色了,可能原因是 ;
当 ,说明达到滴定终点。
③计算:重复上述操作2次,记录实验数据如下表。则消耗KMnO4溶液的平均体积为 mL,此样品的纯度为 。(已知H2C2O4的相对分子质量为90)
④误差分析:下列操作会导致测定结果偏高的是 。
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视
(1)做酸碱中和滴定时,还缺少的试剂是 。
(2)小明在做“研究温度对反应速率的影响”实验时,他往两支试管均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中, B试管置于冷水中,记录溶液褪色所需的时间。褪色所需时间tA tB(填“>”、“=”或“<”)。
写出该反应的离子方程式 。
(3)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250 mL溶液:准确称量5.000g乙二酸样品,配成250mL溶液。
②滴定:准确量取25.00 mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000 mol·L-1 KMnO4溶液装入 (填“酸式”或“碱式”)滴定管,进行滴定操作。
在实验中发现,刚滴下少量KMnO4溶液时,溶液紫红色并没有马上退去。将锥形瓶摇动一段时间后,紫红色才慢慢消失;再继续滴加时,紫红色就很快褪色了,可能原因是 ;
当 ,说明达到滴定终点。
③计算:重复上述操作2次,记录实验数据如下表。则消耗KMnO4溶液的平均体积为 mL,此样品的纯度为 。(已知H2C2O4的相对分子质量为90)
| 序号 | 滴定前读数 | 滴定后读数 |
| 1 | 0.00 | 20.01 |
| 2 | 1.00 | 20.99 |
| 3 | 0.00 | 21.10 |
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
【推荐3】高锰酸钾(KMnO4)是常用的氧化剂。以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体的操作流程如下:
相关资料:①物质溶解度
②锰酸钾[K2MnO4]
外观性状:墨绿色结晶。其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色。
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性中,MnO42-会发生岐化反应。
试回答下列问题:
(1)烘炒前,混配KOH和软锰矿固体,将软锰矿粉碎,其作用是_____ ,上述流程中趁热过滤的目的是___ 。
(2)请写出实验中通入适量CO2时体系中可能发生反应的离子方程式:____ 。
(3)下列有关上述流程及操作说法正确的是_____ 。
A. 平炉中发生的反应中MnO2的作用是氧化剂
B. 流程中CO2用醋酸溶液代替,得到的产品纯度更高,而不能用盐酸和硫酸代替
C. 抽滤前,应先将滤纸放入布氏漏斗中,微开水龙头,使滤纸紧贴漏斗的瓷板上
D. 抽滤完毕,先断开水泵与吸滤瓶间的橡皮管,然后关闭水龙头
(4)洗涤KMnO4晶体最好的试剂是______ 。
A. 无水乙醇 B. 乙醇水溶液 C. 氢氧化钾溶液 D. 冷水
(5)晶体干燥时,温度控制在80℃为宜,温度不宜过高的理由是___ 。
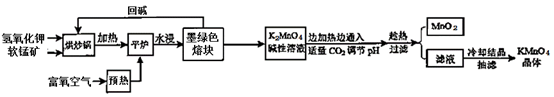
相关资料:①物质溶解度

②锰酸钾[K2MnO4]
外观性状:墨绿色结晶。其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色。
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性中,MnO42-会发生岐化反应。
试回答下列问题:
(1)烘炒前,混配KOH和软锰矿固体,将软锰矿粉碎,其作用是
(2)请写出实验中通入适量CO2时体系中可能发生反应的离子方程式:
(3)下列有关上述流程及操作说法正确的是
A. 平炉中发生的反应中MnO2的作用是氧化剂
B. 流程中CO2用醋酸溶液代替,得到的产品纯度更高,而不能用盐酸和硫酸代替
C. 抽滤前,应先将滤纸放入布氏漏斗中,微开水龙头,使滤纸紧贴漏斗的瓷板上
D. 抽滤完毕,先断开水泵与吸滤瓶间的橡皮管,然后关闭水龙头
(4)洗涤KMnO4晶体最好的试剂是
A. 无水乙醇 B. 乙醇水溶液 C. 氢氧化钾溶液 D. 冷水
(5)晶体干燥时,温度控制在80℃为宜,温度不宜过高的理由是
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
【推荐1】实验室模拟合成氨和氨催化氧化的流程如下:



已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从图中选择制取气体的合适装置:氮气________ 。
(2)氮气和氢气通过甲装置,甲装置的作用有干燥气体、__________ 、______________ 。
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,________ (“会”或“不会”)发生倒吸,原因是:________________________________________ 。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:_______________ ,锥形瓶中还可观察到的现象是:____________ 、产生白烟。用化学方程式解释现象产生的原因___________ 。



已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从图中选择制取气体的合适装置:氮气
(2)氮气和氢气通过甲装置,甲装置的作用有干燥气体、
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
【推荐2】亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组拟制备NaNO2并测定产品纯度。
I【查阅资料】
①2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。
②NO能被酸性高锰酸钾氧化成NO2。
③酸性条件下MnO 被还原为Mn2+。
被还原为Mn2+。
Ⅱ【制备产品】
用如下装置制NaNO2(夹持和加热装置已省略)。

(1)装置A烧瓶中发生反应的化学方程式为___________ 。
(2)B装置的作用是___________ 。
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂可能是___________ 。(填字母编号)
A.浓H2SO4 B.碱石灰 C.无水CaCl2 D.生石灰
Ⅲ【测定纯度】。
设计如下方案测定产品的纯度。

(4)溶液A到溶液B发生反应的离子方程式为___________ 。
(5)取样品2.3g经一系列操作后得到溶液A100mL,准确量取10.00mL A与24.00mL 0.05mol/L的酸性KMnO4溶液在锥形瓶中充分反应。反应后溶液用0.1 mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验2次,平均消耗(NH4)2 Fe(SO4)2溶液10.00ml,则样品中NaNO2的纯度为___________ 。
Ⅳ【探究反思】
(6)NaNO2的纯度偏低,该小组讨论提出的原因中可能正确的是___________ 。(填字母编号)
A.滴定至溶液紫色刚好褪去就立刻停止滴加
B.加入A与KMnO4溶液前锥形瓶未经干燥
C.实验中使用的(NH4)2 Fe(SO4)2溶液暴露在空气中时间过长
I【查阅资料】
①2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。
②NO能被酸性高锰酸钾氧化成NO2。
③酸性条件下MnO
 被还原为Mn2+。
被还原为Mn2+。Ⅱ【制备产品】
用如下装置制NaNO2(夹持和加热装置已省略)。

(1)装置A烧瓶中发生反应的化学方程式为
(2)B装置的作用是
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂可能是
A.浓H2SO4 B.碱石灰 C.无水CaCl2 D.生石灰
Ⅲ【测定纯度】。
设计如下方案测定产品的纯度。

(4)溶液A到溶液B发生反应的离子方程式为
(5)取样品2.3g经一系列操作后得到溶液A100mL,准确量取10.00mL A与24.00mL 0.05mol/L的酸性KMnO4溶液在锥形瓶中充分反应。反应后溶液用0.1 mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验2次,平均消耗(NH4)2 Fe(SO4)2溶液10.00ml,则样品中NaNO2的纯度为
Ⅳ【探究反思】
(6)NaNO2的纯度偏低,该小组讨论提出的原因中可能正确的是
A.滴定至溶液紫色刚好褪去就立刻停止滴加
B.加入A与KMnO4溶液前锥形瓶未经干燥
C.实验中使用的(NH4)2 Fe(SO4)2溶液暴露在空气中时间过长
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
【推荐3】某研究性实验小组欲验证浓硝酸在与Cu、Ag合金的反应过程中除生成NO2气体外,还会有少量NO生成、并测定Cu、Ag合金中Cu的质量分数.查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在.”为此,他们设计了如图所示的装置.
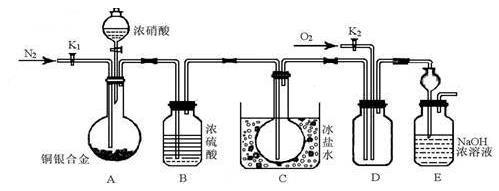
请回答下列问题
(1)写出A中Cu与HNO3反应可能的化学方式___________ .
(2)实验开始前先打开A部分的活塞K1,持续通入一段时间的氮气再关闭K1,其目的是________ ;装置中B瓶的作用是__________ .
(3)停止反应后,打开D中的活塞K2并通入O2,若有NO生成,则D中出现的现象是__________ ;实验发现,通入的O2温度高低对实验现象有较大影响,为便于观察应通入(填“热”或“冷”)______ 的O2.
(4)为减小实验误差,在A中反应完成和D中出现现象后,还应继续进行的操作是__________ .
(5)实验测得如下数据:实验前,Cu、Ag合金的质量:15.0g,浓HNO3:40mL 13.5mol•L﹣1;实验后A溶液:V=40mL c(H+)=1.0mol•L﹣1.假设反应中HNO3既无挥发也无分解,则:
①参加反应的HNO3的物质的量为______ mol.
②若已测出反应后E装置的生成物中含氮元素的质量,则为确定合金中Cu的质量分数还需测定的数据是_____ .

请回答下列问题
(1)写出A中Cu与HNO3反应可能的化学方式
(2)实验开始前先打开A部分的活塞K1,持续通入一段时间的氮气再关闭K1,其目的是
(3)停止反应后,打开D中的活塞K2并通入O2,若有NO生成,则D中出现的现象是
(4)为减小实验误差,在A中反应完成和D中出现现象后,还应继续进行的操作是
(5)实验测得如下数据:实验前,Cu、Ag合金的质量:15.0g,浓HNO3:40mL 13.5mol•L﹣1;实验后A溶液:V=40mL c(H+)=1.0mol•L﹣1.假设反应中HNO3既无挥发也无分解,则:
①参加反应的HNO3的物质的量为
②若已测出反应后E装置的生成物中含氮元素的质量,则为确定合金中Cu的质量分数还需测定的数据是
您最近一年使用:0次



