某化学学习小组发现在碱性溶液中,NO2会发生如下反应:
 2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
于是提出猜想,NO2和碱性的NaHCO3溶液也能发生类似反应。该小组利用如图所示装置,使NO2和NaHCO3溶液充分反应并获得反应液X。
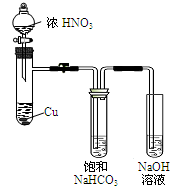
(1)①NaHCO3溶液呈碱性的原因是____ 。
②Cu与浓硝酸反应的现象是____ 。
③欲从反应后的溶液中得到硝酸铜晶体,操作步骤是:蒸发浓缩、____ 、过滤。
(2)该小组同学为了对猜想进行探究,进行如下讨论和实验。
④甲同学认为,可通过检验X中是否存在NO3-的方法验证猜想。但经讨论后认为不可行,你认为其原因是____ 。
⑤乙同学在X中加入少量K2Cr2O7溶液,结果溶液褪色,则产物中含有NaNO2。根据以上信息,写出NO2与NaHCO3溶液反应的离子方程式____ 。
⑥已知在酸性条件下NO2-能将I-氧化为I2。你认为能否用KI淀粉溶液检验X中是否存在NaNO2:_______ (填“能”或“不能”),原因是____ 。
⑦已知5NO2-+ 2MnO4-+6H+= 5NO3-+ 2Mn2+ +3H2O。称取a gKMnO4固体,加蒸馏水和少量稀硫酸溶解,配成250mL溶液。移取20.00mL X于锥形瓶,用所配的酸性KMnO4溶液进行滴定,消耗b mL KMnO4溶液。滴点终点的现象是____ ,则X中NaNO2的浓度是____ (用含a、b的式子表示)。
 2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
于是提出猜想,NO2和碱性的NaHCO3溶液也能发生类似反应。该小组利用如图所示装置,使NO2和NaHCO3溶液充分反应并获得反应液X。

(1)①NaHCO3溶液呈碱性的原因是
②Cu与浓硝酸反应的现象是
③欲从反应后的溶液中得到硝酸铜晶体,操作步骤是:蒸发浓缩、
(2)该小组同学为了对猜想进行探究,进行如下讨论和实验。
④甲同学认为,可通过检验X中是否存在NO3-的方法验证猜想。但经讨论后认为不可行,你认为其原因是
⑤乙同学在X中加入少量K2Cr2O7溶液,结果溶液褪色,则产物中含有NaNO2。根据以上信息,写出NO2与NaHCO3溶液反应的离子方程式
⑥已知在酸性条件下NO2-能将I-氧化为I2。你认为能否用KI淀粉溶液检验X中是否存在NaNO2:
⑦已知5NO2-+ 2MnO4-+6H+= 5NO3-+ 2Mn2+ +3H2O。称取a gKMnO4固体,加蒸馏水和少量稀硫酸溶解,配成250mL溶液。移取20.00mL X于锥形瓶,用所配的酸性KMnO4溶液进行滴定,消耗b mL KMnO4溶液。滴点终点的现象是
更新时间:2016-12-09 08:02:42
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】为验证SO2的性质并制备NaHSO3和Na2SO3,设计如图所示实验装置(部分夹持装置略去)。

(1)装置A中反应的化学方程式是______ 。
(2)盛放浓硫酸的仪器名称是______ ,装置B的作用是______ 。
(3)试管D中发生反应的离子方程式为______ 。
(4)装置E中设计多孔球泡的目的是______ 。
(5)已知:Na2SO3水溶液中H2SO3、HSO 、SO
、SO 的物质的量分数随pH的分布如图1所示,Na2SO3的溶解度曲线如图2所示。
的物质的量分数随pH的分布如图1所示,Na2SO3的溶解度曲线如图2所示。


①边搅拌边向装置E中的Na2CO3溶液中通入SO2制备NaHSO3溶液,当______ 时停止通入SO2。
②由NaHSO3溶液制备Na2SO3的实验方案为:边搅拌边向NaHSO3溶液中加入NaOH溶液,测量溶液的pH,当pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于______ ℃条件下趁热过滤。滴加NaOH溶液不能过慢的原因是______ 。

(1)装置A中反应的化学方程式是
(2)盛放浓硫酸的仪器名称是
(3)试管D中发生反应的离子方程式为
(4)装置E中设计多孔球泡的目的是
(5)已知:Na2SO3水溶液中H2SO3、HSO
 、SO
、SO 的物质的量分数随pH的分布如图1所示,Na2SO3的溶解度曲线如图2所示。
的物质的量分数随pH的分布如图1所示,Na2SO3的溶解度曲线如图2所示。

①边搅拌边向装置E中的Na2CO3溶液中通入SO2制备NaHSO3溶液,当
②由NaHSO3溶液制备Na2SO3的实验方案为:边搅拌边向NaHSO3溶液中加入NaOH溶液,测量溶液的pH,当pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】字母A—F代表六种不同物质,它们之间可发生如下图的转化(部分反应中生成物没有全部列出)。其中D是一种强酸;E是一种常见金属,有“国防金属”的美誉,可在CO2中燃烧。分析图示回答下列问题:

(1)A可以是_______ 或_________ ;
(2)E在CO2中燃烧的化学方程式为______________________________________ ;
(3)D与F反应的化学方程式为____________________________ ,该反应中D表现了_____ 性;
(4)50mL 14 mol·L-1物质D的溶液中加入足量的铜,充分反应后共收集到气体2.24L(标准状况下),则被还原的D的物质的量为________ mol,参加反应的铜的质量为_____ g。

(1)A可以是
(2)E在CO2中燃烧的化学方程式为
(3)D与F反应的化学方程式为
(4)50mL 14 mol·L-1物质D的溶液中加入足量的铜,充分反应后共收集到气体2.24L(标准状况下),则被还原的D的物质的量为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】现有①~⑧八种元素,①原子核外只有一个电子;①与⑤同主族,且元素⑤的焰色为黄色;⑥与⑤同周期,且⑥的原子最外层电子数比⑤多2个,其余元素在周期表中的位置如图所示。回答下列问题:
(1)元素①~⑧中,最高价氧化物对应水化物的碱性最强的元素在周期表中的位置为_______ 。
(2)元素①③⑧形成的盐为_______ (填化学式),其电子式为_______ 。
(3)元素③④⑥⑦对应原子的半径由大到小的顺序为_______ (用元素符号表示)。
(4)元素③的最高价氧化物对应水化物的稀溶液与铜反应的离子方程式为_______ 。
(5)W是第四周期与⑦洞主族的元素。据此推测W不可能具有的性质是_______(填字母)。
| ② | ③ | ④ | ||
| ⑦ | ⑧ |
(2)元素①③⑧形成的盐为
(3)元素③④⑥⑦对应原子的半径由大到小的顺序为
(4)元素③的最高价氧化物对应水化物的稀溶液与铜反应的离子方程式为
(5)W是第四周期与⑦洞主族的元素。据此推测W不可能具有的性质是_______(填字母)。
| A.最高正化合价为+6 | B.气态氢化物比H2S稳定 |
| C.最高价氧化物对应水化物的酸性比硫酸弱 | D.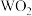 只具有氧化性 只具有氧化性 |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)制备碳酸亚铁的流程如下:
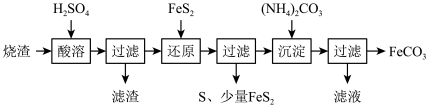
(1)“酸溶”时加快反应速率的方法有___________ (写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:FeS2 +14Fe3+ +8H2O=15Fe2+ +2SO +16H+,则另一个反应的离子方程式为:
+16H+,则另一个反应的离子方程式为:___________ ;
②FeS2还原后,检验Fe3+是否反应完全的方法是___________ 。
(3)①“沉淀”时,需控制pH不宜过高,否则生成的FeCO3中可能混有___________ 杂质;
②写出加入NH4HCO3生成“沉淀”的化学方程式:___________ ;
③所得FeCO3需充分洗涤,检验沉淀已洗涤干净的方法是___________ 。
(4)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为___________ (填化学式)。
(5)FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO。现煅烧23.2kg的FeCO3,得到Fe2O3和FeO的混合物15.84kg。则Fe2O3的质量为___________ kg。

(1)“酸溶”时加快反应速率的方法有
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:FeS2 +14Fe3+ +8H2O=15Fe2+ +2SO
 +16H+,则另一个反应的离子方程式为:
+16H+,则另一个反应的离子方程式为:②FeS2还原后,检验Fe3+是否反应完全的方法是
(3)①“沉淀”时,需控制pH不宜过高,否则生成的FeCO3中可能混有
②写出加入NH4HCO3生成“沉淀”的化学方程式:
③所得FeCO3需充分洗涤,检验沉淀已洗涤干净的方法是
(4)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为
(5)FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO。现煅烧23.2kg的FeCO3,得到Fe2O3和FeO的混合物15.84kg。则Fe2O3的质量为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】现有无色透明溶液,只含有下列离子中的若干种,每种离的个数相等: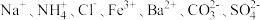 现取三份各100 mL溶液进行实验
现取三份各100 mL溶液进行实验
实验1:第一份加入足量AgNO3溶液有白色沉淀产生;
实验2:第二份加入足量NaOH溶液加热有气体放出;
实验3:第三份加入足量BaCl2溶液后,有沉淀生成,加入足量盐酸后沉淀全部溶解。
(1)由实验1能否确定Cl⁻存在?_________ (填“能”或“否”),理由_______________ 。
(2)由实验2可知该溶液中含有的离子是__________________ 。
(3)实验3中沉淀的化学式为____________ ,该沉淀溶于盐酸的离子方式为_______________ 。
(4)综合上述实验,能否确定有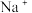 存在?为什么?
存在?为什么?___________ (填“能”或“否”)。
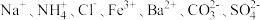 现取三份各100 mL溶液进行实验
现取三份各100 mL溶液进行实验实验1:第一份加入足量AgNO3溶液有白色沉淀产生;
实验2:第二份加入足量NaOH溶液加热有气体放出;
实验3:第三份加入足量BaCl2溶液后,有沉淀生成,加入足量盐酸后沉淀全部溶解。
(1)由实验1能否确定Cl⁻存在?
(2)由实验2可知该溶液中含有的离子是
(3)实验3中沉淀的化学式为
(4)综合上述实验,能否确定有
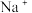 存在?为什么?
存在?为什么?
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某实验小组设计实验证明某碳酸钠粉末中混有硫酸钠和氯化钠,请完成下列空白:
(4)实验步骤(2)中,判断所加试剂已过量的方法是__________________________________
| 实验步骤 | 实验现象 | 有关化学方程式 |
| (1)取少量样品于试管中,加蒸馏水配成溶液。在溶液中先加足量的HNO3溶液 | 有气泡产生 | |
| (2)再向(1)的溶液中加入过量的 | 产生白色沉淀 | |
| (3)取(2)静置后的上层清液少许,滴加AgNO3溶液 | ||
| 结论:碳酸钠粉末中混有硫酸钠和氯化钠 | ||
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】测定硫酸铜晶体(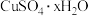 )中x值的实验过程如图:
)中x值的实验过程如图:

(1)第1次称量的是_______ 。
(2)灼烧时,当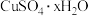 晶体的颜色由
晶体的颜色由_______ 完全变为_______ ,停止加热。
(3)必须要进行恒重操作的原因是_______ 。
(4)各次称量的数据如下表:
则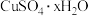 中的x=
中的x=_______ 。
(5)下列操作会导致x值偏高的是_______ (选填编号)
a.坩埚未干燥
b.加热过程中有晶体溅失
c.灼烧后坩埚在空气中冷却
d.恒重操作时,连续两次称量的结果相差不超过0.001g
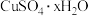 )中x值的实验过程如图:
)中x值的实验过程如图:
(1)第1次称量的是
(2)灼烧时,当
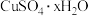 晶体的颜色由
晶体的颜色由(3)必须要进行恒重操作的原因是
(4)各次称量的数据如下表:
| 称量 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
| 质量(g) |  |  |  |  | 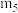 |
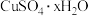 中的x=
中的x=(5)下列操作会导致x值偏高的是
a.坩埚未干燥
b.加热过程中有晶体溅失
c.灼烧后坩埚在空气中冷却
d.恒重操作时,连续两次称量的结果相差不超过0.001g
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】有一含有NaCl、Na2CO3.10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应前后CO2和H2O的质量,来确定该混合物中各组分的质量分数.
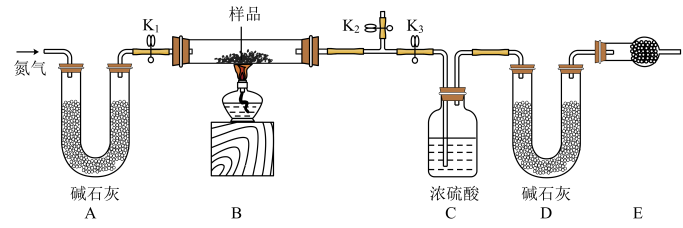
(1)实验步骤
①按上图(夹持仪器未画出)组装好实验装置后,首先进行的操作是_______________ 。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1 K2,关闭K3,缓慢鼓入氮气数分钟,其目的是_____________________ 。
④关闭活塞K1 K2,打开K3,点燃酒精灯加热,待不再产生气体为止。
⑤打开活塞K1,缓慢鼓入氮气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是__________________________ 。
②E处干燥管中盛放的药品是_________ ,其作用是_________________________ ,如果实验中没有该装置,则会导致测量结果NaHCO3的质量分数________ (填“偏大”、“偏小”或“无影响”)。
③若样品质量为wg,反应后C、D装置增加的质量分别为mg、ng,则混合物中Na2CO3.10H20的质量分数为________ (用含w、m、n的代数式表示)。

(1)实验步骤
①按上图(夹持仪器未画出)组装好实验装置后,首先进行的操作是
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1 K2,关闭K3,缓慢鼓入氮气数分钟,其目的是
④关闭活塞K1 K2,打开K3,点燃酒精灯加热,待不再产生气体为止。
⑤打开活塞K1,缓慢鼓入氮气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是
②E处干燥管中盛放的药品是
③若样品质量为wg,反应后C、D装置增加的质量分别为mg、ng,则混合物中Na2CO3.10H20的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】化学上常用燃烧法确定有机物的组成。下图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。

回答下列问题:
(1)A装置中盛放黑色固体分液漏斗盛放的物质是__________ (名称)
(2)C装置(燃烧管)中CuO的作用是将有机物中的某元素充分氧化生成___________ (化学式)
(3)写出E装置中所盛放试剂的名称__________ ,它的作用是吸收___________ (化学式)。
(4)若将B装置去掉会使__________ (元素名称)元素的含量偏__________ (大、小)
(5)若准确称取1.20 g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,E管质量增加1.76 g,D管质量增加0.72 g,则该有机物的最简式为____________ 。
(6)要确定该有机物的化学式,还需要测定______________ 。

回答下列问题:
(1)A装置中盛放黑色固体分液漏斗盛放的物质是
(2)C装置(燃烧管)中CuO的作用是将有机物中的某元素充分氧化生成
(3)写出E装置中所盛放试剂的名称
(4)若将B装置去掉会使
(5)若准确称取1.20 g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,E管质量增加1.76 g,D管质量增加0.72 g,则该有机物的最简式为
(6)要确定该有机物的化学式,还需要测定
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
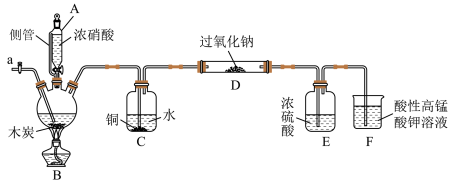
【推荐1】亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛。某兴趣小组利用如图装置(夹持及加热装置已省略)制备NaNO2。 、
、 ;
;
②酸性条件下,NO和 能与
能与 反应生成
反应生成 和
和 ;
;
③ 中铜过量。
中铜过量。
回答下列问题:
(1)仪器A侧管的作用是______________ 。
(2)C装置的作用为______________ ,C装置中涉及的化学反应为______________ (写一个化学方程式)。
(3)检验D中产物是否有亚硝酸钠的方法是______________ ,F装置的作用为______________ 。
(4)预测D中反应开始阶段,固体产物除NaNO2外,还含副产物Na2CO3和NaOH,为避免产生这些副产物,应在C、D装置间增加装置G,则G中盛放的试剂名称为_______ 。
(5)测定NaNO2的纯度:准确称取反应后的固体3.00g于烧杯中,加入煮沸并冷却的蒸馏水溶解,配成250mL的溶液;取出25.00mL于锥形瓶中,加入 的酸性高锰酸钾溶液至刚好反应完全,用去16.00mL的酸性KMnO4溶液。则测得固体中NaNO2的纯度为
的酸性高锰酸钾溶液至刚好反应完全,用去16.00mL的酸性KMnO4溶液。则测得固体中NaNO2的纯度为_______ 。
 、
、 ;
;②酸性条件下,NO和
 能与
能与 反应生成
反应生成 和
和 ;
;③
 中铜过量。
中铜过量。回答下列问题:
(1)仪器A侧管的作用是
(2)C装置的作用为
(3)检验D中产物是否有亚硝酸钠的方法是
(4)预测D中反应开始阶段,固体产物除NaNO2外,还含副产物Na2CO3和NaOH,为避免产生这些副产物,应在C、D装置间增加装置G,则G中盛放的试剂名称为
(5)测定NaNO2的纯度:准确称取反应后的固体3.00g于烧杯中,加入煮沸并冷却的蒸馏水溶解,配成250mL的溶液;取出25.00mL于锥形瓶中,加入
 的酸性高锰酸钾溶液至刚好反应完全,用去16.00mL的酸性KMnO4溶液。则测得固体中NaNO2的纯度为
的酸性高锰酸钾溶液至刚好反应完全,用去16.00mL的酸性KMnO4溶液。则测得固体中NaNO2的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验。
I.将NaOH 溶液与NH4Cl 溶液混合生成NH3·H2O,从而验证NaOH 的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理? 并说明理由:_____ 。
II.根据下图所示装置图回答以下问题。
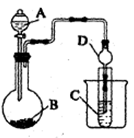
(1)利用如图装置可以验证非金属性的变化规律。图中A装置名称是_______ 。干燥管D的作用是___________ 。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫: 烧瓶中发生反应的离子方程式为_________ 。装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_________ 。
(3)若要用此装置证明酸性: HNO3>H2CO3>H2SiO3进而证明非金属性: N>C>Si,从以下所给物质中选出甲同学设计的实验所用到物质:
①稀HNO3溶液②稀盐酸 ③碳酸钙 ④Na2SiO3 溶液 ⑤SiO2
试剂A与C分别为______ (填序号);试管中发生反应的离子方程式为________ 。有同学认为此实验不能说明N、C、Si的非金属性强弱,你认为原因是________ 。
I.将NaOH 溶液与NH4Cl 溶液混合生成NH3·H2O,从而验证NaOH 的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理? 并说明理由:
II.根据下图所示装置图回答以下问题。

(1)利用如图装置可以验证非金属性的变化规律。图中A装置名称是
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫: 烧瓶中发生反应的离子方程式为
(3)若要用此装置证明酸性: HNO3>H2CO3>H2SiO3进而证明非金属性: N>C>Si,从以下所给物质中选出甲同学设计的实验所用到物质:
①稀HNO3溶液②稀盐酸 ③碳酸钙 ④Na2SiO3 溶液 ⑤SiO2
试剂A与C分别为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某实验小组,在学习和探究了教材中“硫酸铜晶体结晶水含量测定实验”后,进行了大胆尝试,设计并进行了含有不溶于水、也不溶于酸的杂质的硝酸铜晶体中结晶水含量的测定实验(杂质受热不分解)。实验过程及结果如下:
①称空坩埚的质量为5.023g→②称坩埚加样品的质量为8.483g→③灼烧、冷却→④称坩埚加固体的质量为7.943g→⑤灼烧、冷却→⑥称坩埚加固体的质量为7.943g→⑦加入过量稀硫酸溶液后微热→⑧过滤→⑨用蒸馏水多次洗涤滤渣→⑩烘干、称量得1.040g
回答下列问题:
(1)该实验小组在进行实验之前,应查找一个温度值,实验过程中严格控制加热温度不能超过此温度,你认为他们要查的温度应是___ 的温度。
(2)第⑥步称量之后,不需要再加热、冷却、称量的原因是___ 。
(3)第⑦步加稀硫酸的目的是___ ,但在步骤⑦之前应将坩埚内的残渣转移到___ (填仪器名称)中,并将坩埚用硫酸洗净,洗涤液一并倒入该仪器中。
(4)步骤⑨要确保已经将滤渣洗涤干净,方法是:取最后一次洗涤液,测该洗涤液的pH,当该洗涤液的pH=___ 时,即可认为洗涤干净。
(5)经过计算可知,此硝酸铜晶体的化学式是___ 。
(6)步骤⑨应在过滤器上进行,因此滤纸上会有少量滤渣,这会造成实验结果___ 。
A.偏大 B.偏小 C.无影响
①称空坩埚的质量为5.023g→②称坩埚加样品的质量为8.483g→③灼烧、冷却→④称坩埚加固体的质量为7.943g→⑤灼烧、冷却→⑥称坩埚加固体的质量为7.943g→⑦加入过量稀硫酸溶液后微热→⑧过滤→⑨用蒸馏水多次洗涤滤渣→⑩烘干、称量得1.040g
回答下列问题:
(1)该实验小组在进行实验之前,应查找一个温度值,实验过程中严格控制加热温度不能超过此温度,你认为他们要查的温度应是
(2)第⑥步称量之后,不需要再加热、冷却、称量的原因是
(3)第⑦步加稀硫酸的目的是
(4)步骤⑨要确保已经将滤渣洗涤干净,方法是:取最后一次洗涤液,测该洗涤液的pH,当该洗涤液的pH=
(5)经过计算可知,此硝酸铜晶体的化学式是
(6)步骤⑨应在过滤器上进行,因此滤纸上会有少量滤渣,这会造成实验结果
A.偏大 B.偏小 C.无影响
您最近一年使用:0次



