一定温度下在体积为5L的密闭容器中发生可逆反应.
(1)若某可逆反应的化学平衡常数表达式为:K=c(CO)×c(H2)/c(H2O)
(1)写出该反应的化学方程式:_______________ ;
(2)能判断该反应一定达到化学平衡状态的依据是____________ (填选项编号).
E.消耗n mol H2的同时消耗n mol CO
(Ⅱ)若该密闭容器中加入的是2molFe(s)与1mol H2O(g),t1秒时,H2的物质的量为0.20mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35mol.
(1)t1~t2这段时间内的化学反应速率v(H2)=__________ .
(2)若继续加入2mol Fe(s),则平衡____________ 移动(填“向正反应方向”、“向逆反应方向”或“不”),继续通入1mol H2O(g) 再次达到平衡后,H2的物质的量为____________ mol.
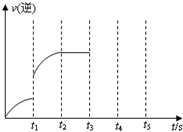
(3)该反应的逆反应速率随时间变化的关系如右图.t1时改变了某种条件,改变的条件可能是__________ (只要写其中一种答案即可)
(1)若某可逆反应的化学平衡常数表达式为:K=c(CO)×c(H2)/c(H2O)
(1)写出该反应的化学方程式:
(2)能判断该反应一定达到化学平衡状态的依据是
| A.容器中气体的平均相对分子质量不随时间而变化 |
| B.υ正(H2O)=υ逆(H2) |
| C.容器中气体的密度不随时间而变化 |
| D.容器中总的物质的量不随时间而变化 |
E.消耗n mol H2的同时消耗n mol CO
(Ⅱ)若该密闭容器中加入的是2molFe(s)与1mol H2O(g),t1秒时,H2的物质的量为0.20mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35mol.
(1)t1~t2这段时间内的化学反应速率v(H2)=
(2)若继续加入2mol Fe(s),则平衡
(3)该反应的逆反应速率随时间变化的关系如右图.t1时改变了某种条件,改变的条件可能是

更新时间:2016-12-09 01:22:05
|
【知识点】 化学平衡
相似题推荐
填空题
|
较难
(0.4)
名校
解题方法
【推荐1】(1)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO 2CO2+N2。反应能够自发进行,则反应的ΔH
2CO2+N2。反应能够自发进行,则反应的ΔH___ 0(填“>”“<”或“=”)。
(2)已知:反应Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g) FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
根据表中数据,计算反应CO2(g)+H2(g) CO(g)+H2O(g)的K。
CO(g)+H2O(g)的K。
①平衡常数的表达式K1=___ ;
②温度为973K时:K=___ ;(结果保留小数点后2位)
③反应CO2(g)+H2(g) CO(g)+H2O(g)是
CO(g)+H2O(g)是__ (填“吸热”或“放热”)反应。
(3)已知在温度为T时,CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为10%,则该反应
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为10%,则该反应___ (填“已经”或“没有”)达到平衡,原因是__ ;此时刻v正__ (填“>”或“<”)v逆。
 2CO2+N2。反应能够自发进行,则反应的ΔH
2CO2+N2。反应能够自发进行,则反应的ΔH(2)已知:反应Fe(s)+CO2(g)
 FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g) FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:| 温度/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1 173 | 2.15 | 1.67 |
根据表中数据,计算反应CO2(g)+H2(g)
 CO(g)+H2O(g)的K。
CO(g)+H2O(g)的K。①平衡常数的表达式K1=
②温度为973K时:K=
③反应CO2(g)+H2(g)
 CO(g)+H2O(g)是
CO(g)+H2O(g)是(3)已知在温度为T时,CO(g)+H2O(g)
 CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为10%,则该反应
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1mol·L-1,c始(H2O)=1mol·L-1,某时刻经测定CO的转化率为10%,则该反应
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g)CH3OH(g)+H2O(g),△H=﹣a kJ•mol﹣1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.

(1)能说明该反应已达平衡状态的是__________ .(选填编号)
(2)计算该温度下此反应的平衡常数K=_________ .(保留两位有效数字).若改变条件________ (填选项),可使K=1.
A增大压强 B增大反应物浓度 C降低温度 D升高温度 E加入催化剂
(3)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子浓度由大到小为:_________ .

(1)能说明该反应已达平衡状态的是
| A.CO2的体积分数在混合气体中保持不变 |
| B.混合气体的平均相对分子质量不随时间的变化而变化 |
| C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O |
| D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变 |
(2)计算该温度下此反应的平衡常数K=
A增大压强 B增大反应物浓度 C降低温度 D升高温度 E加入催化剂
(3)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子浓度由大到小为:
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】研究大气中含硫化合物(主要是SO2和H2S)的转化对环境保护具有重要意义。
(1)SO2的大量排放会引起严重的环境问题是_____________ ,潮湿条件下,写出大气中SO2转化为HSO3-的方程式___________________
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:

1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为___________________
(3)SO2时工业制硫酸的原料之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g) 2SO3(g),过程中测定的部分数据见下表:
2SO3(g),过程中测定的部分数据见下表:
①反应在0-4min内的平均速率为v(SO2)=_________ ;
②此温度下该反应的化学平衡常数K=__________ 。
③8min时,维持温度不变,往反应容器中再通入0.020molSO2(g),0.010molO2(g),重新达到平衡时混合气体中SO2的百分含量将___________ (填“减小”、“增大”或“不变”。)
(4)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化入右图所示:

①在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有__________________ 。
②一般来说,如果一个反应的平衡常数大于105,通常认为反应进行得较安全;相反,如果一个反应的平衡常数夏普与10-5,则认为这个反应很难进行。
已知常温下各物质的溶度积及电离平衡常数:
CuS:Ksp=6.3×10-36;H2S:Ka1=1.3×10-7,Ka2=7.1×10-15,
通过计算说明反应CuS(s)+2H+(aq)=Cu2+(aq)+H2S(aq)进行的程度_________
(1)SO2的大量排放会引起严重的环境问题是
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:

1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为
(3)SO2时工业制硫酸的原料之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)
 2SO3(g),过程中测定的部分数据见下表:
2SO3(g),过程中测定的部分数据见下表:| 时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.050 |
| 4 | 0.050 | 0.025 |
| 5 | 0.040 | |
| 8 | 0.020 |
①反应在0-4min内的平均速率为v(SO2)=
②此温度下该反应的化学平衡常数K=
③8min时,维持温度不变,往反应容器中再通入0.020molSO2(g),0.010molO2(g),重新达到平衡时混合气体中SO2的百分含量将
(4)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化入右图所示:

①在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有
②一般来说,如果一个反应的平衡常数大于105,通常认为反应进行得较安全;相反,如果一个反应的平衡常数夏普与10-5,则认为这个反应很难进行。
已知常温下各物质的溶度积及电离平衡常数:
CuS:Ksp=6.3×10-36;H2S:Ka1=1.3×10-7,Ka2=7.1×10-15,
通过计算说明反应CuS(s)+2H+(aq)=Cu2+(aq)+H2S(aq)进行的程度
您最近一年使用:0次



