接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)⇌△催化剂2SO3(g);△H=﹣190kJ•mol﹣1
(1)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.8g,则V(O2)=___ mol•L﹣1•min﹣1,计算此时化学平衡常数K1=____ .
(2)若温度不变,继续通入0.20mol SO2和0.10mol SO3,则平衡移动方向及原因是_________ ,达平衡后,化学平衡常数为K2,则K1、K2之间的关系为_____ (填“>”、“<”或“=”).
(3)有两只密闭容器A和B,A能保持恒容,B能保持恒压.起始时向容积相等的A、B中分别通入体积比为2:1的等量的SO2和O2,使之发生反应.则(填>、=、<;左、右;增大、减小、不变).
①达到平衡所需要的时间:t(A)______ t(B)
②平衡时,SO2的转化率:a(A)_____ a(B)
③达到平衡时,在两容器中分别通入等量的Ar气.B中的化学平衡向___ 反应方向移动,A中的化学反应速率___ .
(1)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.8g,则V(O2)=
(2)若温度不变,继续通入0.20mol SO2和0.10mol SO3,则平衡移动方向及原因是
(3)有两只密闭容器A和B,A能保持恒容,B能保持恒压.起始时向容积相等的A、B中分别通入体积比为2:1的等量的SO2和O2,使之发生反应.则(填>、=、<;左、右;增大、减小、不变).
①达到平衡所需要的时间:t(A)
②平衡时,SO2的转化率:a(A)
③达到平衡时,在两容器中分别通入等量的Ar气.B中的化学平衡向
更新时间:2016-12-09 03:05:49
|
【知识点】 化学平衡
相似题推荐
填空题
|
较难
(0.4)
【推荐1】在一个2L的密闭容器中充入一定量的SO3,发生反应:
2SO3(g) 2SO2(g)+O2(g)ΔH>0
2SO2(g)+O2(g)ΔH>0
其中SO3的变化如图所示:
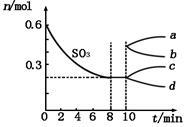
(1)用O2表示0~8min内该反应的平均速率v(O2)=____________ 。
(2)从10 min起,压缩容器为1 L,则SO3的变化曲线为_________ (填图象中的字母序号),平衡向_______ (填“正反应”或“逆反应”)方向移动,判断理由是 ___________________ 。
(3)计算该温度下的平衡常数K=____________ 升高温度,K值将_________ (填“增大”、“减小”或“不变”)。
2SO3(g)
 2SO2(g)+O2(g)ΔH>0
2SO2(g)+O2(g)ΔH>0其中SO3的变化如图所示:

(1)用O2表示0~8min内该反应的平均速率v(O2)=
(2)从10 min起,压缩容器为1 L,则SO3的变化曲线为
(3)计算该温度下的平衡常数K=
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】据报道,一定条件下 Fe2O3可被甲烷还原为“纳米级”的金属铁。其反应为: Fe2O3(s)+3CH4(g)  2Fe(s)+3CO(g)+6H2(g)
2Fe(s)+3CO(g)+6H2(g)
(1)反应在5 L的密闭容器中进行,2 min 后达到平衡,测得 Fe2O3在反应中质量减少 4.8 g。则该段时间内H2的平均反应速率为______________ ;
(2)将固定质量的 Fe2O3(s)和 CH4(g)置于恒温恒压容器中,在一定条件下反应,能表明该反应达到平衡状态的是______________ ;
(3)FeO 可用CO进行还原,已知:t℃时,FeO(s)+CO(g) Fe(s)+CO2(g) K=0.5
Fe(s)+CO2(g) K=0.5
若在 1 L密闭容器中加入0.04 mol FeO(s),并通入 x mol CO,t℃时反应达到平衡。此时FeO(s)的转化率为 50%,则x=______________ 。
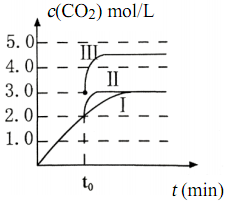
(4)在 3 L容积可变的密闭容器中发生反应:FeO(s)+CO(g) Fe(s)+CO2(g),c(CO2)随反应时间t变化如图中曲线I所示。若在t0时刻分别改变一个条件,曲线 I变为曲线II和曲线III。当曲线I变为曲线 II时,改变的条件是
Fe(s)+CO2(g),c(CO2)随反应时间t变化如图中曲线I所示。若在t0时刻分别改变一个条件,曲线 I变为曲线II和曲线III。当曲线I变为曲线 II时,改变的条件是______________ 。当通过改变压强使曲线 I变为曲线III时,曲线 III达到平衡时容器的体积为_________ L。
 2Fe(s)+3CO(g)+6H2(g)
2Fe(s)+3CO(g)+6H2(g) (1)反应在5 L的密闭容器中进行,2 min 后达到平衡,测得 Fe2O3在反应中质量减少 4.8 g。则该段时间内H2的平均反应速率为
(2)将固定质量的 Fe2O3(s)和 CH4(g)置于恒温恒压容器中,在一定条件下反应,能表明该反应达到平衡状态的是
| A.CH4的转化率等于 CO的产率 |
| B.混合气体的平均相对分子质量不变 |
| C.v 正(CO): v 逆(H2)=1 : 2 |
| D.固体的总质量不变 |
(3)FeO 可用CO进行还原,已知:t℃时,FeO(s)+CO(g)
 Fe(s)+CO2(g) K=0.5
Fe(s)+CO2(g) K=0.5 若在 1 L密闭容器中加入0.04 mol FeO(s),并通入 x mol CO,t℃时反应达到平衡。此时FeO(s)的转化率为 50%,则x=
(4)在 3 L容积可变的密闭容器中发生反应:FeO(s)+CO(g)
 Fe(s)+CO2(g),c(CO2)随反应时间t变化如图中曲线I所示。若在t0时刻分别改变一个条件,曲线 I变为曲线II和曲线III。当曲线I变为曲线 II时,改变的条件是
Fe(s)+CO2(g),c(CO2)随反应时间t变化如图中曲线I所示。若在t0时刻分别改变一个条件,曲线 I变为曲线II和曲线III。当曲线I变为曲线 II时,改变的条件是
您最近一年使用:0次
填空题
|
较难
(0.4)
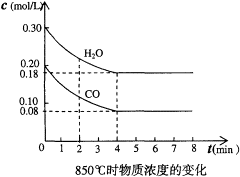
【推荐3】(1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g);△H<0。CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=
CO2(g)+H2(g);△H<0。CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=______________ mol/(L·min)
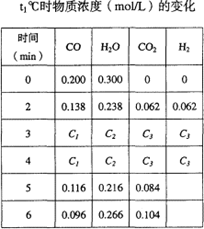
(2)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右上表。请回答:
①表中3min~4min之间反应处于____________ 状态;C1数值__________ 0.08mol/L(填大于、小于或等于)。
②反应在4min~5min问,平衡向逆方向移动,可能的原因是____________ (单选),表中5min—6min之间数值发生变化,可能的原因是____________ (单选)。
a、增加了水蒸气的量 b、降低温度 c、使用催化剂 d、增加氢气浓度
 CO2(g)+H2(g);△H<0。CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=
CO2(g)+H2(g);△H<0。CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=

(2)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右上表。请回答:
①表中3min~4min之间反应处于
②反应在4min~5min问,平衡向逆方向移动,可能的原因是
a、增加了水蒸气的量 b、降低温度 c、使用催化剂 d、增加氢气浓度
您最近一年使用:0次



