已知:25℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25℃时,取10mL 0.1mol/L醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1000mL,溶液pH数值范围为__________ ,溶液中
_____________ (填“增大”“减小”“不变”或“不能确定”)。
②25℃时,0.1mol/L氨水(NH3·H2O溶液)的pH=______ 。用pH试纸测定该氨水pH的操作方法为____________________ 。
③氨水(NH3·H2O溶液)电离平衡常数表达式Kb=___________ ,25℃时,氨水电离平衡常数约为_________ 。
(2)25℃时,现向10mL0.1mol/L氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中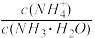
________ (填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
当加入CH3COOH溶液体积为10mL时,混合溶液的pH__________ 7(填“>”“=”“<”)。
(3)某温度下,向V1mL0.1mol/LNaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。
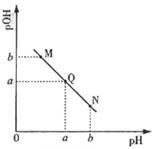
①图中M、Q、N三点所示溶液中水的电离程度最大的是___________ (填字母)。
②若Q点时滴加醋酸溶液体积为V2mL,则V1________ V2(填“>”“=”“<”)。
③若在曲线上某一点W时加入醋酸的体积为V1 mL,则W点应位于图中曲线上Q点的_______ (填“上方”“下方”),此时溶液中离子浓度由大到小的顺序为________________ 。
(1)25℃时,取10mL 0.1mol/L醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1000mL,溶液pH数值范围为

②25℃时,0.1mol/L氨水(NH3·H2O溶液)的pH=
③氨水(NH3·H2O溶液)电离平衡常数表达式Kb=
(2)25℃时,现向10mL0.1mol/L氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中
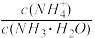
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
当加入CH3COOH溶液体积为10mL时,混合溶液的pH
(3)某温度下,向V1mL0.1mol/LNaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。

①图中M、Q、N三点所示溶液中水的电离程度最大的是
②若Q点时滴加醋酸溶液体积为V2mL,则V1
③若在曲线上某一点W时加入醋酸的体积为V1 mL,则W点应位于图中曲线上Q点的
更新时间:2016-12-09 11:20:12
|
相似题推荐
填空题
|
较难
(0.4)
【推荐1】人们日常生产生活与化学有着紧密的联系。
(1)现有常温下pH=2的盐酸(甲)和pH=2的醋酸溶液(乙),请根据下列操作回答:
①常温下, 溶液加水稀释,下列数值一定变小的是
溶液加水稀释,下列数值一定变小的是___________ (填字母)。
A. c(H+) B. C.
C. 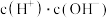 D.
D. 
②取10mL乙溶液,加入少量无水CH3COONa固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中 的值将
的值将___________ (填“增大”“减小”或“无法确定”)。
③相同条件下,取等体积的甲、乙两溶液,分别与0.1mol/LNaOH溶液反应,消耗NaOH溶液的体积(甲)___________ (乙)(填“>”“<”或“=”)。
(2)某温度下, 测得(0.00lmol/L的HCl溶液中,水电离出的c(H+)=1.0×10-9mol/L,此温度下,将VaLpH=4 HCl溶液和VbLpH=9的Ba(OH)2溶液混合均匀,测得溶液的pH=7,则Va:Vb=___________ 。
(3)已知:在25℃,有关弱电解质的电离平衡常数如下表有下表:
①将SO2通入该氨水中,当c(OH-)降至  时,溶液中的
时,溶液中的 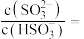
___________
②下列微粒在溶液中不能大量共存的是___________ 。
a. 、
、 B. ClO-、
B. ClO-、 C.
C.  、
、 D. HClO、
D. HClO、 
(1)现有常温下pH=2的盐酸(甲)和pH=2的醋酸溶液(乙),请根据下列操作回答:
①常温下,
 溶液加水稀释,下列数值一定变小的是
溶液加水稀释,下列数值一定变小的是A. c(H+) B.
 C.
C. 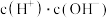 D.
D. 
②取10mL乙溶液,加入少量无水CH3COONa固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中
 的值将
的值将③相同条件下,取等体积的甲、乙两溶液,分别与0.1mol/LNaOH溶液反应,消耗NaOH溶液的体积(甲)
(2)某温度下, 测得(0.00lmol/L的HCl溶液中,水电离出的c(H+)=1.0×10-9mol/L,此温度下,将VaLpH=4 HCl溶液和VbLpH=9的Ba(OH)2溶液混合均匀,测得溶液的pH=7,则Va:Vb=
(3)已知:在25℃,有关弱电解质的电离平衡常数如下表有下表:
| 弱电解质 | 电离常数(Ka) | |
| NH3·H2O | Kb=1.8×10-5 | |
| HClO | Kₐ=4.7×10-8 | |
| H2CO3 | Ka1=4.2×10-7 | Ka2=5.6×10-11 |
| H2SO3 | Ka1=1.54×10-2 | Ka2=1.02×10-7 |
 时,溶液中的
时,溶液中的 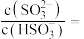
②下列微粒在溶液中不能大量共存的是
a.
 、
、 B. ClO-、
B. ClO-、 C.
C.  、
、 D. HClO、
D. HClO、 
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸:______ 。
(2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2 mol·L-1?______ (选填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是______ 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是______ 酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是______ 。
(4)写出丁组实验所得混合溶液中下列算式的精确结果(不能做近似计算)。
c(Na+)-c(A-)=______ mol·L-1;
c(OH-)-c(HA)=______ mol·L-1.
| 实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸:
(2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2 mol·L-1?
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是
(4)写出丁组实验所得混合溶液中下列算式的精确结果(不能做近似计算)。
c(Na+)-c(A-)=
c(OH-)-c(HA)=
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】下表是不同温度下水的离子积常数:
试回答以下问题:
(1)T2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=__________。此溶液中各种离子的浓度由大到小的顺序是________________ ____。
(2)25℃时,用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶液(设1滴为0.05mL),则①和②溶液中c(OH-)之比是 。
(3)25℃时,0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11。将两种溶液等体积混合,可能发生的现象____________________________________,其主要原因是(用离子方程式表示) 。
(4)已知25℃时:
用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解。当加碱调节pH为 时,铁刚好完全沉淀而锌开始沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全;假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果和原因是 。(lg2=0.3 lg3=0.48)
| 温度/℃ | 25 | T2 |
| 水的离子积常数 | 1×10-14 | 1×10-12 |
试回答以下问题:
(1)T2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=__________。此溶液中各种离子的浓度由大到小的顺序是________________ ____。
(2)25℃时,用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶液(设1滴为0.05mL),则①和②溶液中c(OH-)之比是 。
(3)25℃时,0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11。将两种溶液等体积混合,可能发生的现象____________________________________,其主要原因是(用离子方程式表示) 。
(4)已知25℃时:
| 难溶物 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 |
| Ksp | 8.0×10-16 | 8.0×10-38 | 1.0×10-17 |
用废电池的锌皮制备ZnSO4·7H2O的过程中,需去除少量杂质铁,其方法是:加稀硫酸和H2O2溶解。当加碱调节pH为 时,铁刚好完全沉淀而锌开始沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全;假定Zn2+浓度为0.1mol/L)。若上述过程不加H2O2后果和原因是 。(lg2=0.3 lg3=0.48)
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)═CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ/mol
CH3CH=CH2(g)═CH4(g)+HC≡CH(g)△H2=+32.4kJ/mol
则相同条件下,反应C3H8(g)═CH3CH=CH2(g)+H2(g)的△H=_____ kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为______________________________ ;放电时CO32-移向电池的_______ (填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH =5.60,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二步电离,则H2CO3 HCO3-+H+的平衡常数K1=
HCO3-+H+的平衡常数K1=______________ mol/L。(已知10-5.60=2.5×10-6)
(4)常温下,0.1 mol/L NaHCO3溶液的pH大于8,则溶液中c(H2CO3)__ c(CO32-)(填“>”、“=”或“<”),原因是__________________________ (用简要的文字明)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)═CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ/mol
CH3CH=CH2(g)═CH4(g)+HC≡CH(g)△H2=+32.4kJ/mol
则相同条件下,反应C3H8(g)═CH3CH=CH2(g)+H2(g)的△H=
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH =5.60,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二步电离,则H2CO3
 HCO3-+H+的平衡常数K1=
HCO3-+H+的平衡常数K1=(4)常温下,0.1 mol/L NaHCO3溶液的pH大于8,则溶液中c(H2CO3)
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】25 ℃时,几种弱酸的电离常数如下:
(1)根据上表数据填空:
①物质的量浓度相同的四种酸,其pH由大到小的顺序是___________ (用化学式填写)。
②分别向等体积、相同pH的HCl溶液和CH3COOH溶液中加入足量的Zn粉,反应刚开始时产生H2的速率:v(HCl)______ v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸_______ m(H2)醋酸。
③将0.2 mol/L HCN溶液与0.1 mol/L Na2CO3溶液等体积混合,发生反应的化学方程式为___________________________ 。
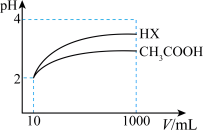
(2)体积均为10 mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程中溶液pH变化如图所示。稀释后,HX溶液中水电离的c(H+)___ 醋酸溶液中水电离的c(H+) ;电离常数Ka(HX)___ Ka(CH3COOH)(填“>”、“=”或“<”)。
(3)CO32- 、 NO2- 、CN-、CH3COO-结合H+的能力由强到弱的顺序为_______________________ (用离子符号表示)
弱酸化学式 | HNO2 | CH3COOH | HCN | H2CO3 |
电离常数 | 5.1×10-4 | 1.8×10-5 | 6.2×10-10 | K1=4.4×10-7K2=4.7×10-11 |
①物质的量浓度相同的四种酸,其pH由大到小的顺序是
②分别向等体积、相同pH的HCl溶液和CH3COOH溶液中加入足量的Zn粉,反应刚开始时产生H2的速率:v(HCl)
③将0.2 mol/L HCN溶液与0.1 mol/L Na2CO3溶液等体积混合,发生反应的化学方程式为
(2)体积均为10 mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程中溶液pH变化如图所示。稀释后,HX溶液中水电离的c(H+)

(3)CO32- 、 NO2- 、CN-、CH3COO-结合H+的能力由强到弱的顺序为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】醋酸是一种常见的弱酸,回答下列问题:
(1)下列哪些措施能够使醋酸溶液中 增大___________。
增大___________。
(2)向100mL0.1mol·L-1的醋酸中加入VmL0.1mol·L-1的NaOH溶液完全反应后,溶液呈中性,则V___________ 100mL(填“>”,“<”或“=”)。
(3)在CH3COOH与CH3COONa的混合溶液中,测得某一时刻混合溶液中: =18,则此时溶液的pH=
=18,则此时溶液的pH=___________ 。(已知:CH3COOH的电离常数Ka=1.9×10-5)
(4)常温下,将amol·L-1的醋酸与bmol·L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=___________ (用含a和b的代数式表示)。
(5)某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室的标准NaOH溶液对其进行滴定实验以测定它的准确浓度,完全反应时所得溶液的pH大约为9。
①该实验应选用___________ 作指示剂。
②为减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为cmol/L,三次实验结果记录如下:
从表可以看出,第一次实验中记录消耗NaOH溶液的体积明显少于后两次,其原因可能是___________ 。
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积。
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液。
C.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定。
D.锥形瓶用蒸馏水洗过后未干燥。
E.盛装氢氧化钠溶液的滴定管用蒸馏水洗过,未用氢氧化钠溶液润洗。
③根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):c(CH3COOH)=___________ mol/L。
(1)下列哪些措施能够使醋酸溶液中
 增大___________。
增大___________。| A.升温 | B.通入HCl气体 | C.加入NaHSO4固体 | D.加入NaOH固体 |
(3)在CH3COOH与CH3COONa的混合溶液中,测得某一时刻混合溶液中:
 =18,则此时溶液的pH=
=18,则此时溶液的pH=(4)常温下,将amol·L-1的醋酸与bmol·L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=
(5)某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室的标准NaOH溶液对其进行滴定实验以测定它的准确浓度,完全反应时所得溶液的pH大约为9。
①该实验应选用
②为减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为cmol/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 24.72 | 25.35 | 25.30 |
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积。
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液。
C.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定。
D.锥形瓶用蒸馏水洗过后未干燥。
E.盛装氢氧化钠溶液的滴定管用蒸馏水洗过,未用氢氧化钠溶液润洗。
③根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):c(CH3COOH)=
您最近一年使用:0次



