物质结构与性质》从原子、分子水平上帮助我们认识物质构成的规律:以微粒之间不同的作用力为线索,研究不同类型物质的有关性质:从物质结构决定性质的视角预测物质的有关性质。
(1)下列说法正确的是_______ (填序号)。
A.元素电负性由大到小的顺序为O>N>C
B.一个乙烯分子含2个π键和4个σ键
C.氯化钠和氯化铯晶体中氯离子的配位数相同
D.第一电离能的大小为Al>Mg>Na
(2)根据等电子体原理,羰基硫(OCS)分子的结构式为_______ ;光气(COCl2)各原子最外层都满 足8电子稳定结构,则光气分子的空间构型为_______ (用文字描述);
(3)Cu 2+基态的电子排布式为_______ ;向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4晶体,硫酸根离子中硫原子的杂化方式为_______ ;不考虑空间构型,其内界结构可用示意图表示为_______ 。
(1)下列说法正确的是

A.元素电负性由大到小的顺序为O>N>C
B.一个乙烯分子含2个π键和4个σ键
C.氯化钠和氯化铯晶体中氯离子的配位数相同
D.第一电离能的大小为Al>Mg>Na
(2)根据等电子体原理,羰基硫(OCS)分子的结构式为
(3)Cu 2+基态的电子排布式为
2016·江苏苏州·一模 查看更多[1]
更新时间:2016-12-09 06:36:23
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子,E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。
请回答下列问题:
(1)请写出D基态的价层电子排布图_________
(2)下列说法错误的是______
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:C<N<O
C.N2与CO为等电子体,结构相似,化学性质相似
D.稳定性:H2O>H2S,由于水分子间存在氢键
(3)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的特点。向F的硫酸盐溶液这通入过量的C与A形成的气体x可生成[F(x)4]2-,该离子的结构式为______ (用元素符号表示)
(4)某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图2所示的离子,该离子中碳原子的杂化方式是______ 。
(5)已知(BC)2是直线型分子,并有对称性,且分子中每个原子最外层都达到8电子稳定结构,则(BC)2中σ键和π键的个数比为_________ 。
(6)C元素最高价含氧酸与硫酸酸性强度相近,原因是______ 。
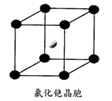
(7)B单质的一种的晶体结构如图1所示,则一个晶胞这所含B原子数为____ ;其中原子坐标参数a为(0,0,0),b为(1/2,1/2,0),则c点原子的坐标参数为_______ 。
(8)D与F形成离子个数比为1: 1的化合物,晶胞与NaCl类似,D离子的配位数是_______ ;设D离子的半径为a pm, F离子的半径为b pm,求该晶胞的空间利用率为________ 。(列出计算式即可)
请回答下列问题:
(1)请写出D基态的价层电子排布图
(2)下列说法错误的是
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:C<N<O
C.N2与CO为等电子体,结构相似,化学性质相似
D.稳定性:H2O>H2S,由于水分子间存在氢键
(3)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的特点。向F的硫酸盐溶液这通入过量的C与A形成的气体x可生成[F(x)4]2-,该离子的结构式为
(4)某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成图2所示的离子,该离子中碳原子的杂化方式是

(5)已知(BC)2是直线型分子,并有对称性,且分子中每个原子最外层都达到8电子稳定结构,则(BC)2中σ键和π键的个数比为
(6)C元素最高价含氧酸与硫酸酸性强度相近,原因是
(7)B单质的一种的晶体结构如图1所示,则一个晶胞这所含B原子数为
(8)D与F形成离子个数比为1: 1的化合物,晶胞与NaCl类似,D离子的配位数是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】I下列有关晶体结构或性质的描述中正确的是( )
A.冰中存在极性键,分子间作用力和氢键
B.因金属性K>Na,故金属钾的熔点高于金属钠
C.各1mol的金刚石与石墨晶体中所含的C-C键的数目相同
D.氧化镁的晶格能大于氯化钠,故其熔点高于氯化钠。
Ⅱ某类金属合金也称为金属互化物,比如:Cu9Al4,Cu5Zn8等。请问答下列问题:
(1)基态锌原子的电子排布式为_______________________________ ;已知金属锌可溶于浓的烧碱溶液生成可溶性的四羟基合锌酸钠Na2[Zn(OH)4]与氢气,该反应的离子方程式为:___________________________________________________ ;已知四羟基合锌酸离子空间构型是正四面体型,则Zn2+的杂化方式为__________________ 。
(2)铜与类卤素(SCN)2反应可生成Cu(SCN)2,1mol (SCN)2分子中含有__________ 个σ键。类卤素(SCN)2对应的酸有两种:A—硫氰酸(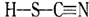 )和B-异硫氰酸(
)和B-异硫氰酸(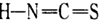 ),两者互为:
),两者互为:_________ ;其中熔点较高的是___________ (填代号),原因是________________________________ 。
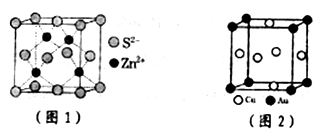
(3)已知硫化锌晶胞如图1所示,则其中Zn2+的配位数是____________ ;S2-采取的堆积方式为____________________ 。(填A1或A2或A3)
(4)已知铜与金形成的金属互化物的结构如图2所示,其立方晶胞的棱长为a纳米(nm),该金属互化物的密度为_______ g/cm3(用含a,NA的代数式表示)。
A.冰中存在极性键,分子间作用力和氢键
B.因金属性K>Na,故金属钾的熔点高于金属钠
C.各1mol的金刚石与石墨晶体中所含的C-C键的数目相同
D.氧化镁的晶格能大于氯化钠,故其熔点高于氯化钠。
Ⅱ某类金属合金也称为金属互化物,比如:Cu9Al4,Cu5Zn8等。请问答下列问题:

(1)基态锌原子的电子排布式为
(2)铜与类卤素(SCN)2反应可生成Cu(SCN)2,1mol (SCN)2分子中含有
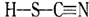 )和B-异硫氰酸(
)和B-异硫氰酸(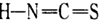 ),两者互为:
),两者互为:(3)已知硫化锌晶胞如图1所示,则其中Zn2+的配位数是
(4)已知铜与金形成的金属互化物的结构如图2所示,其立方晶胞的棱长为a纳米(nm),该金属互化物的密度为
您最近一年使用:0次
填空题
|
适中
(0.65)
真题
名校
【推荐3】氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是_______ 。
a.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
b.Ca2+与F-间仅存在静电吸引作用
c.阴阳离子比为2:1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是__________________________ (用离子方程式表示)。 已知AlF63-在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为___________ ,其中氧原子的杂化方式为_________ 。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)=2ClF3(g) △H=-313kJ·mol-1,F-F键键能为159kJ·mol-1,Cl-Cl键键能为242kJ·mol-1,则ClF3中Cl-F键的平均键能为_________ kJ·mol-1。ClF3的熔、沸点比BrF3的________ (填“高”或“低”)。
(1)下列关于CaF2的表述正确的是
a.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
b.Ca2+与F-间仅存在静电吸引作用
c.阴阳离子比为2:1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)=2ClF3(g) △H=-313kJ·mol-1,F-F键键能为159kJ·mol-1,Cl-Cl键键能为242kJ·mol-1,则ClF3中Cl-F键的平均键能为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】下表是某些短周期元素的电负性:
(1)通过分析电负性变化规律,确定N最接近的电负性范围:___ <N<___ 。
(2)推测电负性与原子半径的关系:________ 。
(3)某有机化合物的结构简式为CH3CH2NH2,其中C—N键中,你认为共用电子对偏向于__ (填“C”或“N”)一方。
(4)试推断:AlBr3中化学键的类型是____ 。
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性 | 1.0 | 1.5 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
(1)通过分析电负性变化规律,确定N最接近的电负性范围:
(2)推测电负性与原子半径的关系:
(3)某有机化合物的结构简式为CH3CH2NH2,其中C—N键中,你认为共用电子对偏向于
(4)试推断:AlBr3中化学键的类型是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】2022年央视春晚的舞蹈剧《只此青绿》灵感来自北宋卷轴画《千里江山图》,该卷长11.91米,颜色绚丽,由石绿、雌黄、赭石、砗磲、朱砂等颜料绘制而成。颜料中经常含有铜、锌、钛、铁等元素。
(1)写出Zn所在元素周期表中的分区是_______ 区;基态Ti原子的价电子排布式_______ ;基态 核外电子的空间运动状态有
核外电子的空间运动状态有_______ 种,基态铁原子处在最高能层的电子的电子云形状为_______ 。
(2) 、
、 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为_______ 。
(3)一种新研发出的铁磁性材料M的分子结构如图所示。
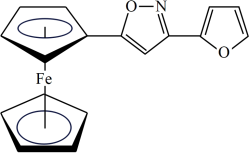
①M分子中C、N、O三种元素的电负性由大到小的顺序为_______ 。
②M分子中 共提供6个杂化轨道,则铁原子可能的杂化方式为
共提供6个杂化轨道,则铁原子可能的杂化方式为_______ (填序号)。
A. B.
B. C.
C. D.
D.
(1)写出Zn所在元素周期表中的分区是
 核外电子的空间运动状态有
核外电子的空间运动状态有(2)
 、
、 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为(3)一种新研发出的铁磁性材料M的分子结构如图所示。

①M分子中C、N、O三种元素的电负性由大到小的顺序为
②M分子中
 共提供6个杂化轨道,则铁原子可能的杂化方式为
共提供6个杂化轨道,则铁原子可能的杂化方式为A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】钴、铁、镓、砷的单质及其化合物在生产生活中有重要的应用。回答下列问题:
(1)写出 As 的基态原子的电子排布式_____ 。
(2)将 NaNO3 和 Na2O 在一定条件下反应得到一种白色晶体,已知其中阴离子与 SO42-互为等 电子体,则该阴离子的化学式是_____ 。
(3)Fe3+、Co3+与 N3-、CN-等可形成络合离子。
①K3[Fe(CN)6]可用于检验 Fe2+,配体 CN-中碳原子杂化轨道类型为_____ 。
②[Co(N3)(NH3)5]SO4 中 Co 的配位数为_____ ,其配离子中含有的化学键类型为___ (填离子键、共价键、配位键)。
(1)写出 As 的基态原子的电子排布式
(2)将 NaNO3 和 Na2O 在一定条件下反应得到一种白色晶体,已知其中阴离子与 SO42-互为等 电子体,则该阴离子的化学式是
(3)Fe3+、Co3+与 N3-、CN-等可形成络合离子。
①K3[Fe(CN)6]可用于检验 Fe2+,配体 CN-中碳原子杂化轨道类型为
②[Co(N3)(NH3)5]SO4 中 Co 的配位数为
您最近一年使用:0次
【推荐2】(1)①下列物质的分子与 分子的空间结构最相似的是
分子的空间结构最相似的是___________ (填序号)。
A. B.
B. C.
C. D.
D.
② 分子是否为极性分子?
分子是否为极性分子?___________ (填“是”或“否”)。
(2)溴化碘(IBr)的化学性质类似于卤素单质,溴化碘的电子式是___________ ,它是由___________ 键形成的___________ 分子。
 分子的空间结构最相似的是
分子的空间结构最相似的是A.
 B.
B. C.
C. D.
D.
②
 分子是否为极性分子?
分子是否为极性分子?(2)溴化碘(IBr)的化学性质类似于卤素单质,溴化碘的电子式是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】氮族元素在化学领域具有重要的地位。请回答下列问题:
(1)基态氮原子的核外电子排布式为___________ 。
(2)在PH3分子中,中心原子的杂化方式为___________ ,PH3的空间结构为___________ 。
(3)向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,向该溶液中加入一定量的乙醇,析出[Cu(NH3)4]SO4·H2O固体。
①[Cu(NH3)4]SO4·H2O晶体中不存在的作用力是___________ (填字母)。
A.离子键 B.共价键 C.氢键 D.金属键 E.配位键
②将[Cu(NH3)4]SO4配合物溶于水,电离方程式为___________ 。
(1)基态氮原子的核外电子排布式为
(2)在PH3分子中,中心原子的杂化方式为
(3)向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入氨水沉淀溶解,得到深蓝色透明溶液,向该溶液中加入一定量的乙醇,析出[Cu(NH3)4]SO4·H2O固体。
①[Cu(NH3)4]SO4·H2O晶体中不存在的作用力是
A.离子键 B.共价键 C.氢键 D.金属键 E.配位键
②将[Cu(NH3)4]SO4配合物溶于水,电离方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】请按要求作答。
(1)在配合物 中,
中,___________ 是中心离子; 的结构式为
的结构式为___________ ,与氢氧化钠溶液共热能否产生氨气?如果可以请写出化学方程式,如果不可以请说明理由___________ 。
(2)请根据官能团的不同对下列有机物进行分类:___________ ;酮:___________ ;醛:___________ (填序号)。
Ⅱ.④的官能团名称为___________ ,⑥的官能团名称为___________ ,⑦的官能团名称为___________ 。
(3)请写出有机物①与金属钠反应的化学方程式___________ 。
(1)在配合物
 中,
中, 的结构式为
的结构式为(2)请根据官能团的不同对下列有机物进行分类:
① ②
② ③
③ ④
④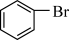 ⑤
⑤ ⑥
⑥ ⑦
⑦
Ⅱ.④的官能团名称为
(3)请写出有机物①与金属钠反应的化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】某同学所做的有关铜元素的实验流程如图:
单质 棕色的烟
棕色的烟 绿色溶液
绿色溶液 蓝色沉淀
蓝色沉淀 深蓝色溶液
深蓝色溶液
(1)Cu原子的价层电子的轨道表达式(电子排布图)为____ 。
(2)向深蓝色溶液中加入适量乙醇,会析出深蓝色晶体,该晶体中存在的化学键的类型有____ 。该深蓝色配离子空间构型为_____ 。
(3)写出反应④的离子方程式____ 。
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为____ 。
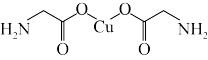
(5)N元素的最简单氢化物易溶于水的原因是_____ 。
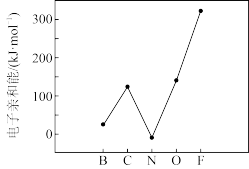
(6)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是_____ ;氮元素的E1呈现异常的原因是_____ 。
(7)NF3与NH3的空间构型相同,但NF3不易与Cu2+等形成配位键,其原因是:_____ 。
单质
 棕色的烟
棕色的烟 绿色溶液
绿色溶液 蓝色沉淀
蓝色沉淀 深蓝色溶液
深蓝色溶液(1)Cu原子的价层电子的轨道表达式(电子排布图)为
(2)向深蓝色溶液中加入适量乙醇,会析出深蓝色晶体,该晶体中存在的化学键的类型有
(3)写出反应④的离子方程式
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为

(5)N元素的最简单氢化物易溶于水的原因是
(6)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是

(7)NF3与NH3的空间构型相同,但NF3不易与Cu2+等形成配位键,其原因是:
您最近一年使用:0次