Fe2O3和Cu2O都是砖红色粉末,课外小组通过实验探究某砖红色粉末是Fe2O3、Cu2O或者是二者混合物。探究过程如下:
查阅资料:Cu2O是碱性氧化物,Cu2O与H+反应生成的Cu+不稳定,立即转化成Cu2+和Cu。提出假设:假设1:红色粉末是Fe2O3;假设2:红色粉末是Cu2O;假设3:红色粉末为Fe2O3、Cu2O的混合物
设计探究实验:
取少量粉末,向其加入足量稀盐酸在所得溶液中滴加苯酚溶液
(1)若假设1成立,则实验现象是__________ 。
(2)若滴加苯酚后溶液不变紫色,则证明原固体粉末不含Fe2O3。你认为结论是否合理______ (填“合理”或“不合理”),简述理由___________ 。
(3)若固体粉末完全溶解无固体存在,滴加苯酚时溶液不变紫色,证明原固体粉末是_____ ,相关的离子方程式为______________ 。(任写其中一个)
查阅资料:Cu2O是碱性氧化物,Cu2O与H+反应生成的Cu+不稳定,立即转化成Cu2+和Cu。提出假设:假设1:红色粉末是Fe2O3;假设2:红色粉末是Cu2O;假设3:红色粉末为Fe2O3、Cu2O的混合物
设计探究实验:
取少量粉末,向其加入足量稀盐酸在所得溶液中滴加苯酚溶液
(1)若假设1成立,则实验现象是
(2)若滴加苯酚后溶液不变紫色,则证明原固体粉末不含Fe2O3。你认为结论是否合理
(3)若固体粉末完全溶解无固体存在,滴加苯酚时溶液不变紫色,证明原固体粉末是
2010·海南·一模 查看更多[1]
(已下线)2010年海南省嘉积中学高三上学期教学质量监测(一)化学
更新时间:2016-12-09 00:57:47
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】硫酸亚铁是重要的化工原料,以硫酸亚铁为原料可以获得下列物质:

(1)保存硫酸亚铁溶液时,为防止FeSO4溶液氧化变质,常在硫酸亚铁溶液加入少量________ 。检验第①步反应后溶液FeSO4已被完全氧化的操作是___________ 。
(2)制备Fe4(OH)2(SO4)5:第①步反应的离子方程式为___________ 。
(3)氧化共沉淀法制备纳米Fe3O4:
I.氧化Fe2+生成FeO(OH):将FeSO4溶液用NaOH溶液调节pH至a,再加入H2O2溶液,立即得到FeO(OH)红棕色悬浊液。上述反应完成后,测得a值与FeO(OH)产率及其生成后溶液pH的关系,结果如下:
(常温下:pH=7为中性;pH>7呈碱性,pH越大碱性越强;pH<7呈酸性,pH越小酸性越强)
经检验:当a=7时,产物中存在大量Fe2O3.对Fe2O3的产生提出两种假设:
i.反应过程中溶液酸性增强,导致FeO(OH)向Fe2O3转化;
ii.溶液中存在少量Fe2+,导致FeO(OH)向Fe2O3转化。
①经分析,假设ⅰ不成立的实验依据是___________ 。(结合反应方程式解释)
②如果假设ii是成立的,则随a值增大FeO(OH)产量增大的原因是___________ 。
Ⅱ.FeO(OH)与Fe2+共沉淀:共沉淀时的反应条件对产物纯度和产率的影响极大。已知N= ,其它条件一定时,测得纳米Fe3O4的产率随N的变化曲线如图所示:
,其它条件一定时,测得纳米Fe3O4的产率随N的变化曲线如图所示:

③经理论分析,N=2共沉淀时纳米Fe3O4产率应最高,事实并非如此的可能原因是___________ 。

(1)保存硫酸亚铁溶液时,为防止FeSO4溶液氧化变质,常在硫酸亚铁溶液加入少量
(2)制备Fe4(OH)2(SO4)5:第①步反应的离子方程式为
(3)氧化共沉淀法制备纳米Fe3O4:
I.氧化Fe2+生成FeO(OH):将FeSO4溶液用NaOH溶液调节pH至a,再加入H2O2溶液,立即得到FeO(OH)红棕色悬浊液。上述反应完成后,测得a值与FeO(OH)产率及其生成后溶液pH的关系,结果如下:
(常温下:pH=7为中性;pH>7呈碱性,pH越大碱性越强;pH<7呈酸性,pH越小酸性越强)
| a | 7.0 | 8.0 | 9.0 |
| FeO(OH)的产量 | <50% | 95% | >95% |
| FeO(OH)生成后溶液pH | 接近4 | 接近4 | 接近4 |
i.反应过程中溶液酸性增强,导致FeO(OH)向Fe2O3转化;
ii.溶液中存在少量Fe2+,导致FeO(OH)向Fe2O3转化。
①经分析,假设ⅰ不成立的实验依据是
②如果假设ii是成立的,则随a值增大FeO(OH)产量增大的原因是
Ⅱ.FeO(OH)与Fe2+共沉淀:共沉淀时的反应条件对产物纯度和产率的影响极大。已知N=
 ,其它条件一定时,测得纳米Fe3O4的产率随N的变化曲线如图所示:
,其它条件一定时,测得纳米Fe3O4的产率随N的变化曲线如图所示:
③经理论分析,N=2共沉淀时纳米Fe3O4产率应最高,事实并非如此的可能原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】FeO( OH)在高档涂料、油墨的生产中有着重要的用途。某化工厂以氧化铁废料(含少量的 FeO、SiO2)为原料制备FeO(OH)的流程如图所示:

请回答下列有关问题:
(1)FeO( OH)中铁元素的化合价为____ ,滤液3中溶质的主要成分是______
(2)酸浸时主要反应的离子方程式为______ ,试剂a最好是_____ 。
(3)通入空气的反应中,消耗的氧化剂与还原剂的物质的量之比为______ 。操作X为向滤液2中加入乙醇而不是蒸发浓缩、冷却结晶,这说明绿矾晶体在乙醇中的溶解度_____ (填“大”或“小”)。
若操作X为蒸发浓缩、冷却结晶,可能造成的不良后果是_____ 。

请回答下列有关问题:
(1)FeO( OH)中铁元素的化合价为
(2)酸浸时主要反应的离子方程式为
(3)通入空气的反应中,消耗的氧化剂与还原剂的物质的量之比为
若操作X为蒸发浓缩、冷却结晶,可能造成的不良后果是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某废料铁泥主要成分为Fe2O3、FeO和Fe,其他杂质不与硫酸反应。现取wg废料铁泥提取 ,设计实验流程如下:
,设计实验流程如下:
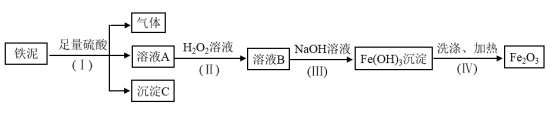
(1)写出步骤(I)中铁单质参与的有关反应的离子方程式______ 、______ ,分离溶液A和沉淀C的操作名称是______ 。
(2)检验溶液A中含有 应选用的试剂是
应选用的试剂是______
A.铁粉 B. 溶液 C.酸性
溶液 C.酸性 溶液 D.KSCN溶液
溶液 D.KSCN溶液
(3)步骤(Ⅱ)中加入 溶液,
溶液, 在反应中作
在反应中作______ (用离子反应方程式解释)。
(4)若最终获得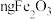 ,则铁泥中铁元素的质量分数为
,则铁泥中铁元素的质量分数为______ 。
 ,设计实验流程如下:
,设计实验流程如下:
(1)写出步骤(I)中铁单质参与的有关反应的离子方程式
(2)检验溶液A中含有
 应选用的试剂是
应选用的试剂是A.铁粉 B.
 溶液 C.酸性
溶液 C.酸性 溶液 D.KSCN溶液
溶液 D.KSCN溶液(3)步骤(Ⅱ)中加入
 溶液,
溶液, 在反应中作
在反应中作(4)若最终获得
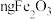 ,则铁泥中铁元素的质量分数为
,则铁泥中铁元素的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】铁是生产、生活及生命中的重要元素。
(1)血红蛋白中的铁元素呈+2价,具有结合O2分子结合成氧合血红蛋白的能力。如果误服亚硝酸盐,会使人中毒,因为二价铁被_______ (填“氧化”或“还原”)。
(2)为防止FeCl2发生氧化反应而变质,存放时应加入_____ (填化学式)。现有一瓶久置的FeCl2溶液,请设计实验检验其中是否含有Fe3+__________________________ 。
(3)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型消毒剂。在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4的离子方程式:__________________________ ;高铁酸钠对水消毒时转化为Fe3+,Fe3+ 净水的有关离子方程式为___________________ 。
(4)球墨铸铁中含有一种铁碳化合物X。实验小组为测定X的组成设计实验如下:
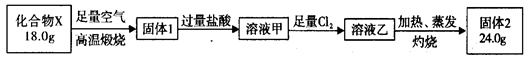
固体2的俗名是________ ,X的化学式可以表示为________ 。
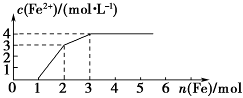
(5)某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的物质的量之间的关系如图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3的物质的量浓度之比为________ 。
 。
。
(1)血红蛋白中的铁元素呈+2价,具有结合O2分子结合成氧合血红蛋白的能力。如果误服亚硝酸盐,会使人中毒,因为二价铁被
(2)为防止FeCl2发生氧化反应而变质,存放时应加入
(3)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型消毒剂。在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4的离子方程式:
(4)球墨铸铁中含有一种铁碳化合物X。实验小组为测定X的组成设计实验如下:

固体2的俗名是
(5)某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的物质的量之间的关系如图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3的物质的量浓度之比为
 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】甘氨酸亚铁[ (H2NCH2COO)2Fe]是一种补血剂,工业上用赤铁矿(含少量铝、铜、硅、锰的氧化物)制备甘氨酸亚铁的流程图如下:

已知:甘氨酸(H2NCH2COOH),易溶于水,微溶于乙醇,具有两性。
FeSO4·7H2O也是一种常用的补血剂,在空气中易变质,检验其是否变质的试剂是_______ 。

已知:甘氨酸(H2NCH2COOH),易溶于水,微溶于乙醇,具有两性。
FeSO4·7H2O也是一种常用的补血剂,在空气中易变质,检验其是否变质的试剂是
您最近一年使用:0次
【推荐3】I.向含有 、
、 、
、 (已知还原性
(已知还原性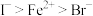 )的溶液中缓慢通入氯气,溶液中各种离子的物质的量变化如图所示。
)的溶液中缓慢通入氯气,溶液中各种离子的物质的量变化如图所示。

(1)当通入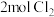 时,溶液中发生反应的离子方程式是:
时,溶液中发生反应的离子方程式是:_______ 。
(2)BC段表示_______ 的物质的量变化情况。
(3)原溶液中
_______ 。
Ⅱ.“化学——我们的生活,我们的未来。”学习化学应该明白“从生活中来,到生活中去”的道理。请填空:
(4)生活中若将“84”消毒液(有效成分是 )和洁厕灵(主要成分是
)和洁厕灵(主要成分是 )混合,易产生黄绿色有毒气体,请写出该反应的离子方程式:
)混合,易产生黄绿色有毒气体,请写出该反应的离子方程式:_______ 。
(5)某补铁剂(有效成分为 )因长期放置被氧化而失效,为检验其氧化产物
)因长期放置被氧化而失效,为检验其氧化产物 ,同学们取上述样品制成溶液进行如下实验。
,同学们取上述样品制成溶液进行如下实验。
①甲同学取少许溶液,加入_______ 溶液,出现血红色溶液,证明氧化产物为 。
。
②乙同学另取少许溶液,加入淀粉 溶液,溶液变为蓝色,证明氧化产物为
溶液,溶液变为蓝色,证明氧化产物为 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
 、
、 、
、 (已知还原性
(已知还原性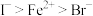 )的溶液中缓慢通入氯气,溶液中各种离子的物质的量变化如图所示。
)的溶液中缓慢通入氯气,溶液中各种离子的物质的量变化如图所示。
(1)当通入
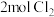 时,溶液中发生反应的离子方程式是:
时,溶液中发生反应的离子方程式是:(2)BC段表示
(3)原溶液中

Ⅱ.“化学——我们的生活,我们的未来。”学习化学应该明白“从生活中来,到生活中去”的道理。请填空:
(4)生活中若将“84”消毒液(有效成分是
 )和洁厕灵(主要成分是
)和洁厕灵(主要成分是 )混合,易产生黄绿色有毒气体,请写出该反应的离子方程式:
)混合,易产生黄绿色有毒气体,请写出该反应的离子方程式:(5)某补铁剂(有效成分为
 )因长期放置被氧化而失效,为检验其氧化产物
)因长期放置被氧化而失效,为检验其氧化产物 ,同学们取上述样品制成溶液进行如下实验。
,同学们取上述样品制成溶液进行如下实验。①甲同学取少许溶液,加入
 。
。②乙同学另取少许溶液,加入淀粉
 溶液,溶液变为蓝色,证明氧化产物为
溶液,溶液变为蓝色,证明氧化产物为 ,该反应的离子方程式为
,该反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】Cu2O可用于制作船底防污漆,某学习小组探究制备Cu2O的方法。
【查阅资料】① CuSO4与Na2SO3溶液混合可制备Cu2O。② Cu2O为砖红色固体;酸性条件下生成Cu2+和Cu。
③ Cu2O和Cu(SO3)23-可以相互转化 Cu2O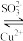 Cu(SO3)23-(无色)
Cu(SO3)23-(无色)
(1)配制0.25 mol·L-1CuSO4溶液和0.25 mol·L-1 Na2SO3溶液。测得CuSO4溶液pH=4,Na2SO3溶液pH=9。用离子方程式表示CuSO4溶液pH=4的原因_______ 。
(2)完成CuSO4溶液和Na2SO3溶液反应制Cu2O的离子方程式:____ Cu2++ ____ SO32-+ ____ =____ Cu2O↓+ ____ + ____ HSO3-
【实验探究】
(3)证明ii中砖红色沉淀是Cu2O的实验方案是_______ 。
(4)经检验i中黄色沉淀含有Cu2SO3,ii中沉淀由黄色变砖红色的化学方程式是______ 。
(5)iii中砖红色沉淀消失的原因是_______ 。
(6)在加热条件下,若向2 mL 0.25 mol·L-1Na2SO3溶液中滴加0.25 mol·L-1CuSO4溶液至过量,预期观察到的现象是_______ 。
(7)由上述实验得出结论:CuSO4溶液和Na2SO3溶液反应制备Cu2O,应控制的条件是_______ 、_______ 。
【查阅资料】① CuSO4与Na2SO3溶液混合可制备Cu2O。② Cu2O为砖红色固体;酸性条件下生成Cu2+和Cu。
③ Cu2O和Cu(SO3)23-可以相互转化 Cu2O
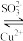 Cu(SO3)23-(无色)
Cu(SO3)23-(无色) (1)配制0.25 mol·L-1CuSO4溶液和0.25 mol·L-1 Na2SO3溶液。测得CuSO4溶液pH=4,Na2SO3溶液pH=9。用离子方程式表示CuSO4溶液pH=4的原因
(2)完成CuSO4溶液和Na2SO3溶液反应制Cu2O的离子方程式:
【实验探究】
| 操作 | 现象 |
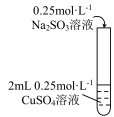 | i 有黄色沉淀出现,随着 Na2SO3溶液的滴入,沉淀增加,当加到5 mL时,溶液的蓝色消失。 ii 将试管加热,黄色沉淀变为砖红色,有刺激性气味气体产生。 iii在加热条件下,继续滴入Na2SO3溶液,砖红色沉淀减少,当1加到10 mL时,沉淀完全溶解,得无色溶液。 |
(4)经检验i中黄色沉淀含有Cu2SO3,ii中沉淀由黄色变砖红色的化学方程式是
(5)iii中砖红色沉淀消失的原因是
(6)在加热条件下,若向2 mL 0.25 mol·L-1Na2SO3溶液中滴加0.25 mol·L-1CuSO4溶液至过量,预期观察到的现象是
(7)由上述实验得出结论:CuSO4溶液和Na2SO3溶液反应制备Cu2O,应控制的条件是
您最近一年使用:0次
【推荐2】为探究黑色固体 X(仅含两种元素)的组成和性质,设计并完成如下实验:

(1)X的化学式是________________ 。
(2)写出固体甲与稀硫酸反应的离子方程式________________________ 。

(1)X的化学式是
(2)写出固体甲与稀硫酸反应的离子方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
【查阅资料】:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
【提出假设】:假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
若取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
(1)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?___________ 简述你的理由___________
(2)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是___________
【探究延伸】:
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(3)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为___________ 。
(4)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下表:
实验室有下列试剂可供选择:A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
请用上述试剂,设计方案将Cu2+、Fe2+、Fe3+混合溶液中的Fe2+、Fe3+除去_______ 。
【查阅资料】:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
【提出假设】:假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
若取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
(1)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?
(2)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是
【探究延伸】:
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(3)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为
(4)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下表:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 6.5 | 1.4 |
| 沉淀完全pH | 13 | 9.7 | 3.7 |
请用上述试剂,设计方案将Cu2+、Fe2+、Fe3+混合溶液中的Fe2+、Fe3+除去
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
解题方法
【推荐1】五种有机物A、B、C、D、E,其中A、B是烃类,其它为含氧衍生物;A与E、B与D分别碳数相同。常温常压下A为气体,B、C是液体,D为固体。已知:
(1)A可以聚合;完全燃烧1molA,需氧气3mol。
(2)B的蒸气对氢气的相对密度是39,完全燃烧7.8g B,需氧气16.8L(标准状态)。
(3)C与浓硫酸共热得A,C经氧化可得E。
(4)D溶液遇FeCl3溶液显紫色,E与Na2CO3溶液混和有气体产生。
由上述推断出各物质的结构简式:A._________ 、B.___________ 、C.__________ 、 D.___________ 、E.____________ 。
(1)A可以聚合;完全燃烧1molA,需氧气3mol。
(2)B的蒸气对氢气的相对密度是39,完全燃烧7.8g B,需氧气16.8L(标准状态)。
(3)C与浓硫酸共热得A,C经氧化可得E。
(4)D溶液遇FeCl3溶液显紫色,E与Na2CO3溶液混和有气体产生。
由上述推断出各物质的结构简式:A.
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】环己烯是重要的化工原料。其实验室制备流程如下:

回答下列问题。
Ⅰ.环己烯的制备与提纯
(1)检验原料环己醇中是否含有苯酚杂质,所需试剂与现象分别为___________ 、___________ 。
(2)操作1的装置如图所示(加热和夹持装置已略去)。

①仪器B的作用为___________ 。
②烧瓶A中为可逆反应,写出其中反应的化学方程式:___________ ;
③A中反应催化剂不选用浓硫酸的原因:___________ 。
(3)操作2分离方法名称是___________ 。
(4)完善操作3的步骤:
①安装蒸馏装置
②加入待蒸馏的物质和沸石
③___________
④加热
⑤弃去前馏分
⑥___________
⑦停止加热
⑧停止通冷凝水。
Ⅱ.环己烯含量的测定
(5)在一定条件下,向 环己烯样品中加入
环己烯样品中加入 ,与环己烯充分反应后,剩余的
,与环己烯充分反应后,剩余的 与足量
与足量 作用生成
作用生成 ,用
,用 的
的 标准溶液滴定,终点时消耗
标准溶液滴定,终点时消耗 标准溶液
标准溶液 (以上数据均已扣除干扰因素)。测定过程中,发生的反应如下:
(以上数据均已扣除干扰因素)。测定过程中,发生的反应如下:
ⅰ.
ⅱ.
ⅲ.
①滴定所用指示剂为___________ 。
②样品中环己烯的质量分数为___________ (用字母表示)。

回答下列问题。
Ⅰ.环己烯的制备与提纯
(1)检验原料环己醇中是否含有苯酚杂质,所需试剂与现象分别为
(2)操作1的装置如图所示(加热和夹持装置已略去)。

①仪器B的作用为
②烧瓶A中为可逆反应,写出其中反应的化学方程式:
③A中反应催化剂不选用浓硫酸的原因:
(3)操作2分离方法名称是
(4)完善操作3的步骤:
①安装蒸馏装置
②加入待蒸馏的物质和沸石
③
④加热
⑤弃去前馏分
⑥
⑦停止加热
⑧停止通冷凝水。
Ⅱ.环己烯含量的测定
(5)在一定条件下,向
 环己烯样品中加入
环己烯样品中加入 ,与环己烯充分反应后,剩余的
,与环己烯充分反应后,剩余的 与足量
与足量 作用生成
作用生成 ,用
,用 的
的 标准溶液滴定,终点时消耗
标准溶液滴定,终点时消耗 标准溶液
标准溶液 (以上数据均已扣除干扰因素)。测定过程中,发生的反应如下:
(以上数据均已扣除干扰因素)。测定过程中,发生的反应如下:ⅰ.

ⅱ.

ⅲ.

①滴定所用指示剂为
②样品中环己烯的质量分数为
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
解题方法
【推荐3】以下为某药物K的合成路线:

回答下列问题:
(1)已知B分子苯环上的一氯代物只有2种,则B的结构简式为_______ 。
(2)D中官能团的名称为_______ 。
(3)G→H的方程式为_______ 。
(4)H→I的反应条件为_______ 。
(5)E+J→K的另一产物为_______ 。
(6)符合下列条件的E的同分异构体有_______ 种,其中一种同分异构体的结构简式为_______ 。
①能发生银镜反应;
②与FeCl3溶液不发生显色反应,但水解产物之一能发生;
③核磁共振氢谱有四组峰,峰面积之比为6:2:1:1。

回答下列问题:
(1)已知B分子苯环上的一氯代物只有2种,则B的结构简式为
(2)D中官能团的名称为
(3)G→H的方程式为
(4)H→I的反应条件为
(5)E+J→K的另一产物为
(6)符合下列条件的E的同分异构体有
①能发生银镜反应;
②与FeCl3溶液不发生显色反应,但水解产物之一能发生;
③核磁共振氢谱有四组峰,峰面积之比为6:2:1:1。
您最近一年使用:0次



