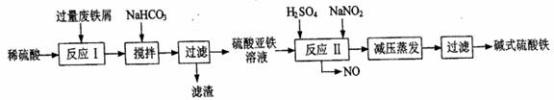
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
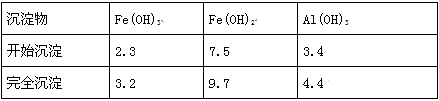
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
回答下列问题:
(1)加入过量废铁屑的目的是________________________ (用离子方程式表示);加入少量NaHCO3的目的是________________________ ;该工艺中“搅拌”的作用是________________________ ;
(2)反应Ⅱ中的离子方程式为__________ ;该流程中可以循环、回收利用的物质是________ ;
(3)生产中碱式硫酸铁溶液蒸发时需要在减压条件下的原因是________ ;
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-;为检验所得产品中是否含有Fe2+,应使用的试剂为______ 。(填写字母)

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:

回答下列问题:
(1)加入过量废铁屑的目的是
(2)反应Ⅱ中的离子方程式为
(3)生产中碱式硫酸铁溶液蒸发时需要在减压条件下的原因是
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-;为检验所得产品中是否含有Fe2+,应使用的试剂为
| A.酸性KMnO4溶液 | B.KSCN溶液 | C.氯水 | D.NaOH溶液 |
更新时间:2016-12-09 08:01:22
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】I.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是___________ (填化学式)。
(2)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。
、Cl-、H2O。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:___________ 。
②每生成2mol 转移
转移___________ mol电子,若反应过程中转移了0.5mol电子,则还原产物的物质的量为___________ mol。
II.工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:

回答下列问题:
(3)试剂a是___________ ,操作I用到的玻璃仪器有烧杯、玻璃棒和___________ 。
(4)滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为___________ 。
(5)上述流程中操作III包括___________ 、___________ 、过滤、洗涤。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是
(2)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。
、Cl-、H2O。①请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:
②每生成2mol
 转移
转移II.工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:

回答下列问题:
(3)试剂a是
(4)滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为
(5)上述流程中操作III包括
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】以铁镍合金(含少量铜)为原料,生产电极材料LiNiO2的部分工艺流程如下:

已知:①表中列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol∙L-1计算);
②Ksp[Fe(OH)3]=5×10-38;
③本工艺环境下KMnO4溶液不与Ni2+发生反应。
回答下列问题。
(1)LiNiO2中Ni的化合价为___________ 。
(2)“酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80℃的原因是___________ 。
(3)“除铁”时加入适量KMnO4溶液并调节溶液pH的目的是除去铁元素的同时溶液中不会有明显的锰元素残留,写出“除铁”步骤的离子方程式___________ ,常温下此体系中Fe3+残留最大浓度为___________ mol∙L-1。
(4)“除铜”时不能通过调节溶液的pH来除去溶液中Cu2+,理由是___________ 。
(5)“沉镍”时得到碳酸镍(NiCO3)沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得LiNiO2,该反应的过程中氧化剂与还原剂的物质的量之比为___________ 。

已知:①表中列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol∙L-1计算);
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | Ni2+ |
| 开始沉淀pH | 1.1 | 5.8 | 4.6 | 6.7 |
| 完全沉淀pH | 3.2 | 8.8 | 7.4 | 9.5 |
②Ksp[Fe(OH)3]=5×10-38;
③本工艺环境下KMnO4溶液不与Ni2+发生反应。
回答下列问题。
(1)LiNiO2中Ni的化合价为
(2)“酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80℃的原因是
(3)“除铁”时加入适量KMnO4溶液并调节溶液pH的目的是除去铁元素的同时溶液中不会有明显的锰元素残留,写出“除铁”步骤的离子方程式
(4)“除铜”时不能通过调节溶液的pH来除去溶液中Cu2+,理由是
(5)“沉镍”时得到碳酸镍(NiCO3)沉淀。在空气中碳酸镍与碳酸锂共同“煅烧”可制得LiNiO2,该反应的过程中氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
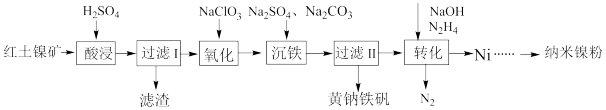
【推荐3】镍是化工产业的重要原料。以红土镍矿(主要含有Fe2O3、FeO、NiO、SiO2等)为原料,制取纳米镍粉,同时获得净水剂黄钠铁矾[NaFe3(SO4)2(OH)6]的工艺流程如下:
溶液中Ni2+离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“酸浸”时需要加热,其原因是______ 。
(2)“氧化”过程发生反应的离子方程式是______ 。
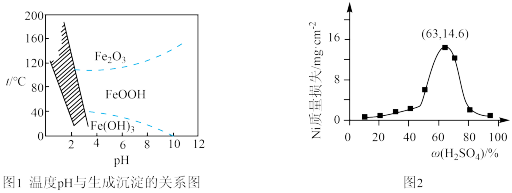
(3)“沉铁”过程,控制不同的条件可以得到不同的沉淀,所得沉淀与温度、pH的关系如图所示(图1中阴影部分表示的是黄钠铁矾稳定存在区域)。若反应在80℃时进行,加碳酸钠偏多,则所得黄钠铁矾中混有的杂质是______ ;检验沉铁步骤中反应是否完全的方法是______ 。
(4)利用上述表格数据,计算Ni(OH)2的Ksp=______ (列出计算式)。
(5)“转化”过程,向“过滤II”所得滤液(富含Ni2+)中加入N2H4,控制溶液中NaOH的浓度,可得到不同晶态物质(NiSO4·Ni、Ni或二者的混合物)。写出生成Ni的离子方程式______ 。
(6)95℃时,将Ni片浸在不同质量分数的硫酸中,经4小时腐蚀后的质量损失情况如图2所示,当ω(H2SO4)大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为______ 。

溶液中Ni2+离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ |
| 开始沉淀时(c=0.01mol·L-1)的pH | 7.2 |
| 沉淀完全时(c=1.0×10-5mol·L-1)的pH | 8.7 |
(1)“酸浸”时需要加热,其原因是
(2)“氧化”过程发生反应的离子方程式是
(3)“沉铁”过程,控制不同的条件可以得到不同的沉淀,所得沉淀与温度、pH的关系如图所示(图1中阴影部分表示的是黄钠铁矾稳定存在区域)。若反应在80℃时进行,加碳酸钠偏多,则所得黄钠铁矾中混有的杂质是

(4)利用上述表格数据,计算Ni(OH)2的Ksp=
(5)“转化”过程,向“过滤II”所得滤液(富含Ni2+)中加入N2H4,控制溶液中NaOH的浓度,可得到不同晶态物质(NiSO4·Ni、Ni或二者的混合物)。写出生成Ni的离子方程式
(6)95℃时,将Ni片浸在不同质量分数的硫酸中,经4小时腐蚀后的质量损失情况如图2所示,当ω(H2SO4)大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】我国化工专家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
(1)沉淀池中发生的化学反应方程式是______ 。
(2)上述流程中X物质的分子式______ 。
(3)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是___ (选填字母)。
A.碳酸氢钠难溶于水
B.碳酸氢钠受热易分解
C.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(4)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。第一位同学:将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
请回答:
①甲中发生反应的离子方程式是________ 。
②乙装置中的试剂是___________ 。
③实验结束后,分离出NaHCO3 晶体的操作是________ (填分离操作的名称)。
第二位同学:用图中戊装置进行实验(其它装置未画出)。
④为提高二氧化碳在此反应液中被吸收的程度,实验时,须先从a管通入___ 气体,再从b管通入_____ 气体。
⑤装置c中的试剂为_______ (选填字母)。
A.碱石灰 B.浓硫酸 C.无水氯化钙
(5)请你再写出一种实验室制取少量碳酸氢钠的方法:(用简要的文字和相关的化学反应方程式来描述):________________ 。
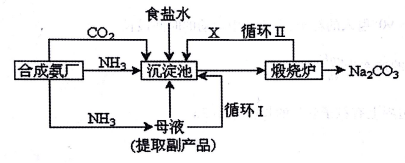
(1)沉淀池中发生的化学反应方程式是
(2)上述流程中X物质的分子式
(3)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是
A.碳酸氢钠难溶于水
B.碳酸氢钠受热易分解
C.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(4)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。第一位同学:将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

请回答:
①甲中发生反应的离子方程式是
②乙装置中的试剂是
③实验结束后,分离出NaHCO3 晶体的操作是
第二位同学:用图中戊装置进行实验(其它装置未画出)。
④为提高二氧化碳在此反应液中被吸收的程度,实验时,须先从a管通入
⑤装置c中的试剂为
A.碱石灰 B.浓硫酸 C.无水氯化钙
(5)请你再写出一种实验室制取少量碳酸氢钠的方法:(用简要的文字和相关的化学反应方程式来描述):
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】超酸是一类比纯硫酸更强的酸,在石油重整中用作高效催化剂。某实验小组用SbCl3制备超酸HSbF6,反应原理如下:SbCl3+Cl2 SbCl5、SbCl5+6HF=HSbF6+5HCl。制备SbCl5的实验装置如图(毛细管连通大气,夹持、加热及搅拌装置略):
SbCl5、SbCl5+6HF=HSbF6+5HCl。制备SbCl5的实验装置如图(毛细管连通大气,夹持、加热及搅拌装置略):
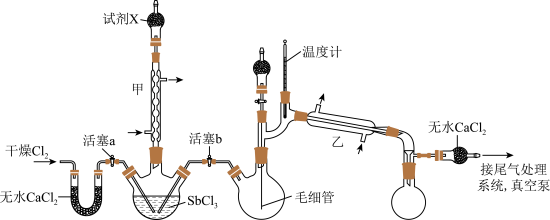
已知:
回答下列问题:
(1)Sb为第51号元素,则在元素周期表中的位置为___________ 。
(2)仪器甲、乙可否互换?___________ (填“是”或“否”),原因是___________ 。
(3)试剂X的名称为___________ 。
(4)三颈烧瓶中的反应完成后,需将反启后的溶液转移至双口烧瓶中进行减压蒸馏。
①在该装置中,将三颈烧瓶中的溶液转移至双口烧瓶中的操作是___________ 。
②用减压蒸储而不用常压蒸储的主要原因是___________ 。
(5)毛细管连通大气的主要作用是防止___________ ,还具有搅拌和加速液体逸出的作用。
(6)由SbCl5制备HSbF6时,应选用___________材质的仪器(填标号)。
(7)蒸储-EDTA返滴法是测定氟的高精度办法,可通过测定氟元素的含量,确定本产品纯度。取 g产品,通过蒸馏法将氟全部转化为F-,用25.00mL
g产品,通过蒸馏法将氟全部转化为F-,用25.00mL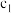 mol/L La(NO3)3吸收,冷却至室温,加入指示剂,用
mol/L La(NO3)3吸收,冷却至室温,加入指示剂,用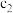 mol/L EDTA标准溶液(用H2Y2-表示)滴定至终点,消耗EDTA
mol/L EDTA标准溶液(用H2Y2-表示)滴定至终点,消耗EDTA 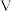 mL。氟元素的质量分数为
mL。氟元素的质量分数为___________ (列出计算式)。(已知La3++3F-=LaF3;La3++H2Y2-=LaY-+2H+)
 SbCl5、SbCl5+6HF=HSbF6+5HCl。制备SbCl5的实验装置如图(毛细管连通大气,夹持、加热及搅拌装置略):
SbCl5、SbCl5+6HF=HSbF6+5HCl。制备SbCl5的实验装置如图(毛细管连通大气,夹持、加热及搅拌装置略):
已知:
| 物质 | 熔点 | 沸点 | 性质 |
| SbCl3 | 73.4℃ | 101.3kPa220.3℃ | 极易水解 |
| SbCl5 | 3.5℃ | 101.3kPa176℃(140°C分解) | 极易水解 |
| 2.9kPa79℃ |
(1)Sb为第51号元素,则在元素周期表中的位置为
(2)仪器甲、乙可否互换?
(3)试剂X的名称为
(4)三颈烧瓶中的反应完成后,需将反启后的溶液转移至双口烧瓶中进行减压蒸馏。
①在该装置中,将三颈烧瓶中的溶液转移至双口烧瓶中的操作是
②用减压蒸储而不用常压蒸储的主要原因是
(5)毛细管连通大气的主要作用是防止
(6)由SbCl5制备HSbF6时,应选用___________材质的仪器(填标号)。
| A.玻璃 | B.陶瓷 | C.铁或铝 | D.聚四氟乙烯 |
 g产品,通过蒸馏法将氟全部转化为F-,用25.00mL
g产品,通过蒸馏法将氟全部转化为F-,用25.00mL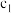 mol/L La(NO3)3吸收,冷却至室温,加入指示剂,用
mol/L La(NO3)3吸收,冷却至室温,加入指示剂,用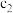 mol/L EDTA标准溶液(用H2Y2-表示)滴定至终点,消耗EDTA
mol/L EDTA标准溶液(用H2Y2-表示)滴定至终点,消耗EDTA 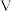 mL。氟元素的质量分数为
mL。氟元素的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】研究小组以 (绿色固体)、
(绿色固体)、 等物质为原料制备无水
等物质为原料制备无水 (紫色固体,易升华),制备装置如图所示(夹持装置略)。
(紫色固体,易升华),制备装置如图所示(夹持装置略)。

(1)仪器A的名称为_______ 。
(2)B处的装置为_______ (填选项),装的药品为_______ 。
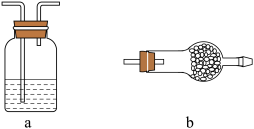
(3)本实验持续通入 的目的有赶走体系中原有的空气、
的目的有赶走体系中原有的空气、_______ 。
(4)反应管的温度升到 时发生反应,生成
时发生反应,生成 和
和 (光气),其化学方程式为
(光气),其化学方程式为_______ 。 有剧毒,与水反应生成两种酸性气体,
有剧毒,与水反应生成两种酸性气体, 分子中
分子中 原子的杂化方式为
原子的杂化方式为_______ ,C装置中生成的盐是_______ (填化学式)。
(5)反应管右端有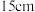 在加热炉外,其作用是
在加热炉外,其作用是_______ 。
(6)反应完成后,得到固体产品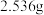 。则该实验的产率为
。则该实验的产率为_______  。[已知
。[已知 的式量为152;
的式量为152; 的式量为158.5]
的式量为158.5]
 (绿色固体)、
(绿色固体)、 等物质为原料制备无水
等物质为原料制备无水 (紫色固体,易升华),制备装置如图所示(夹持装置略)。
(紫色固体,易升华),制备装置如图所示(夹持装置略)。
(1)仪器A的名称为
(2)B处的装置为

(3)本实验持续通入
 的目的有赶走体系中原有的空气、
的目的有赶走体系中原有的空气、(4)反应管的温度升到
 时发生反应,生成
时发生反应,生成 和
和 (光气),其化学方程式为
(光气),其化学方程式为 有剧毒,与水反应生成两种酸性气体,
有剧毒,与水反应生成两种酸性气体, 分子中
分子中 原子的杂化方式为
原子的杂化方式为(5)反应管右端有
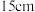 在加热炉外,其作用是
在加热炉外,其作用是(6)反应完成后,得到固体产品
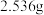 。则该实验的产率为
。则该实验的产率为 。[已知
。[已知 的式量为152;
的式量为152; 的式量为158.5]
的式量为158.5]
您最近一年使用:0次



