I.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是___________ (填化学式)。
(2)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。
、Cl-、H2O。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:___________ 。
②每生成2mol 转移
转移___________ mol电子,若反应过程中转移了0.5mol电子,则还原产物的物质的量为___________ mol。
II.工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:

回答下列问题:
(3)试剂a是___________ ,操作I用到的玻璃仪器有烧杯、玻璃棒和___________ 。
(4)滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为___________ 。
(5)上述流程中操作III包括___________ 、___________ 、过滤、洗涤。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是
(2)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。
、Cl-、H2O。①请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:
②每生成2mol
 转移
转移II.工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:

回答下列问题:
(3)试剂a是
(4)滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为
(5)上述流程中操作III包括
更新时间:2023-07-15 10:18:50
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】重铬酸钾是一种重要的化工原料,工业上以某含铬矿(主要成分为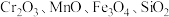 等)为主要原料制备重铬酸钾的工艺流程如图所示:
等)为主要原料制备重铬酸钾的工艺流程如图所示: 的条件下,
的条件下, (III)不能被氧化,高锰酸钾的还原产物是
(III)不能被氧化,高锰酸钾的还原产物是 。
。
回答下列问题:
(1)为提高“酸浸”效率,可采取的措施有_______ (任写两条)。
(2)浸渣的主要成分为_______ (填化学式);“除铁、除锰”时沉锰的离子方程式为_______ 。
(3)“焙烧”时发生反应的化学方程式为_______ 。
(4)调 ”的目的是为了完成
”的目的是为了完成 和
和 的转换,涉及反应:
的转换,涉及反应: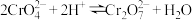 ;常温下,某
;常温下,某 溶液中含铬元素
溶液中含铬元素 ,调节溶液的
,调节溶液的 后两种离子的变化曲线如图所示,
后两种离子的变化曲线如图所示,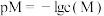 ,其中
,其中 可表示
可表示 或
或 ,图中表示
,图中表示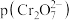 随
随 变化的曲线为
变化的曲线为_______ (填“X”或“Y”);其中反应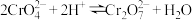 的平衡常数
的平衡常数
_______ 。 ”,在完成转换的同时制备
”,在完成转换的同时制备 和
和 (装置如图所示):
(装置如图所示):_______ (填化学式),离子交换膜为_______ (填“阴离子”“质子”或“阳离子”)交换膜。
(6)“交换”过程中有关物质的溶解度如图所示,有同学认为结晶过滤的温度应是 和
和 溶解度相差最大的时候,你认为这个观点是否正确并说明理由:
溶解度相差最大的时候,你认为这个观点是否正确并说明理由:_______ 。
 等)为主要原料制备重铬酸钾的工艺流程如图所示:
等)为主要原料制备重铬酸钾的工艺流程如图所示: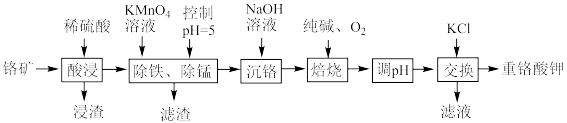
 的条件下,
的条件下, (III)不能被氧化,高锰酸钾的还原产物是
(III)不能被氧化,高锰酸钾的还原产物是 。
。回答下列问题:
(1)为提高“酸浸”效率,可采取的措施有
(2)浸渣的主要成分为
(3)“焙烧”时发生反应的化学方程式为
(4)调
 ”的目的是为了完成
”的目的是为了完成 和
和 的转换,涉及反应:
的转换,涉及反应: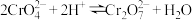 ;常温下,某
;常温下,某 溶液中含铬元素
溶液中含铬元素 ,调节溶液的
,调节溶液的 后两种离子的变化曲线如图所示,
后两种离子的变化曲线如图所示,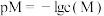 ,其中
,其中 可表示
可表示 或
或 ,图中表示
,图中表示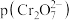 随
随 变化的曲线为
变化的曲线为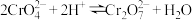 的平衡常数
的平衡常数

 ”,在完成转换的同时制备
”,在完成转换的同时制备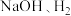 和
和 (装置如图所示):
(装置如图所示):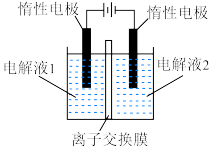
(6)“交换”过程中有关物质的溶解度如图所示,有同学认为结晶过滤的温度应是
 和
和 溶解度相差最大的时候,你认为这个观点是否正确并说明理由:
溶解度相差最大的时候,你认为这个观点是否正确并说明理由: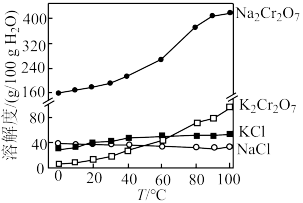
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】为充分利用资源,变废为宝,可从废旧CPU[含Au(金)、Ag、Cu和Pt(铂)]中回收Au,其化工流程如图:
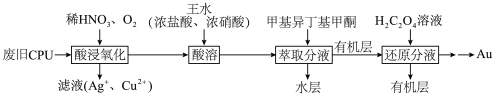
回答下列问题
(1)“酸浸氧化”中,为了提高反应速率,可以采取的措施是___________ (写出一种即可)。
(2)“酸浸氧化”中,通入氧气的目的是___________ 。
(3)“酸溶”时,Pt、Au分别转化为H2PtCl6和HAuCl4,同时有NO生成。Pt溶解的化学方程式是___________ 。
(4)“萃取分液”后的“水层”中可回收的金属是___________ 。
(5)从“还原分液”后的“有机层”中回收甲基异丁基甲酮,采用的方法是___________ 。
(6)理论上消耗1mol草酸(H2C2O4)可得到Au的质量为___________ g(结果保留一位小数)。
(7)提取“滤液”中的Ag+会涉及反应AgCl(s)+2NH3 [Ag(NH3)2]++Cl-,则该反应的平衡常数K的值为
[Ag(NH3)2]++Cl-,则该反应的平衡常数K的值为 ___________ 。已知:①[Ag(NH3)2]+ Ag++2NH3 K1=6×10-8;②Ksp(AgCl)=1.8×10-10。
Ag++2NH3 K1=6×10-8;②Ksp(AgCl)=1.8×10-10。

回答下列问题
(1)“酸浸氧化”中,为了提高反应速率,可以采取的措施是
(2)“酸浸氧化”中,通入氧气的目的是
(3)“酸溶”时,Pt、Au分别转化为H2PtCl6和HAuCl4,同时有NO生成。Pt溶解的化学方程式是
(4)“萃取分液”后的“水层”中可回收的金属是
(5)从“还原分液”后的“有机层”中回收甲基异丁基甲酮,采用的方法是
(6)理论上消耗1mol草酸(H2C2O4)可得到Au的质量为
(7)提取“滤液”中的Ag+会涉及反应AgCl(s)+2NH3
 [Ag(NH3)2]++Cl-,则该反应的平衡常数K的值为
[Ag(NH3)2]++Cl-,则该反应的平衡常数K的值为  Ag++2NH3 K1=6×10-8;②Ksp(AgCl)=1.8×10-10。
Ag++2NH3 K1=6×10-8;②Ksp(AgCl)=1.8×10-10。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
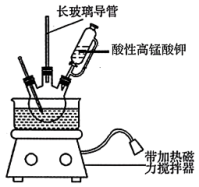
【推荐3】3,4-亚甲二氧基苯甲酸是一种用途广泛的有机合成中间体,微溶于水。实验室可用KMnO4氧化3,4-亚甲二氧基苯甲醛(油状液体)制备,实验装置如下图(夹持仪器已省略),其反应方程式为:
步骤1:向三颈烧瓶中加入3,4-亚甲二氧基苯甲醛11.2mL(约15.0g)和一定量水,缓慢开启搅拌器并加热。于70~80℃滴加稍过量的酸性KMnO4溶液,反应结束后,加入KOH溶液至碱性。
步骤2:趁热过滤,洗涤滤渣。合并滤液和洗涤液,向其中加入硫酸至水层不再产生沉淀。
步骤3:抽滤,洗涤,干燥,得3,4-亚甲二氧基苯甲酸固体12.2g。
回答下列问题:
(1)盛酸性KMnO4溶液的仪器的名称是___________ ;实验装置中长玻璃导管可用___________ 代替(填仪器名称)。
(2)反应结束后,加入KOH溶液前需向溶液中加入H2C2O4溶液在酸性条件下处理,发生反应的离子方程式为___________ 。
(3)步骤1中加入KOH溶液至碱性的目的是___________ 。
(4)步骤2中趁热过滤除去的物质是___________ (填化学式)。
(5)步骤3中检验产品是否洗净的操作为___________ 。
(6)写出步骤2中加入H2SO4发生的化学方程式___________ 。
(7)本实验3,4-亚甲二氧基苯甲酸的产率约为___________ %(保留两位小数)
3 +2KMnO4→2
+2KMnO4→2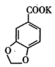 +
+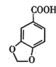 +2MnO2↓+H2O
+2MnO2↓+H2O
步骤1:向三颈烧瓶中加入3,4-亚甲二氧基苯甲醛11.2mL(约15.0g)和一定量水,缓慢开启搅拌器并加热。于70~80℃滴加稍过量的酸性KMnO4溶液,反应结束后,加入KOH溶液至碱性。
步骤2:趁热过滤,洗涤滤渣。合并滤液和洗涤液,向其中加入硫酸至水层不再产生沉淀。
步骤3:抽滤,洗涤,干燥,得3,4-亚甲二氧基苯甲酸固体12.2g。
回答下列问题:
(1)盛酸性KMnO4溶液的仪器的名称是
(2)反应结束后,加入KOH溶液前需向溶液中加入H2C2O4溶液在酸性条件下处理,发生反应的离子方程式为
(3)步骤1中加入KOH溶液至碱性的目的是
(4)步骤2中趁热过滤除去的物质是
(5)步骤3中检验产品是否洗净的操作为
(6)写出步骤2中加入H2SO4发生的化学方程式
(7)本实验3,4-亚甲二氧基苯甲酸的产率约为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】镓(Ga)是非常重要的稀土金属,其化合物广泛应用于诸多领域。
(1)镓元素在元素周期表中的位置是___________ 。
(2)GaN作为第三代半导体材料,广泛应用于大功率充电器和5G通讯技术。工业上利用炼锌矿渣[主要含可溶性铁酸镓 、铁酸锌
、铁酸锌 ]制备并提取GaN,工艺流程如下:
]制备并提取GaN,工艺流程如下:
①“酸浸”过程中 发生的反应的离子方程式为
发生的反应的离子方程式为___________ 。
②利用上述工艺,酸浸后的酸浸液应加入___________ 固体充分反应后再进行萃取。
③“反萃取”后,溶液中镓元素的存在形式为___________ (填离子符号)。
④回收金属元素时,锌主要从___________ 中回收。
A.浸出渣 B.酸浸液 C.水相 D.有机相
(3)MOCVD法是通过 与
与 反应得到GaN和另一种产物,该反应的化学方程式为
反应得到GaN和另一种产物,该反应的化学方程式为___________ 。
(4)该流程中,可以循环使用的物质是___________ 。
(1)镓元素在元素周期表中的位置是
(2)GaN作为第三代半导体材料,广泛应用于大功率充电器和5G通讯技术。工业上利用炼锌矿渣[主要含可溶性铁酸镓
 、铁酸锌
、铁酸锌 ]制备并提取GaN,工艺流程如下:
]制备并提取GaN,工艺流程如下: 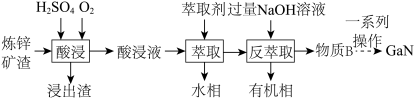
| 金属离子 |  |  |  |  |
| 萃取率/% | 0 | 0 | 99 | 97~98.5 |
 发生的反应的离子方程式为
发生的反应的离子方程式为②利用上述工艺,酸浸后的酸浸液应加入
③“反萃取”后,溶液中镓元素的存在形式为
④回收金属元素时,锌主要从
A.浸出渣 B.酸浸液 C.水相 D.有机相
(3)MOCVD法是通过
 与
与 反应得到GaN和另一种产物,该反应的化学方程式为
反应得到GaN和另一种产物,该反应的化学方程式为(4)该流程中,可以循环使用的物质是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,为探索工业废料的再利用,某化学兴趣小组设计了如图实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4•7H2O)和胆矾晶体。

请回答:
(1)写出步骤II反应的离子方程式:_______ 。
(2)试剂X是_______ ,溶液D是_______ 。
(3)在步骤II时,用如图装置制取CO2并通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是_______ 。

(4)由固体F制取硫酸铜溶液,通常有两种方案:
方案一:将固体F在加热条件下与浓硫酸反应;
方案二:将固体F投入热的稀浓硫酸中,然后通入氧气;
方法一的缺点为:_______ 。
(5)工业上常用溶液E制得净水剂Na2FeO4,流程如图:

①测得溶液E中c(Fe2+)为0.2mol·L-1,若要处理1m3溶液E,理论上需要消耗25%的H2O2溶液_______ kg。
②写出由Fe(OH)3制取Na2FeO4的离子方程式_______ 。(已知NaClO还原为NaCl)

请回答:
(1)写出步骤II反应的离子方程式:
(2)试剂X是
(3)在步骤II时,用如图装置制取CO2并通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可采取的改进措施是

(4)由固体F制取硫酸铜溶液,通常有两种方案:
方案一:将固体F在加热条件下与浓硫酸反应;
方案二:将固体F投入热的稀浓硫酸中,然后通入氧气;
方法一的缺点为:
(5)工业上常用溶液E制得净水剂Na2FeO4,流程如图:

①测得溶液E中c(Fe2+)为0.2mol·L-1,若要处理1m3溶液E,理论上需要消耗25%的H2O2溶液
②写出由Fe(OH)3制取Na2FeO4的离子方程式
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】工业上用某矿渣(主要成分是Cu2O,少量杂质是Al2O3、Fe2O3和SiO2)提取铜的操作流程如下:

已知:①Cu2O+2H+=Cu+Cu2++H2O ②某些金属氢氧化物开始测沉淀和完全沉淀时的pH
(1)反应I中,与铁元素有关反应的离子方程式为__________________ 、________________ 。
(2)y的数值范围是_____________________ 。
(3)以上步骤中的NaOH可以用__________ 代替(填字母)
A.CuO B.NH4Cl C.Cu(OH)2
(4)电解过程中,阳极产物可能为_____________________ 。
(5)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,且该物质与还原产物的物质的量之比为4:1,该反应的离子方程式为___________________________ 。

已知:①Cu2O+2H+=Cu+Cu2++H2O ②某些金属氢氧化物开始测沉淀和完全沉淀时的pH
| 沉淀物 |  | 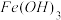 |  |  |
| 开始沉淀pH | 5.4 | 4.0 | 2.2 | 5.8 |
| 沉淀完成pH | 6.7 | 5.2 | 3.2 | 8.8 |
(2)y的数值范围是
(3)以上步骤中的NaOH可以用
A.CuO B.NH4Cl C.Cu(OH)2
(4)电解过程中,阳极产物可能为
(5)用NaClO调pH,生成沉淀B的同时生成一种具有漂白作用的物质,且该物质与还原产物的物质的量之比为4:1,该反应的离子方程式为
您最近一年使用:0次



