下列关于电解质溶液的正确判断是
| A.在pH = 12的溶液中,K+、Cl—、HCO3—、Na+可以大量共存 |
| B.在pH= 0的溶液中,Na+、NO3—、SO32—、K+可以大量共存 |
C.由0.1 mol/L一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH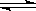 B++OH— B++OH— |
| D.pH=2的一元酸和pH=12的一元强碱等体积混后溶液一定存在:c( OH-)= c(H+) |
11-12高二下·江西·阶段练习 查看更多[2]
更新时间:2016-12-09 17:20:55
|
【知识点】 弱电解质的电离
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式或化学方程式的叙述中,正确的是( )
A.向含有相等物质的量的 、ClO-、 、ClO-、 溶液中,逐滴加入稀盐酸,反应由前到后顺序为: 溶液中,逐滴加入稀盐酸,反应由前到后顺序为: 、ClO-、 、ClO-、 |
| B.向含有0.4molFeI2的溶液中通入0.3molCl2充分反应:4Fe2++2I-+3Cl2=4Fe3++6Cl-+I2 |
C.向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O=HClO+ |
D.向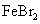 溶液中滴加少量氯水,再加入 溶液中滴加少量氯水,再加入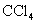 溶液振荡,静置,有机层呈橙色 溶液振荡,静置,有机层呈橙色 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
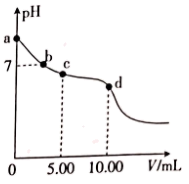
【推荐2】室温下,向10.00 mL0.1000 mol·L-1NaHCO3溶液中滴加0.1000 mol·L-1的盐酸,溶液的pH随加入的盐酸的体积V变化的曲线如图所示(已知室温下H2CO3的电离平衡常数: ,
,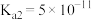 。忽略混合时溶液体积和温度的变化)。下列说法正确的是
。忽略混合时溶液体积和温度的变化)。下列说法正确的是
 ,
,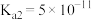 。忽略混合时溶液体积和温度的变化)。下列说法正确的是
。忽略混合时溶液体积和温度的变化)。下列说法正确的是
A.a点时,对于反应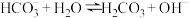 ,反应达到平衡状态时,平衡常数 ,反应达到平衡状态时,平衡常数 |
| B.b点溶液中的全部溶质为NaHCO3和NaCl |
C.c点溶液中,c(Na+)>c(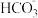 )>c(Cl-)>c(H+)>c(OH-) )>c(Cl-)>c(H+)>c(OH-) |
D.d点溶液中存在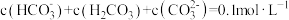 |
您最近半年使用:0次



