(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为__________ 、_______ 。
(2)用甲烷制取氢气的两步反应的能量变化如下图所示:
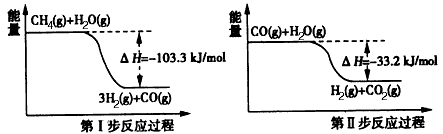
甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是________________ 。
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5KJ/mol
②NH2CO2NH4(s)= CO(NH2)2(s) +H2O(g) △H=+116.5KJ/mol
③H2O(l)=H2O(g) △H=+44KJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式__________________ 。
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为_________________ 。
(2)用甲烷制取氢气的两步反应的能量变化如下图所示:

甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5KJ/mol
②NH2CO2NH4(s)= CO(NH2)2(s) +H2O(g) △H=+116.5KJ/mol
③H2O(l)=H2O(g) △H=+44KJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为
更新时间:2017-09-07 11:01:39
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】Ⅰ.CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
(1)已知CH3OH(g)+ O2(g)
O2(g) CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是
CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是_____________ (填字母)。
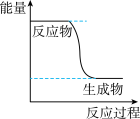
a.CH3OH转变成H2的过程是一个吸收能量的过程
b.H2的生成速率与CH3OH的消耗速率之比为1∶2
c.化学变化不仅有新物质生成,同时也一定有能量变化
d.1 mol H—O键断裂的同时2 mol C=O键断裂,则反应达最大限度
(2)某温度下,将5 mol CH3OH和2 mol O2充入2 L的密闭容器中,经过4 min反应达到平衡,测得c(O2)=0.2 mol·L-1,4 min内平均反应速率v(H2)=_______ ,则CH3OH的转化率为_______ 。
(3)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。其中负极反应式为_________ ,下列说法正确的是_______ (填序号)。
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4 g CH3OH转移1.2 mol电子
(4)已知断开1 mol H—H键吸收的能量为436 kJ,形成1 mol H—N键放出的能量为391 kJ,根据化学方程式N2+3H2 2NH3,反应完1 mol N2放出的能量为92.4 kJ,则断开1 mol N≡N键需吸收的能量是
2NH3,反应完1 mol N2放出的能量为92.4 kJ,则断开1 mol N≡N键需吸收的能量是______________ kJ。
Ⅱ.将等物质的量的A和B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),5 min 后测得c(D)=0.5 mol·L-1,c(A)∶c(B)=1∶2,C的反应速率是 0.15 mol·L-1·min-1。
xC(g)+2D(g),5 min 后测得c(D)=0.5 mol·L-1,c(A)∶c(B)=1∶2,C的反应速率是 0.15 mol·L-1·min-1。
(5)x=________ 。
(6)A在5 min末的浓度是________ 。
(7)此时容器内的压强与开始时之比为__________________ 。
(1)已知CH3OH(g)+
 O2(g)
O2(g) CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是
CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是
a.CH3OH转变成H2的过程是一个吸收能量的过程
b.H2的生成速率与CH3OH的消耗速率之比为1∶2
c.化学变化不仅有新物质生成,同时也一定有能量变化
d.1 mol H—O键断裂的同时2 mol C=O键断裂,则反应达最大限度
(2)某温度下,将5 mol CH3OH和2 mol O2充入2 L的密闭容器中,经过4 min反应达到平衡,测得c(O2)=0.2 mol·L-1,4 min内平均反应速率v(H2)=
(3)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。其中负极反应式为
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4 g CH3OH转移1.2 mol电子
(4)已知断开1 mol H—H键吸收的能量为436 kJ,形成1 mol H—N键放出的能量为391 kJ,根据化学方程式N2+3H2
 2NH3,反应完1 mol N2放出的能量为92.4 kJ,则断开1 mol N≡N键需吸收的能量是
2NH3,反应完1 mol N2放出的能量为92.4 kJ,则断开1 mol N≡N键需吸收的能量是Ⅱ.将等物质的量的A和B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)
 xC(g)+2D(g),5 min 后测得c(D)=0.5 mol·L-1,c(A)∶c(B)=1∶2,C的反应速率是 0.15 mol·L-1·min-1。
xC(g)+2D(g),5 min 后测得c(D)=0.5 mol·L-1,c(A)∶c(B)=1∶2,C的反应速率是 0.15 mol·L-1·min-1。(5)x=
(6)A在5 min末的浓度是
(7)此时容器内的压强与开始时之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】铁及其化合物在工业上有许多用途。回答下列有关问题:
(1)FeCl3可用于金属蚀刻、污水处理等。工业生产中FeCl3可由NaClO3氧化酸性FeCl2废液(含有的溶质为FeCl2、FeCl3、HCl)制备。
①写出NaClO3氧化酸性FeCl2废液的离子方程式:_______________ 。
②测得pH=2的FeCl2废液中,c(Cl-)=5.3×10-2mol· L-1,c(Fe3+)=1.0×10-3mol· L-1,则c(Fe2+)=____ mol· L-1,若在FeCl3的某次生产中处理了1m3该FeCl2废液,则反应中转移的电子为_________ mol。
(2)铁系氧化物材料在五金器材的抛光、光学仪器和玉石的磨光材料、吸波材料、半导体材料等方面得以广泛应用。在空气中加热FeCO3可制得铁系氧化物材料。已知:
①4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648kJ·mol-1;
②C(s)+O2(g)= CO2(g) ΔH=-393kJ·mol-1;
③2Fe(s)+2C(s) +3O2(g) =2FeCO3(s) ΔH=-1480kJ·mol-1;
则在空气中加热FeCO3生成铁系氧化物Fe2O3的热化学方程式为_____________ 。
(3)已知在某种含铁催化剂作用下发生下列反应;CO(g)+3H2(g) CH4(g)+ H2O (g) ΔH<0。
CH4(g)+ H2O (g) ΔH<0。
一定温度下和压强条件下,把1molCO和3molH2加入压强为P0的恒压密闭容器中,测得不同时间CO的体积分数 (CO)如下表:
(CO)如下表:
①当______ 不再发生变化时(写出一条即可),则表明CO(g)+3H2(g)  CH4(g)+ H2O (g)达到平衡。
CH4(g)+ H2O (g)达到平衡。
②达到平衡时CO的转化率为________ ;若用平衡分压代替平衡浓度,则该温度下的平衡常数K=____ (已知:气体分压=气体总压×体积分数)。
③若下图中表示该反应中CO的平衡转化率与温度、压强的关系。图中温度T1、T2、T3由高到低的顺序是______________ 。
(1)FeCl3可用于金属蚀刻、污水处理等。工业生产中FeCl3可由NaClO3氧化酸性FeCl2废液(含有的溶质为FeCl2、FeCl3、HCl)制备。
①写出NaClO3氧化酸性FeCl2废液的离子方程式:
②测得pH=2的FeCl2废液中,c(Cl-)=5.3×10-2mol· L-1,c(Fe3+)=1.0×10-3mol· L-1,则c(Fe2+)=
(2)铁系氧化物材料在五金器材的抛光、光学仪器和玉石的磨光材料、吸波材料、半导体材料等方面得以广泛应用。在空气中加热FeCO3可制得铁系氧化物材料。已知:
①4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648kJ·mol-1;
②C(s)+O2(g)= CO2(g) ΔH=-393kJ·mol-1;
③2Fe(s)+2C(s) +3O2(g) =2FeCO3(s) ΔH=-1480kJ·mol-1;
则在空气中加热FeCO3生成铁系氧化物Fe2O3的热化学方程式为
(3)已知在某种含铁催化剂作用下发生下列反应;CO(g)+3H2(g)
 CH4(g)+ H2O (g) ΔH<0。
CH4(g)+ H2O (g) ΔH<0。一定温度下和压强条件下,把1molCO和3molH2加入压强为P0的恒压密闭容器中,测得不同时间CO的体积分数
 (CO)如下表:
(CO)如下表: | t/min | 0 | 10 | 20 | 30 | 40 | 50 |
 (CO) (CO) | 0.250 | 0.230 | 0.214 | 0.202 | 0.200 | 0.200 |
①当
 CH4(g)+ H2O (g)达到平衡。
CH4(g)+ H2O (g)达到平衡。②达到平衡时CO的转化率为
③若下图中表示该反应中CO的平衡转化率与温度、压强的关系。图中温度T1、T2、T3由高到低的顺序是

您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】请由下列三个热化学反应方程式:
 N2(g) +
N2(g) +  H2(g) +
H2(g) + O2(g)= HNO3(g) △H= - 133.86 kJ/mol
O2(g)= HNO3(g) △H= - 133.86 kJ/mol
 N2(g) +
N2(g) +  H2(g) +
H2(g) + O2(g)= HNO3(l) △H = - 173.00 kJ/mol
O2(g)= HNO3(l) △H = - 173.00 kJ/mol
 N2(g) +
N2(g) +  H2(g) +
H2(g) + O2(g)= HNO3(aq,1 mol/L) △H = - 200.36 kJ/mol
O2(g)= HNO3(aq,1 mol/L) △H = - 200.36 kJ/mol
(1)写出HNO3(g)、HNO3(1)分别溶于水形成HNO3(aq,1 mo/L)的热化学方程式_______ 。
(2)若用水稀释浓硝酸成1 mol/L 稀硝酸的△H=a kJ/mol。请写出分别用水将HNO3(g)、HNO3 (l)转变为浓硝酸时的△H 的差值_______ 。
 N2(g) +
N2(g) +  H2(g) +
H2(g) + O2(g)= HNO3(g) △H= - 133.86 kJ/mol
O2(g)= HNO3(g) △H= - 133.86 kJ/mol N2(g) +
N2(g) +  H2(g) +
H2(g) + O2(g)= HNO3(l) △H = - 173.00 kJ/mol
O2(g)= HNO3(l) △H = - 173.00 kJ/mol N2(g) +
N2(g) +  H2(g) +
H2(g) + O2(g)= HNO3(aq,1 mol/L) △H = - 200.36 kJ/mol
O2(g)= HNO3(aq,1 mol/L) △H = - 200.36 kJ/mol(1)写出HNO3(g)、HNO3(1)分别溶于水形成HNO3(aq,1 mo/L)的热化学方程式
(2)若用水稀释浓硝酸成1 mol/L 稀硝酸的△H=a kJ/mol。请写出分别用水将HNO3(g)、HNO3 (l)转变为浓硝酸时的△H 的差值
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为___________ ,A电极的电极反应式为_______ ;反应进行一段时间后溶液C的pH将___ (填“升高”“降低”或“基本不变”)。____ ,负极反应为___________ ;正极反应为_____________________________ 。
(3)熔盐电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32--4e-=4CO2,正极反应式为___________ ,电池总反应式为_______ 。

(3)熔盐电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32--4e-=4CO2,正极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】根据下列原电池的装置图,回答问题:
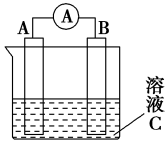
(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且做负极,则A电极上发生的电极反应式为___________ ;反应进行一段时间后溶液C的pH将___________ (填“升高”“降低”或“基本不变”)。
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如上图所示的原电池装置,则负极A极材料为___________ ,正极B极材料为___________ ,溶液C为___________ 。
(3)用CH4和O2组合形成的质子交换膜燃料电池的结构示意图如下:

①则d电极是___________ (填“正极”或“负极”),c电极的反应方程式为___________ 。
②若线路中转移2mol电子,则上述燃料电池,消耗的O2在标准状况下的体积为___________ L。
(4)熔融盐电池具有高的发电效率,因而受到重视。可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃料气,空气与CO2的混合气为正极助燃气,制得在650℃下工作的燃料电池,其负极电极反应式为2CO+2 -4e-=4CO2,则正极电极反应式为
-4e-=4CO2,则正极电极反应式为___________ 。

(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且做负极,则A电极上发生的电极反应式为
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如上图所示的原电池装置,则负极A极材料为
(3)用CH4和O2组合形成的质子交换膜燃料电池的结构示意图如下:

①则d电极是
②若线路中转移2mol电子,则上述燃料电池,消耗的O2在标准状况下的体积为
(4)熔融盐电池具有高的发电效率,因而受到重视。可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃料气,空气与CO2的混合气为正极助燃气,制得在650℃下工作的燃料电池,其负极电极反应式为2CO+2
 -4e-=4CO2,则正极电极反应式为
-4e-=4CO2,则正极电极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】常利用化学反应将化学能转化为热能、电能等其他形式的能量,用于生产、生活。
Ⅰ.用盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。已知:
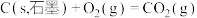


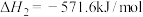

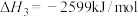
(1)请写出由 和
和 生成
生成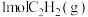 的热化学方程式:
的热化学方程式:__________ 。
Ⅱ.化学能转化为热能的转化率约30%,可见燃料直接燃烧会浪费大量能量。而燃料电池中化学能转化为电能的转化率接近100%。北京冬奥会使用氢氧燃料电池汽车,同时也实现了低碳环保。某种氢氧燃料电池的内部结构示意图如下图。__________ 。
(3)若电路中通过3mol电子,则负极消耗物质的质量为__________ 。
Ⅲ.锂离子电池基于电化学“嵌入/脱嵌”反应原理,替代了传统的“氧化—还原”理念;锰酸锂可充电电池的总反应为:
 向
向__________ 移动(填“正极”或“负极”);
②充电时,电池的阳极反应式为__________ ,若此时转移 ,则石墨电极将增重
,则石墨电极将增重__________ g。
Ⅰ.用盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。已知:
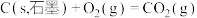


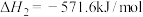

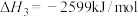
(1)请写出由
 和
和 生成
生成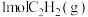 的热化学方程式:
的热化学方程式:Ⅱ.化学能转化为热能的转化率约30%,可见燃料直接燃烧会浪费大量能量。而燃料电池中化学能转化为电能的转化率接近100%。北京冬奥会使用氢氧燃料电池汽车,同时也实现了低碳环保。某种氢氧燃料电池的内部结构示意图如下图。

(3)若电路中通过3mol电子,则负极消耗物质的质量为
Ⅲ.锂离子电池基于电化学“嵌入/脱嵌”反应原理,替代了传统的“氧化—还原”理念;锰酸锂可充电电池的总反应为:

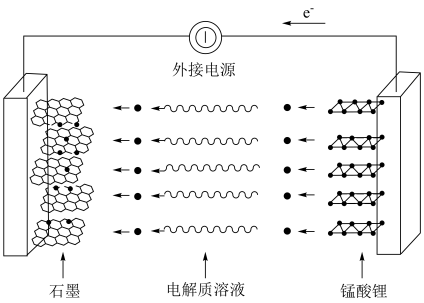
 向
向②充电时,电池的阳极反应式为
 ,则石墨电极将增重
,则石墨电极将增重
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)有下列四种物质:A.青霉素 B.葡萄糖 C.苯甲酸钠 D.柠檬黄
请你根据题意,选择恰当的选项用字母代号填空:
① 常用作食品着色剂的是_________ ;
② 可用作食品防腐剂的是_________ ;
③ 有阻止多种细菌生长的功能的抗生素类药物是_________ ;
④ 可直接进入人体血液补充能量的是_________ 。
(2)防止环境污染和改善生态环境已成为全球的共识。
① 下列物质不会污染室内空气的是( ) (填字母,下同);
A.氮气(N2) B.一氧化碳(CO) C.甲醛(HCHO)
② 工业废水需处理达标后才能排放。下列废水处理的方法不合理的是_________ ;
A.要除去钢铁厂、电镀厂产生的酸性废水,可使用熟石灰[Ca(OH)2]
B.要除去废水中含有的Hg2+离子,可使用硫化钠(Na2S)
C.要除去废水中的悬浮物,可使用氯气
③ 下列有关环境污染防治的叙述中,不正确的是_________ 。
A.推广使用无铅汽油可减少铅污染 B.室外焚烧塑料垃圾可减少大气污染
C. 淘汰含磷洗衣粉可降低水体富营养化程度
(3)材料与社会生活密不可分。
① 在下列材料中,属于无机非金属材料的是_________ ;
A.硬币 B.聚氯乙烯塑料 C.氮化硅陶瓷
② 为防止轮船的船体在海水中被腐蚀,一般在铅身连接______ (填“锌块”或“铜块”);
③ 炒过菜的铁锅未及时洗净易腐蚀出现红褐色锈斑,它是铁锅在潮湿的空气中发生________ 腐蚀造成的(填“化学”或“电化学”)。
请你根据题意,选择恰当的选项用字母代号填空:
① 常用作食品着色剂的是
② 可用作食品防腐剂的是
③ 有阻止多种细菌生长的功能的抗生素类药物是
④ 可直接进入人体血液补充能量的是
(2)防止环境污染和改善生态环境已成为全球的共识。
① 下列物质不会污染室内空气的是
A.氮气(N2) B.一氧化碳(CO) C.甲醛(HCHO)
② 工业废水需处理达标后才能排放。下列废水处理的方法不合理的是
A.要除去钢铁厂、电镀厂产生的酸性废水,可使用熟石灰[Ca(OH)2]
B.要除去废水中含有的Hg2+离子,可使用硫化钠(Na2S)
C.要除去废水中的悬浮物,可使用氯气
③ 下列有关环境污染防治的叙述中,不正确的是
A.推广使用无铅汽油可减少铅污染 B.室外焚烧塑料垃圾可减少大气污染
C. 淘汰含磷洗衣粉可降低水体富营养化程度
(3)材料与社会生活密不可分。
① 在下列材料中,属于无机非金属材料的是
A.硬币 B.聚氯乙烯塑料 C.氮化硅陶瓷
② 为防止轮船的船体在海水中被腐蚀,一般在铅身连接
③ 炒过菜的铁锅未及时洗净易腐蚀出现红褐色锈斑,它是铁锅在潮湿的空气中发生
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】(1)合金是生活中常见的材料。某合金具有密度小、强度高的优良性能,常用于制造门窗框架。该合金中含量最高的金属为_____ 。
(2)在下列材料中,属于无机非金属材料的是_______ (填字母)。
A.硬币 B.聚氯乙烯塑料 C.氮化硅陶瓷
(3)炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑。铁锅的腐蚀主要是由__________ 腐蚀造成的。铁锈的主要成分是_________ (填化学式)
(4)玻璃是一种常用的硅酸盐材料。制备普通玻璃的原料有________ 、________ 和_______ 。
(2)在下列材料中,属于无机非金属材料的是
A.硬币 B.聚氯乙烯塑料 C.氮化硅陶瓷
(3)炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑。铁锅的腐蚀主要是由
(4)玻璃是一种常用的硅酸盐材料。制备普通玻璃的原料有
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】按要求答题:
(l)食品和药物安全是国家高度重视的民生问题。根据题意,用下列选项的字母代号填空。
A.阿司匹林(乙酸水杨酸) B.青霉素 C.抗酸药(氢氧化铝) D.麻黄碱
①治疗胃酸过多,但患有严重的胃溃疡,应该选择_______ ;
②是一种重要的抗生素类药,有阻止多种细菌生长的功能,该药物是_______ ;
③能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是_______ 。
(2)钢铁是目前用量最大、用途最广的合金材料,在潮湿空气中容易发生腐蚀。请写出钢铁发生电化学腐蚀的负极反应式_______________________________________ 。
(3)材料是人类赖以生存的重要物质基础,而化学是材料科学发展的基础。材料种类很多,通常可分为金属材料、无机非金属材料、高分子合成材料及复合材料, 生活中的玻璃、陶瓷、水泥属于上述材料中的______________ ,
(l)食品和药物安全是国家高度重视的民生问题。根据题意,用下列选项的字母代号填空。
A.阿司匹林(乙酸水杨酸) B.青霉素 C.抗酸药(氢氧化铝) D.麻黄碱
①治疗胃酸过多,但患有严重的胃溃疡,应该选择
②是一种重要的抗生素类药,有阻止多种细菌生长的功能,该药物是
③能使发热的病人体温降至正常,并起到缓解疼痛的作用,该药物是
(2)钢铁是目前用量最大、用途最广的合金材料,在潮湿空气中容易发生腐蚀。请写出钢铁发生电化学腐蚀的负极反应式
(3)材料是人类赖以生存的重要物质基础,而化学是材料科学发展的基础。材料种类很多,通常可分为金属材料、无机非金属材料、高分子合成材料及复合材料, 生活中的玻璃、陶瓷、水泥属于上述材料中的
您最近一年使用:0次



