氯化亚铜是重要的铜盐系列化工产品,广泛应用于石油化工、有机合成等行业。CuCl晶体呈白色,微溶于水,不溶于稀盐酸和乙醇,露置于潮湿空气中易水解氧化为绿色的[Cu2(OH)3C1],见光易分解。某研究小组以CuCl2(含少量Fe2+)粗品为原料制取CuCl,设计的合成路线如下:
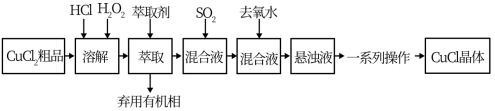
已知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮。
②CuCl在溶液中存在:CuCl(s)+2Cl-(aq) [CuCl3]2-(aq)。
[CuCl3]2-(aq)。
请回答:
(1)下列叙述正确的是__________ 。
A.CuCl2原料中含有的Fe2+等杂质经氧化、萃取几乎都在有机相中被除去
B.加入萃取剂后,混合物转移至分液漏斗中,塞上玻璃塞,如图用力振摇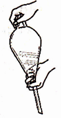
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.用浓盐酸洗涤分液后的有机相时,需在分液漏斗中进行
(2)上述合成路线中,SO2通入混合液的实验装置如下图所示:
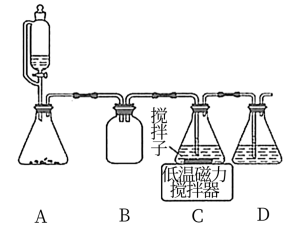
①装置D的作用是_______________ 。
②C中反应的离子方程式为_____________ 。
(3)上述合成路线中,向混合液中加入大量去氧水的目的是________________ 。
(4)上述合成路线中,一系列操作包括:抽滤、洗涤、干燥。干燥时应注意密封、____________ 。
(5)现称取l.200g产品,用硫酸酸化的硫酸铁溶解,并稀释成250mL。每次用移液管移取25.00mL溶液于锥形瓶中,用0.01000,mol·L-1KmnO4溶液滴定平均消耗24.00mL。
①用移液管吸取25.00mL溶液后,把溶液转移到锥形瓶中的具体操作为____________ 。
②产品中CuCl的纯度为__________ (本实验条件下,Cl-难于被MnO4-氧化)。

已知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮。
②CuCl在溶液中存在:CuCl(s)+2Cl-(aq)
 [CuCl3]2-(aq)。
[CuCl3]2-(aq)。请回答:
(1)下列叙述正确的是
A.CuCl2原料中含有的Fe2+等杂质经氧化、萃取几乎都在有机相中被除去
B.加入萃取剂后,混合物转移至分液漏斗中,塞上玻璃塞,如图用力振摇

C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.用浓盐酸洗涤分液后的有机相时,需在分液漏斗中进行
(2)上述合成路线中,SO2通入混合液的实验装置如下图所示:

①装置D的作用是
②C中反应的离子方程式为
(3)上述合成路线中,向混合液中加入大量去氧水的目的是
(4)上述合成路线中,一系列操作包括:抽滤、洗涤、干燥。干燥时应注意密封、
(5)现称取l.200g产品,用硫酸酸化的硫酸铁溶解,并稀释成250mL。每次用移液管移取25.00mL溶液于锥形瓶中,用0.01000,mol·L-1KmnO4溶液滴定平均消耗24.00mL。
①用移液管吸取25.00mL溶液后,把溶液转移到锥形瓶中的具体操作为
②产品中CuCl的纯度为
更新时间:2017-09-21 14:53:59
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】三氯化六氨合钴([Co(NH3)6]Cl3)是一种橙黄色晶体,实验室制备过程如下:
Ⅰ.将研细的6 g CoCl2•6H2O晶体和4 g NH4Cl固体加入锥形瓶中,加水,加热溶解,冷却;
Ⅱ.加入13.5 mL浓氨水,用活性炭作催化剂,混合均匀后逐滴滴加13.5 mL 5% H2O2溶液,水浴加热至50~60℃,保持20 min。用冰浴冷却,过滤,得粗产品;
Ⅲ.将粗产品溶于50 mL热的稀盐酸中,______,向滤液中缓慢加入6.7 mL浓盐酸,有大量橙黄色晶体析出,冰浴冷却后过滤;
Ⅳ.先用冷的2 mol·L−1 HCl溶液洗涤晶体,再用少许乙醇洗涤,干燥,得产品。
(1)[Co(NH3)6]Cl3中Co的化合价是______ 。
(2)CoCl2遇浓氨水生成Co(OH)2沉淀,加入浓氨水前先加入NH4Cl可避免沉淀生成,原因是______ 。
(3)溶液中CoCl2、NH4Cl和浓氨水混合后,与H2O2溶液反应生成[Co(NH3)6]Cl3的化学方程式是______ 。
(4)补全Ⅲ中的操作:______ 。
(5)沉淀滴定法测定制备的产品中Cl-的质量分数:
ⅰ.准确称取a g Ⅳ中的产品,配制成100 mL溶液,移取25 mL溶液于锥形瓶中;
ⅱ.滴加少量0.005 mol·L−1 K2CrO4溶液作为指示剂,用c mol·L−1 AgNO3溶液滴定至终点;
ⅲ.平行测定三次,消耗AgNO3溶液的体积的平均值为v mL,计算晶体中Cl-的质量分数。
已知:溶解度:AgCl 1.3×10−6 mol·L−1,Ag2CrO4(砖红色)6.5×10−5 mol·L−1
①ⅱ中,滴定至终点的现象是______ 。
②制备的晶体中Cl-的质量分数是______ (列计算式,Cl的相对原子质量:35.5)。
Ⅰ.将研细的6 g CoCl2•6H2O晶体和4 g NH4Cl固体加入锥形瓶中,加水,加热溶解,冷却;
Ⅱ.加入13.5 mL浓氨水,用活性炭作催化剂,混合均匀后逐滴滴加13.5 mL 5% H2O2溶液,水浴加热至50~60℃,保持20 min。用冰浴冷却,过滤,得粗产品;
Ⅲ.将粗产品溶于50 mL热的稀盐酸中,______,向滤液中缓慢加入6.7 mL浓盐酸,有大量橙黄色晶体析出,冰浴冷却后过滤;
Ⅳ.先用冷的2 mol·L−1 HCl溶液洗涤晶体,再用少许乙醇洗涤,干燥,得产品。
(1)[Co(NH3)6]Cl3中Co的化合价是
(2)CoCl2遇浓氨水生成Co(OH)2沉淀,加入浓氨水前先加入NH4Cl可避免沉淀生成,原因是
(3)溶液中CoCl2、NH4Cl和浓氨水混合后,与H2O2溶液反应生成[Co(NH3)6]Cl3的化学方程式是
(4)补全Ⅲ中的操作:
(5)沉淀滴定法测定制备的产品中Cl-的质量分数:
ⅰ.准确称取a g Ⅳ中的产品,配制成100 mL溶液,移取25 mL溶液于锥形瓶中;
ⅱ.滴加少量0.005 mol·L−1 K2CrO4溶液作为指示剂,用c mol·L−1 AgNO3溶液滴定至终点;
ⅲ.平行测定三次,消耗AgNO3溶液的体积的平均值为v mL,计算晶体中Cl-的质量分数。
已知:溶解度:AgCl 1.3×10−6 mol·L−1,Ag2CrO4(砖红色)6.5×10−5 mol·L−1
①ⅱ中,滴定至终点的现象是
②制备的晶体中Cl-的质量分数是
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,175℃时分解。
Ⅰ.用硝酸氧化法制备草酸晶体并测定其纯度,制备装置如图所示(加热、固定等装置略去)。
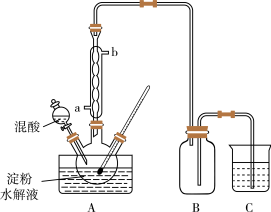
实验步骤如下
①糖化:先将淀粉水解为葡萄糖;
②氧化:在淀粉水解液中加入混酸(质量之比为3:2的65%HNO3与98%H2SO4的混合物),在55~60℃下水浴加热发生反应;
③结晶、蒸发、干燥:反应后溶液经冷却、减压过滤,即得草酸晶体粗产品。
(1)装混酸的仪器名称为________ ;步骤②中,水浴加热的优点为___________________ 。
(2)“②氧化”时发生的主要反应如下,完成下列化学方程式:
___ C6H12O6 + ___ HNO3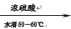
____ +__________ H2C2O4 + 9NO2↑ + 3NO↑+ ______ 。
(3)称取m g草酸晶体粗产品,配成100 mL溶液。取20.00 mL于锥形瓶中,用a moL·L-1KMnO4标准液标定,只发生5H2C2O4 + 2MnO4- + 6H+ = 2Mn2+ + 10CO2↑ + 8H2O反应,消耗KMnO4标准液体积为VmL,则所得草酸晶体(H2C2O4·2H2O)的纯度为___________ 。
Ⅱ.证明草酸晶体分解得到的产物
(4)甲同学选择上述装置验证产物CO2,装置B的主要作用是__________ 。
(5)乙同学认为草酸晶体分解的产物中除了CO2、H2O应该还有CO,为进行验证,选用甲同学实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验。
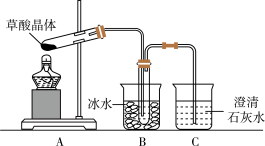
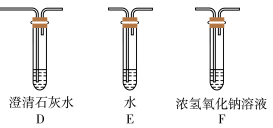
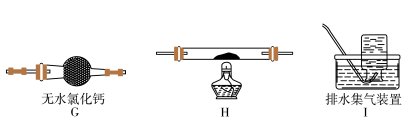
①乙同学的实验装置中,依次连接的合理顺序为A、B、_____________ 。其中装置H反应管中盛有的物质是________________________ 。
②能证明草酸晶体分解产物中有CO的现象是_____________________ 。
Ⅰ.用硝酸氧化法制备草酸晶体并测定其纯度,制备装置如图所示(加热、固定等装置略去)。

实验步骤如下
①糖化:先将淀粉水解为葡萄糖;
②氧化:在淀粉水解液中加入混酸(质量之比为3:2的65%HNO3与98%H2SO4的混合物),在55~60℃下水浴加热发生反应;
③结晶、蒸发、干燥:反应后溶液经冷却、减压过滤,即得草酸晶体粗产品。
(1)装混酸的仪器名称为
(2)“②氧化”时发生的主要反应如下,完成下列化学方程式:
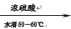
(3)称取m g草酸晶体粗产品,配成100 mL溶液。取20.00 mL于锥形瓶中,用a moL·L-1KMnO4标准液标定,只发生5H2C2O4 + 2MnO4- + 6H+ = 2Mn2+ + 10CO2↑ + 8H2O反应,消耗KMnO4标准液体积为VmL,则所得草酸晶体(H2C2O4·2H2O)的纯度为
Ⅱ.证明草酸晶体分解得到的产物
(4)甲同学选择上述装置验证产物CO2,装置B的主要作用是
(5)乙同学认为草酸晶体分解的产物中除了CO2、H2O应该还有CO,为进行验证,选用甲同学实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验。



①乙同学的实验装置中,依次连接的合理顺序为A、B、
②能证明草酸晶体分解产物中有CO的现象是
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】[CH3CH(OH)COO]2Fe(乳酸亚铁)是一种广泛应用于食品的铁强化剂,可由乳酸与FeCO3反应制得。兴趣小组在实验室按下列步骤制备乳酸亚铁晶体并进行含量测定。回答下列问题:
I.制备FeCO3:
兴趣小组利用FeSO4(用废铁屑和稀硫酸反应制得)和NH4HCO3在如图装置制备FeCO3:
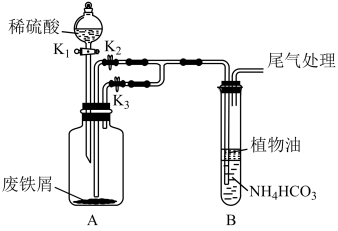
(1)植物油的作用是_______ 。
(2)实验过程中,将生成的FeSO4溶液和NH4HCO3溶液混合的操作是_______ 。
(3)该实验制备FeCO3的离子方程式为_______ 。
(4)经过滤、洗涤得到FeCO3,久置后,发现在盛有FeCO3试剂瓶的瓶口有红褐色物质,其原因是_______ (用化学方程式解释)。
Ⅱ.制备乳酸亚铁:
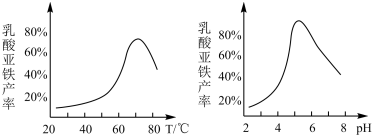
(5)兴趣小组向FeCO3固体中加入乳酸溶液,在一定条件下搅拌使之充分反应,并测得反应溶液的pH、温度对乳酸亚铁产率的影响如图所示,则反应时适宜的加方式为_______ ;溶液pH控制在5~6之间乳酸亚铁产率较高的主要原因是_______ 。
Ⅲ.测定乳酸亚铁的纯度:
(6)兴趣小组通过用硫酸铈铵(NH4)4Ce(SO4)4滴定法测定样品中Fe2+的含量来计算乳酸亚铁固体样品纯度(反应中Ce元素被还原为Ce3+)。称取3.0g样品配制成100.00mL溶液,取该溶液25.00mL,将0.1000mol/L(NH4)4Ce(SO4)4标准溶液装入_______ 中(填A或B),反复滴定2~3次,平均消耗(NH4)4Ce(SO4)4标准溶液30.00mL,则样品中乳酸亚铁的纯度为_______ 。
A.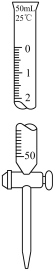 B.
B.
I.制备FeCO3:
兴趣小组利用FeSO4(用废铁屑和稀硫酸反应制得)和NH4HCO3在如图装置制备FeCO3:

(1)植物油的作用是
(2)实验过程中,将生成的FeSO4溶液和NH4HCO3溶液混合的操作是
(3)该实验制备FeCO3的离子方程式为
(4)经过滤、洗涤得到FeCO3,久置后,发现在盛有FeCO3试剂瓶的瓶口有红褐色物质,其原因是
Ⅱ.制备乳酸亚铁:
(5)兴趣小组向FeCO3固体中加入乳酸溶液,在一定条件下搅拌使之充分反应,并测得反应溶液的pH、温度对乳酸亚铁产率的影响如图所示,则反应时适宜的加方式为

Ⅲ.测定乳酸亚铁的纯度:
(6)兴趣小组通过用硫酸铈铵(NH4)4Ce(SO4)4滴定法测定样品中Fe2+的含量来计算乳酸亚铁固体样品纯度(反应中Ce元素被还原为Ce3+)。称取3.0g样品配制成100.00mL溶液,取该溶液25.00mL,将0.1000mol/L(NH4)4Ce(SO4)4标准溶液装入
A.
 B.
B.
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】Na2S2O4俗称保险粉,大量用于漂白纸张和印染工业。某学习小组用下列方法制备该物质。
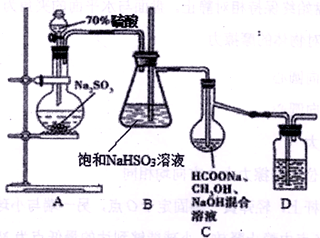
①把甲酸溶于甲醇溶液,再和足量的NaOH溶液混合配成溶液;
②制取SO2并通入上述溶液中,一段时间后可获得保险粉。
(已知:Na2S2O4在水中溶解度较大,在甲醇中溶解度较小)装置如上图所示
(1)A装置中反应的化学方程式为__________________________ ,为了液体顺利下滴A装置中的分液漏斗改为__________ (仪器名称)更合适。
(2)B装置的作用为_____________________________ , D中盛放的试剂为 ___________________ 。
(3)C装置的主要玻璃仪器名称为_________ ,足量SO2气体通入混合溶液中,生成保险粉的同时生成一种气体,则C中反应的化学方程式为______________________________ 。
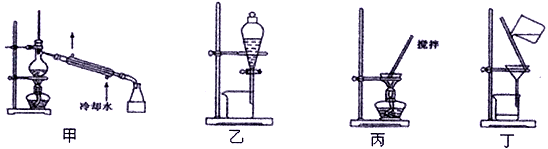
(4)分离C装置中产品Na2S2O4时应选用下列装置__________ (填甲、乙、丙、丁,下同),回收甲醇的装置为_______________________ 。
(5)保险粉在空气中容易吸收氧气而发生氧化.其方程式可能为:
①2 Na2S2O4+O2+2H2O=4NaHSO3 或②Na2S2O4+O2+H2O=NaHSO3+NaHSO4
请设计实验证明氧化时有反应②发生:__________________________________________ 。

①把甲酸溶于甲醇溶液,再和足量的NaOH溶液混合配成溶液;
②制取SO2并通入上述溶液中,一段时间后可获得保险粉。
(已知:Na2S2O4在水中溶解度较大,在甲醇中溶解度较小)装置如上图所示
(1)A装置中反应的化学方程式为
(2)B装置的作用为
(3)C装置的主要玻璃仪器名称为
(4)分离C装置中产品Na2S2O4时应选用下列装置

(5)保险粉在空气中容易吸收氧气而发生氧化.其方程式可能为:
①2 Na2S2O4+O2+2H2O=4NaHSO3 或②Na2S2O4+O2+H2O=NaHSO3+NaHSO4
请设计实验证明氧化时有反应②发生:
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】KMnO4在实验室和工业上均有重要应用,其实验室制备的过程如下:
资料:K2MnO4为暗绿色固体,在强碱性溶液中稳定,碱性减弱时易发生歧化反应(Mn的化合价既升高又降低)。
Ⅰ.将MnO2与KOH固体混合,通入氧气充分灼烧,生成暗绿色熔融态物质。
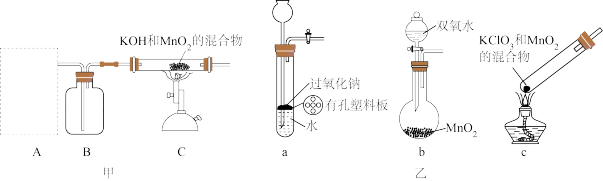
Ⅱ.冷却,将固体研细,用稀KOH溶液浸取,过滤,得暗绿色溶液。
II.向暗绿色溶液中加入适量1mol/LH3PO4溶液调pH值至11,直至K2MnO4全部歧化,过滤分离黑色滤渣和滤液。
Ⅳ.将滤液蒸发浓缩,冷却结晶,过滤,洗涤,在80℃烘箱中干燥3h,得KMnO4固体。
Ⅴ.产品分析。
(1)步骤Ⅰ,装置A应选用图乙中的________ (填“a”、“b”或“c”),装置B中所盛试剂的名称为______ 。
(2)步骤Ⅱ,浸取时用稀KOH溶液的原因是__________________ 。
(3)步骤Ⅲ,粗略判断全部歧化的现象是____________ ,歧化的离子方程式为______________ 。
(4)步骤Ⅳ,不选用更高温度的原因是__________________ 。
(5)步骤Ⅴ,利用H2C2O4标准溶液测定KMnO4的纯度[已知:M(KMnO4)=158g/mol]
①溶液配制:称取1.000g的KMnO4固体样品配成100mL的溶液。
②滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):检漏→蒸馏水洗涤→_____ →_____ →_____ →_____ →_____ →开始滴定。
A烘干
B装入滴定液至零刻度以上
C调整滴定液液面至零刻度或零刻度以下
D用洗耳球吹出润洗液
E排除气泡
F用滴定液润洗2至3次
G记录起始读数
③滴定:移取25.00mLKMnO4溶液于锥形瓶中,加少量硫酸酸化,用cmol/L的H2C2O4标准溶液滴定,发生反应:H2C2O4 +MnO +H+Mn2++CO2↑+H2O(未配平),当溶液紫色褪色且半分钟内不变色即为终点,平行滴定3次,H2C2O4溶液的平均用量为VmL,则样品纯度表达式为
+H+Mn2++CO2↑+H2O(未配平),当溶液紫色褪色且半分钟内不变色即为终点,平行滴定3次,H2C2O4溶液的平均用量为VmL,则样品纯度表达式为_______ (不必化简)。
资料:K2MnO4为暗绿色固体,在强碱性溶液中稳定,碱性减弱时易发生歧化反应(Mn的化合价既升高又降低)。
Ⅰ.将MnO2与KOH固体混合,通入氧气充分灼烧,生成暗绿色熔融态物质。

Ⅱ.冷却,将固体研细,用稀KOH溶液浸取,过滤,得暗绿色溶液。
II.向暗绿色溶液中加入适量1mol/LH3PO4溶液调pH值至11,直至K2MnO4全部歧化,过滤分离黑色滤渣和滤液。
Ⅳ.将滤液蒸发浓缩,冷却结晶,过滤,洗涤,在80℃烘箱中干燥3h,得KMnO4固体。
Ⅴ.产品分析。
(1)步骤Ⅰ,装置A应选用图乙中的
(2)步骤Ⅱ,浸取时用稀KOH溶液的原因是
(3)步骤Ⅲ,粗略判断全部歧化的现象是
(4)步骤Ⅳ,不选用更高温度的原因是
(5)步骤Ⅴ,利用H2C2O4标准溶液测定KMnO4的纯度[已知:M(KMnO4)=158g/mol]
①溶液配制:称取1.000g的KMnO4固体样品配成100mL的溶液。
②滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):检漏→蒸馏水洗涤→
A烘干
B装入滴定液至零刻度以上
C调整滴定液液面至零刻度或零刻度以下
D用洗耳球吹出润洗液
E排除气泡
F用滴定液润洗2至3次
G记录起始读数
③滴定:移取25.00mLKMnO4溶液于锥形瓶中,加少量硫酸酸化,用cmol/L的H2C2O4标准溶液滴定,发生反应:H2C2O4 +MnO
 +H+Mn2++CO2↑+H2O(未配平),当溶液紫色褪色且半分钟内不变色即为终点,平行滴定3次,H2C2O4溶液的平均用量为VmL,则样品纯度表达式为
+H+Mn2++CO2↑+H2O(未配平),当溶液紫色褪色且半分钟内不变色即为终点,平行滴定3次,H2C2O4溶液的平均用量为VmL,则样品纯度表达式为
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】连二亚硫酸钠(Na2S2O4),也称为保险粉,Na2S2O4)易溶于水,难溶于甲醇,具有极强的还原性,易被空气氧化,在碱性介质中稳定。工业上常用制备Na2S2O4的方法有I.锌粉法、II.甲酸钠法。
I.实验室模拟锌粉法的装置如图(加热等辅助仪器略去)

反应原理为:
Zn+2SO2=ZnS2O4
ZnS2O4+2NaOH=Zn(OH)2↓+Na2S2O4
(1)连接好装置后,首先要检验装置的气密性,方法为___ 。
(2)①装置A中分液漏斗中的试剂是___ 。
A.稀硫酸 B.98%的硫酸 C.70%的硫酸
②装置B中反应结束后,取出混合物进行以下操作,得到Na2S2O4晶体。
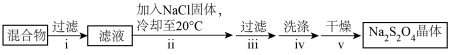
操作ii加入NaCl固体的目的是__ (用平衡移动原理解释),操作iv洗涤中选用的试剂是__ (填“水”或“甲醇”)。
(3)实验室保存新制Na2S2O4晶体的方法是___ 。
II.实验室模拟甲酸钠法的装置如图(加热等辅助仪器略去)

第一步,在F装置中加入甲酸钠、氢氧化钠、甲醇(溶剂)的混合液;
第二步,向装置F中通入二氧化硫;
第三步,75℃加热一段时间,装置中有晶体析出,并产生大量气体:
第四步,过滤、洗涤、干燥,收集产品。
(4)装置F的名称___ ,在其中制备连二亚硫酸钠的离子方程式可表示为___ 。
(5)已知某温度下,H2SO3的电离常数为K1≈1.5×10-2,K2≈1.0×10-7,H2CO3的电离常数为K1ˊ≈4.4×10-7,K2ˊ≈4.7×10-11。装置G用于吸收未反应完的SO2和反应产生的CO2。该温度下当G溶液中HSO 、SO
、SO 离子浓度相等时,溶液的pH约为
离子浓度相等时,溶液的pH约为___ 。
(6)甲酸钠法于1968年实现工业化,继而逐渐替代了锌粉法生产连二亚硫酸钠。与锌粉法相比,甲酸钠法的优点在于___ 。
I.实验室模拟锌粉法的装置如图(加热等辅助仪器略去)

反应原理为:
Zn+2SO2=ZnS2O4
ZnS2O4+2NaOH=Zn(OH)2↓+Na2S2O4
(1)连接好装置后,首先要检验装置的气密性,方法为
(2)①装置A中分液漏斗中的试剂是
A.稀硫酸 B.98%的硫酸 C.70%的硫酸
②装置B中反应结束后,取出混合物进行以下操作,得到Na2S2O4晶体。

操作ii加入NaCl固体的目的是
(3)实验室保存新制Na2S2O4晶体的方法是
II.实验室模拟甲酸钠法的装置如图(加热等辅助仪器略去)

第一步,在F装置中加入甲酸钠、氢氧化钠、甲醇(溶剂)的混合液;
第二步,向装置F中通入二氧化硫;
第三步,75℃加热一段时间,装置中有晶体析出,并产生大量气体:
第四步,过滤、洗涤、干燥,收集产品。
(4)装置F的名称
(5)已知某温度下,H2SO3的电离常数为K1≈1.5×10-2,K2≈1.0×10-7,H2CO3的电离常数为K1ˊ≈4.4×10-7,K2ˊ≈4.7×10-11。装置G用于吸收未反应完的SO2和反应产生的CO2。该温度下当G溶液中HSO
 、SO
、SO 离子浓度相等时,溶液的pH约为
离子浓度相等时,溶液的pH约为(6)甲酸钠法于1968年实现工业化,继而逐渐替代了锌粉法生产连二亚硫酸钠。与锌粉法相比,甲酸钠法的优点在于
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行了有关实验:
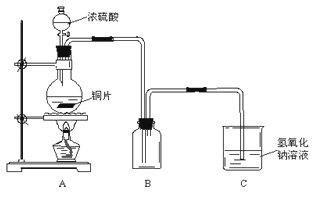
(1)实验中他们取6.4g铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜跟浓硫酸反应的化学方程式:___________________________________________
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是:____________________ 。
③下列药品中能够用证明反应结束后的烧瓶中确有余酸的是:________ (填写字母编号)。
A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(2)为定量测定余酸的物质的量浓度,某位同学进行了如下设计:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。他认为测定SO2的量的方法有多种,请问下列实验方案中可行的是__________ (填写字母编号)。其中计算结果余酸物质的量浓度比实际偏高的是_______________ (填写字母编号)
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量氯化钡溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
E.将装置A产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀(已知:硝酸具有强氧化性)
若A项不可行,请写出改进的方法:___________________ (若A项可行则该空写“不用改进”)

(1)实验中他们取6.4g铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜跟浓硫酸反应的化学方程式:
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是:
③下列药品中能够用证明反应结束后的烧瓶中确有余酸的是:
A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(2)为定量测定余酸的物质的量浓度,某位同学进行了如下设计:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。他认为测定SO2的量的方法有多种,请问下列实验方案中可行的是
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量氯化钡溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
E.将装置A产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀(已知:硝酸具有强氧化性)
若A项不可行,请写出改进的方法:
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】甲,乙两同学用图所示装置进行实验探究硝酸与铁反应的产物。

文献记载:
I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、﹣3价等氮的化合物。
Ⅱ.FeSO4+NO⇌Fe(NO)SO4(棕色)△H<0.
Ⅲ.NO2和NO都能被KMnO4氧化吸收
Ⅳ.铁氰化钾化学式为K3[Fe(CN)6]:亚铁氰化钾化学式为K4[Fe(CN)6]
3Fe2++2[Fe(CN)6]3﹣═Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4﹣═Fe4[Fe(CN)6]3↓(蓝色沉淀)
甲的实验操作和现象记录如下:
请回答下列问题:
(1)滴入浓硝酸加热前没有明显现象的原因是____________ 。
A.常温下铁和浓硝酸不反应
B. 铁遇浓硝酸形成致密氧化膜,阻止反应进一步发生
C.反应需要催化剂
(2)甲的实验操作中通入CO2的主要目的是__________ 。
A. 排除反应体系中的空气 ,防止干扰
B. 将产生的气体压入后续装置吸收
C.维持系统内压强平衡
(3)甲取少量B中溶液,加热,现象是_________ 。
A.棕色溶液变浅绿色B.棕色溶液变无色C.有红棕色气体逸出
D.有无色气体逸出E.产生红褐色沉淀
(4)乙认为有NO生成的证据不足.乙仍采用该装置和操作进行对照实验,浓硝酸换成稀硝酸,证明有NO生成的实验现象是A中___________________ B中。
(5)将A所得溶液稀释至500mL,取少量稀释后的溶液调节pH后,滴加铁氰化钾溶液有蓝色沉淀生成。另取稀释后的溶液25.00mL加入过量的KI固体,充分反应后pH至7左右,滴入几滴淀粉溶液做指示剂,用0.25mol/L Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3溶液16.00mL.(已知:I2+2S2O32﹣=2I﹣+S4O62﹣),则A中所得溶液的c(Fe3+)=______ mol/L。

文献记载:
I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、﹣3价等氮的化合物。
Ⅱ.FeSO4+NO⇌Fe(NO)SO4(棕色)△H<0.
Ⅲ.NO2和NO都能被KMnO4氧化吸收
Ⅳ.铁氰化钾化学式为K3[Fe(CN)6]:亚铁氰化钾化学式为K4[Fe(CN)6]
3Fe2++2[Fe(CN)6]3﹣═Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4﹣═Fe4[Fe(CN)6]3↓(蓝色沉淀)
甲的实验操作和现象记录如下:
| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅. ②反应停止后,A中无固体剩余,得100mL的溶液 |
(1)滴入浓硝酸加热前没有明显现象的原因是
A.常温下铁和浓硝酸不反应
B. 铁遇浓硝酸形成致密氧化膜,阻止反应进一步发生
C.反应需要催化剂
(2)甲的实验操作中通入CO2的主要目的是
A. 排除反应体系中的空气 ,防止干扰
B. 将产生的气体压入后续装置吸收
C.维持系统内压强平衡
(3)甲取少量B中溶液,加热,现象是
A.棕色溶液变浅绿色B.棕色溶液变无色C.有红棕色气体逸出
D.有无色气体逸出E.产生红褐色沉淀
(4)乙认为有NO生成的证据不足.乙仍采用该装置和操作进行对照实验,浓硝酸换成稀硝酸,证明有NO生成的实验现象是A中
(5)将A所得溶液稀释至500mL,取少量稀释后的溶液调节pH后,滴加铁氰化钾溶液有蓝色沉淀生成。另取稀释后的溶液25.00mL加入过量的KI固体,充分反应后pH至7左右,滴入几滴淀粉溶液做指示剂,用0.25mol/L Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3溶液16.00mL.(已知:I2+2S2O32﹣=2I﹣+S4O62﹣),则A中所得溶液的c(Fe3+)=
您最近半年使用:0次
【推荐3】I.为探究难溶性盐X(仅含三种元素)的组成和性质,设计并完成如下实验:
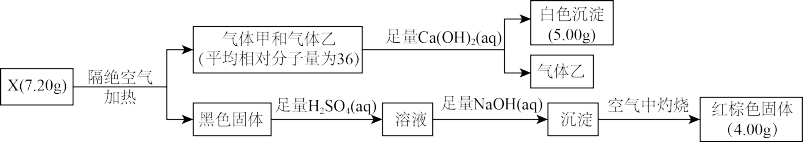
已知:气体甲和气体乙组成元素相同。
请回答:
(1)气体乙的摩尔质量是_________ 。
(2)写出X在隔绝空气条件下加热分解的化学方程式_______________ 。
Ⅱ.工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4,SiCl4经提纯后用氢气还原得高纯硅。以下是实验室制备SiCl4的装置示意图(注:SiCl4遇水易水解)。

请回答下列问题:
(3)D装置的作用_______________ 。
(4)装置A的硬质玻璃管中发生反应的化学方程式是________________ 。
(5)C中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和 。以下是探究该吸收液中可能存在其他酸根离子(忽略空气中CO2的影响)的实验。
。以下是探究该吸收液中可能存在其他酸根离子(忽略空气中CO2的影响)的实验。
【提出假设】假设1:只有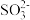 ;假设2:只有ClO-。假设3:……
;假设2:只有ClO-。假设3:……
【设计方案】取少量吸收液于试管中,滴加3 mol·L-1 H2SO4至溶液呈酸性,向试管中滴加_______ 溶液,若溶液变为蓝色,则假设2成立。

已知:气体甲和气体乙组成元素相同。
请回答:
(1)气体乙的摩尔质量是
(2)写出X在隔绝空气条件下加热分解的化学方程式
Ⅱ.工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4,SiCl4经提纯后用氢气还原得高纯硅。以下是实验室制备SiCl4的装置示意图(注:SiCl4遇水易水解)。

请回答下列问题:
(3)D装置的作用
(4)装置A的硬质玻璃管中发生反应的化学方程式是
(5)C中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和
 。以下是探究该吸收液中可能存在其他酸根离子(忽略空气中CO2的影响)的实验。
。以下是探究该吸收液中可能存在其他酸根离子(忽略空气中CO2的影响)的实验。【提出假设】假设1:只有
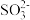 ;假设2:只有ClO-。假设3:……
;假设2:只有ClO-。假设3:……【设计方案】取少量吸收液于试管中,滴加3 mol·L-1 H2SO4至溶液呈酸性,向试管中滴加
您最近半年使用:0次



