根据信息回答以下与金属元素相关的问题。
I .镁、钙和锶(Sr)都属于碱土金属,具有相似的化学性质。
(1)钙在周期表中的位置为__________ 。锶比钙的金属性更强,它们的单质都能和水反应放出氢气,则锶与水反应的化学方程式为_____________ 。颗粒状的单质锶与稀硫酸反应,反应现象不如钠和水反应那么剧烈,原因是__________ 。
(2)锶在一定条件下分别与N2、H2发生反应,生成Y、Z两种锶的化合物,Y、Z与水反应均可放出气体。0.0lmolY溶于l00mL盐酸恰好完全反应,生成氯化物混合溶液,则盐酸的物质的量浓度为___________ , Z的电子式为_____________________ 。
II. KMnO4常用作氧化剂、防腐剂、消毒剂、漂白剂和水处理剂等。
(3)工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4,化学方程式为_________________ 。此过程不用瓷坩埚的原因是_________________________ 。
(4)高锰酸钾在酸性介质中还原产物为Mn2+,废液中c(Mn2+)浓度较大时会污染水体。实验室可以用过二硫酸铵[(NH4)2S2O8]溶液检验废水中Mn2+,实验现象是溶液变紫红色(还原产物为 ),写出检验Mn2+的离子方程式
),写出检验Mn2+的离子方程式_________________ 。
I .镁、钙和锶(Sr)都属于碱土金属,具有相似的化学性质。
(1)钙在周期表中的位置为
(2)锶在一定条件下分别与N2、H2发生反应,生成Y、Z两种锶的化合物,Y、Z与水反应均可放出气体。0.0lmolY溶于l00mL盐酸恰好完全反应,生成氯化物混合溶液,则盐酸的物质的量浓度为
II. KMnO4常用作氧化剂、防腐剂、消毒剂、漂白剂和水处理剂等。
(3)工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4,化学方程式为
(4)高锰酸钾在酸性介质中还原产物为Mn2+,废液中c(Mn2+)浓度较大时会污染水体。实验室可以用过二硫酸铵[(NH4)2S2O8]溶液检验废水中Mn2+,实验现象是溶液变紫红色(还原产物为
 ),写出检验Mn2+的离子方程式
),写出检验Mn2+的离子方程式
17-18高三上·重庆·阶段练习 查看更多[2]
更新时间:2017-10-12 20:57:49
|
相似题推荐
填空题
|
较难
(0.4)
【推荐1】按要求回答下列问题:
(1)反应Cl2+H2O⇌H++Cl-+HClO其化学平衡常数的K表达式为:_________
(2)常温下,向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是______
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中 不变
不变
D.溶液中 减小
减小
(3)硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离.但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4-⇌H++SO42-.
请据此回答下列有关问题:
①Na2SO4溶液呈______ (填“弱酸性”、“中性”或“弱碱性”).
②写出下列反应的离子方程式
H2SO4溶液与BaCl2溶液反应______ ;
H2SO4溶液与Na2SO4溶液反应______ .
③在0.1mol•L-1的Na2SO4溶液中,下列粒子浓度关系式正确的是______ .(填编号)
A.c(SO42-)+c(HSO4-)=0.1mol•L-1
B.c(SO42-)+c(HSO4-)=2c(Na+)
C.c(OH-)=c(H+)+c(HSO4-)
D.c(Na+)+c(H+)=c(OH-)+c(HSO4-)
(1)反应Cl2+H2O⇌H++Cl-+HClO其化学平衡常数的K表达式为:
(2)常温下,向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中
 不变
不变D.溶液中
 减小
减小(3)硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离.但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4=H++HSO4-,HSO4-⇌H++SO42-.
请据此回答下列有关问题:
①Na2SO4溶液呈
②写出下列反应的离子方程式
H2SO4溶液与BaCl2溶液反应
H2SO4溶液与Na2SO4溶液反应
③在0.1mol•L-1的Na2SO4溶液中,下列粒子浓度关系式正确的是
A.c(SO42-)+c(HSO4-)=0.1mol•L-1
B.c(SO42-)+c(HSO4-)=2c(Na+)
C.c(OH-)=c(H+)+c(HSO4-)
D.c(Na+)+c(H+)=c(OH-)+c(HSO4-)
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】短周期元素 a~g 在表中的位置如右表,请回答下列问题:
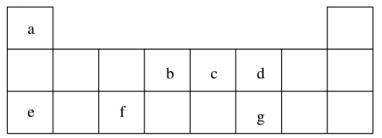
(1)d、e元素常见离子的半径由大到小的顺序为(用化学式表示)__________ ;b、c两元素非金属性较强的是(写元素符号)_________ ,写出能证明这一结论的一个化学方程式_____________ 。
(2)下列有关说法正确的是( )
A.e在 d2 中燃烧,生成e2d
B.加热熔化eda时不可用Al2O3坩埚,可用瓷坩埚
C.将 gd2 通入溴水中,溴水褪色,体现了gd2 的漂白性
D.将打磨过的 f 置于酒精灯上点燃,观察到f 熔化但未见液滴滴落
(3)上述元素可组成盐 R:ca4f(gd4)2和盐S:ca4agd4。
①相同条件下,0.1 mol·L-1盐R中 c(ca4+)_______ (填“=”、 “>”或“<”)0.1 mol·L-1盐S中c(ca4+)。
②R常用作净水剂,其原理为(用离子方程式表示)______________ 。
③向盛有 10 mL 1 mol·L-1盐S溶液的烧杯中滴加1 mol·L-1 NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是_____________ 。
④向盛有 10 mL 1 mol·L-1盐R溶液的烧杯中滴加 1 mol·L-1NaOH溶液 32 mL后,继续滴加至35 mL,写出此时段(32 mL~35 mL)间发生的离子方程式:_____________ 。

(1)d、e元素常见离子的半径由大到小的顺序为(用化学式表示)
(2)下列有关说法正确的是
A.e在 d2 中燃烧,生成e2d
B.加热熔化eda时不可用Al2O3坩埚,可用瓷坩埚
C.将 gd2 通入溴水中,溴水褪色,体现了gd2 的漂白性
D.将打磨过的 f 置于酒精灯上点燃,观察到f 熔化但未见液滴滴落
(3)上述元素可组成盐 R:ca4f(gd4)2和盐S:ca4agd4。
①相同条件下,0.1 mol·L-1盐R中 c(ca4+)
②R常用作净水剂,其原理为(用离子方程式表示)
③向盛有 10 mL 1 mol·L-1盐S溶液的烧杯中滴加1 mol·L-1 NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是
④向盛有 10 mL 1 mol·L-1盐R溶液的烧杯中滴加 1 mol·L-1NaOH溶液 32 mL后,继续滴加至35 mL,写出此时段(32 mL~35 mL)间发生的离子方程式:
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐3】(1)取300 mL 0.2 mol/L的 KI溶液与一定量的酸性 KMnO4 溶液恰好反应,生成等物质的量的 I2和 KIO3,则消耗 KMnO4的物质的量是___ mol。
(2)在 Fe(NO3)3 溶液中加入 Na2SO3 溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是___ ,又变为棕黄色的原因是(用离子方程式解释)____ 。
(3)在 100 mLFeBr2 溶液中通入标准状况下3.36 L Cl2,溶液中有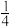 的 Br -被氧化成单质 Br2,则原 FeBr2溶液中 FeBr2 的物质的量浓度为
的 Br -被氧化成单质 Br2,则原 FeBr2溶液中 FeBr2 的物质的量浓度为_____ mol/L。
(4)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3。
①写出该反应的化学方程式____ 。
②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是___ 。
(2)在 Fe(NO3)3 溶液中加入 Na2SO3 溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是
(3)在 100 mLFeBr2 溶液中通入标准状况下3.36 L Cl2,溶液中有
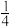 的 Br -被氧化成单质 Br2,则原 FeBr2溶液中 FeBr2 的物质的量浓度为
的 Br -被氧化成单质 Br2,则原 FeBr2溶液中 FeBr2 的物质的量浓度为(4)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3。
①写出该反应的化学方程式
②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2 Na2FeO4+2Na2O+2Na2SO4+O2↑
①该反应中还原剂是_________ ,每生成1mol O2转移_______ mol电子。
②简要说明K2FeO4作为水处理剂时,在水处理过程中所起的作用_________________ 。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:____________________________ 。
②低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),其原因是________________________________________________ 。
(1)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2 Na2FeO4+2Na2O+2Na2SO4+O2↑
①该反应中还原剂是
②简要说明K2FeO4作为水处理剂时,在水处理过程中所起的作用
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:
②低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),其原因是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】硼及硼的化合物有着广泛的用途。请回答下列问题:
(1)已知硼既能与酸又能与碱反应,化学性质类似于铝,请写出硼与氢氧化钠反应的化学方程式___ ;
(2)B2H6是硼的一种气态氢化物,因组成与乙烷(C2H6)相似而被称为乙硼烷。
①经测定B2H6中B原子最外层也满足8电子结构,由此推测B2H6与C2H6分子结构____________ (填“相同”或“不相同”)。
②B2H6是强还原剂,它与水反应生成H3BO3和H2。若有0.1mol B2H6与水完全反应,则产生H2在标准状况下的体积为_______ L。
(3)已知H3BO3是一种白色片状晶体,微溶于水,它的的电离类似于Al(OH)3,可用于制备储氢材料NaBH4涉及的主要反应为:
I.H3BO3+3CH3OH→B(OCH3)3+3H2O II.B(OCH3)3+4NaH→NaBH4+3CH3ONa
①H3BO3为____ (填“一元”、“二元”或“三元”)酸
②B(OCH3)3属于_____ (填序号)类。
A.烃 B.醇 C.酯 D.羧酸
③在碱性条件下,NaBH4与CuSO4溶液反应可得Cu和Na[B(OH)4],其中H元素由-1价升高为+1价,该反应的离子方程式为__ 。
(1)已知硼既能与酸又能与碱反应,化学性质类似于铝,请写出硼与氢氧化钠反应的化学方程式
(2)B2H6是硼的一种气态氢化物,因组成与乙烷(C2H6)相似而被称为乙硼烷。
①经测定B2H6中B原子最外层也满足8电子结构,由此推测B2H6与C2H6分子结构
②B2H6是强还原剂,它与水反应生成H3BO3和H2。若有0.1mol B2H6与水完全反应,则产生H2在标准状况下的体积为
(3)已知H3BO3是一种白色片状晶体,微溶于水,它的的电离类似于Al(OH)3,可用于制备储氢材料NaBH4涉及的主要反应为:
I.H3BO3+3CH3OH→B(OCH3)3+3H2O II.B(OCH3)3+4NaH→NaBH4+3CH3ONa
①H3BO3为
②B(OCH3)3属于
A.烃 B.醇 C.酯 D.羧酸
③在碱性条件下,NaBH4与CuSO4溶液反应可得Cu和Na[B(OH)4],其中H元素由-1价升高为+1价,该反应的离子方程式为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐3】回答下列问题
(1)金属与硝酸反应通常不能生成H2,用3mol/L HNO3与过量铁粉反应,HNO3的还原产物主要是NO,请写出反应的离子方程式:___________ 。
有同学在查阅文献时发现文献有记载:HNO3与铁反应能产生H2。于是其小组进行了金属铁与硝酸反应能否产生H2及其有利条件的探究。
实验I:20℃,将过量铁粉溶于0.5mol·L-1 HNO3中,立即有无色气体生成,充分反应后,溶液几乎无色。
(2)检验气体:方法如图所示。
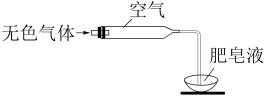
确认气体是H2,不含NO。实验证据是___________ 。
(3)检验溶液:取上层清液,等分两份
①向一份滴加K3[Fe(CN)6]溶液,___________ (填现象),说明含有Fe2+。
②向另一份加入NaOH溶液,产生灰绿色沉淀;加热至沸,有刺激性气味气体逸出,用湿润红色石蕊试纸检验,试纸变蓝。综合①、②,说明实验I中发生的反应有Fe+2H+=Fe2++H2↑,另外还有___________ (写出离子方程式)。
对H2产生的原因提出假设:在稀的酸性溶液中,HNO3中H+的氧化性大于NO ,验证如下:
,验证如下:
(4)实验II:将铜粉溶于0.5mol/L HNO3中。经检测,发现没有___________ 生成,初步证实假设不成立。
(5)再次查阅文献发现:在酸性介质中,尽管电极电势数据显示NO 离子是个颇强的氧化剂,然而动力学原因导致它在稀酸中的反应一般都很慢。于是小组改变条件重复实验I,向2mL 0.5mol·L-1 HNO3中加入过量铁粉,结果如下:
离子是个颇强的氧化剂,然而动力学原因导致它在稀酸中的反应一般都很慢。于是小组改变条件重复实验I,向2mL 0.5mol·L-1 HNO3中加入过量铁粉,结果如下:
经检验,实验III、IV、V中,NO 的还原产物与实验I相同。
的还原产物与实验I相同。
从反应速率的角度解释温度升高H2体积减少的原因___________ 。
(6)综上所述,有利于金属与硝酸反应生成氢气的条件是___________ 。
(1)金属与硝酸反应通常不能生成H2,用3mol/L HNO3与过量铁粉反应,HNO3的还原产物主要是NO,请写出反应的离子方程式:
有同学在查阅文献时发现文献有记载:HNO3与铁反应能产生H2。于是其小组进行了金属铁与硝酸反应能否产生H2及其有利条件的探究。
实验I:20℃,将过量铁粉溶于0.5mol·L-1 HNO3中,立即有无色气体生成,充分反应后,溶液几乎无色。
(2)检验气体:方法如图所示。

确认气体是H2,不含NO。实验证据是
(3)检验溶液:取上层清液,等分两份
①向一份滴加K3[Fe(CN)6]溶液,
②向另一份加入NaOH溶液,产生灰绿色沉淀;加热至沸,有刺激性气味气体逸出,用湿润红色石蕊试纸检验,试纸变蓝。综合①、②,说明实验I中发生的反应有Fe+2H+=Fe2++H2↑,另外还有
对H2产生的原因提出假设:在稀的酸性溶液中,HNO3中H+的氧化性大于NO
 ,验证如下:
,验证如下:(4)实验II:将铜粉溶于0.5mol/L HNO3中。经检测,发现没有
(5)再次查阅文献发现:在酸性介质中,尽管电极电势数据显示NO
 离子是个颇强的氧化剂,然而动力学原因导致它在稀酸中的反应一般都很慢。于是小组改变条件重复实验I,向2mL 0.5mol·L-1 HNO3中加入过量铁粉,结果如下:
离子是个颇强的氧化剂,然而动力学原因导致它在稀酸中的反应一般都很慢。于是小组改变条件重复实验I,向2mL 0.5mol·L-1 HNO3中加入过量铁粉,结果如下:| 实验序号 | Ⅲ | Ⅳ | Ⅴ |
| 温度 | 20℃ | 40℃ | 60℃ |
| 生成H2体积 | 6.0mL | 3.4mL | 2.6mL |
经检验,实验III、IV、V中,NO
 的还原产物与实验I相同。
的还原产物与实验I相同。从反应速率的角度解释温度升高H2体积减少的原因
(6)综上所述,有利于金属与硝酸反应生成氢气的条件是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】硒的原子序数为34,是硫的同主族元素,硒的单质及其化合物用途非常广泛。
(1)硒位于周期表第___ ,周期___ 族。Se2Cl2常用作分析试剂,其电子式为_____ 。
(2)硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是_____ (填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
(3)工业上常从电冶铜的阳极泥中提取纳米硒。向浆化的阳极泥中通入氯气,Cu2Se被溶液中的HClO氧化为H2SeO3及CuCl2,反应中HClO与Cu2Se的物质的量之比为___ 。用氨水中和亚硒酸后得到亚硒酸铵,再向( NH4)2SeO3溶液中加入Na2S2O3可得到纳米硒,同时生成亚硫酸盐,(NH4)2SeO3与Na2S2O3反应生成纳米硒的离子方程式为______ 。
(1)硒位于周期表第
(2)硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
(3)工业上常从电冶铜的阳极泥中提取纳米硒。向浆化的阳极泥中通入氯气,Cu2Se被溶液中的HClO氧化为H2SeO3及CuCl2,反应中HClO与Cu2Se的物质的量之比为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】X、Y是短周期元素,且X的原子序数比Y大4。请填空:
I.若X是金属元素,Y是非金属元素,化合物XY是优质的耐高温材料。
(1)元素Y在元素周期表的位置为 。
(2)粉末状X是制造烟花的重要原料之一,生产粉末状X时,将X蒸气在某种气体中冷却。下列可作为冷却气体的是 。
II.若X是短周期最活泼的金属元素。
(3)Y2H4、O2与XOH溶液组成的电池,其负极的电极反应式(已知:Y2H4可以和O2反应生成Y2和H2O)为 。该电池中OH-移向 极。
(4)25℃时,往a mol·L-1 YH3的水溶液(甲)中滴加0.01 mol·L-1H2SO4溶液(乙),滴加过程中溶液的导电能力 (填“增强”、“减弱”或“不变”),当甲与乙等体积混合后,溶液呈中性(设温度不变),甲中溶质的电离常数Kb= (填表达式,用含a的代数式表示)。
I.若X是金属元素,Y是非金属元素,化合物XY是优质的耐高温材料。
(1)元素Y在元素周期表的位置为 。
(2)粉末状X是制造烟花的重要原料之一,生产粉末状X时,将X蒸气在某种气体中冷却。下列可作为冷却气体的是 。
| A.空气 | B.氮气 | C.氩气 | D.二氧化碳 |
II.若X是短周期最活泼的金属元素。
(3)Y2H4、O2与XOH溶液组成的电池,其负极的电极反应式(已知:Y2H4可以和O2反应生成Y2和H2O)为 。该电池中OH-移向 极。
(4)25℃时,往a mol·L-1 YH3的水溶液(甲)中滴加0.01 mol·L-1H2SO4溶液(乙),滴加过程中溶液的导电能力 (填“增强”、“减弱”或“不变”),当甲与乙等体积混合后,溶液呈中性(设温度不变),甲中溶质的电离常数Kb= (填表达式,用含a的代数式表示)。
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】(1)已知CuCl2溶液与乙二胺H2N-CH2CH2-NH2[常用(en)表示]作用,可形成配离子(如图所示):
请回答下列问题︰
①乙二胺分子中N原子成键时采取的杂化类型是____________ ,
乙二胺沸点高于Cl-CH2CH2-Cl的主要原因是___________________________ 。
②上述配离子中含有的化学键类型有:__________________ 。(填写代码,多选) ;
a配位键 b极性键 c非极性键 d离子键
③该配合物 [Cu(en)2]Cl2的系统命名为_______ ;其中铜离子的配位数是_______ 。
(2)下表中实线是元素周期表的部分边界,其中上边界未用实线标出。

根据信息回答下列问题:
①周期表中基态Ga原子的最外层电子排布式为__________________
②Fe元素位于周期表的_____ 区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为____ ;
已知:原子数目和电子总数(或价电子总数)相同的粒子互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为______ 和______ (填化学式)。
③根据VSEPR理论预测ED4-离子的空间构型为_________ 。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的化学式为____________ (写2种)。

请回答下列问题︰
①乙二胺分子中N原子成键时采取的杂化类型是
乙二胺沸点高于Cl-CH2CH2-Cl的主要原因是
②上述配离子中含有的化学键类型有:
a配位键 b极性键 c非极性键 d离子键
③该配合物 [Cu(en)2]Cl2的系统命名为
(2)下表中实线是元素周期表的部分边界,其中上边界未用实线标出。

根据信息回答下列问题:
①周期表中基态Ga原子的最外层电子排布式为
②Fe元素位于周期表的
已知:原子数目和电子总数(或价电子总数)相同的粒子互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为
③根据VSEPR理论预测ED4-离子的空间构型为
您最近一年使用:0次



