下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
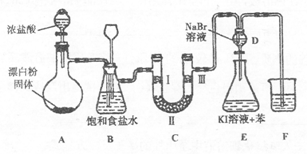
(1)装置A是氯气的发生装置,请写出该反应相应的化学方程式:________ 。
(2)装置B中饱和食盐水的作用是______ ;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:_________ 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ处依次放入物质的组合应是_________ (填字母编号)。
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是______ ,该现象____ (填“能”或“不能”) 说明溴单质的氧化性强于碘,原因是________ 。
(5)装置F的烧杯中的溶液不能选用下列中的_________ (填字母编号)。
A.饱和NaOH溶液 B.饱和Ca(OH)2溶液 C.饱和Na2CO3溶液

(1)装置A是氯气的发生装置,请写出该反应相应的化学方程式:
(2)装置B中饱和食盐水的作用是
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ处依次放入物质的组合应是
| 编号 | I | Ⅱ | Ⅲ |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(5)装置F的烧杯中的溶液不能选用下列中的
A.饱和NaOH溶液 B.饱和Ca(OH)2溶液 C.饱和Na2CO3溶液
2017·山东·二模 查看更多[3]
更新时间:2017-11-13 22:03:31
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】某学习小组为验证浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO,设计如图装置进行实验(夹持仪器已略去)。【查阅资料】:NO与NaOH溶液不反应,NO2与NaOH溶液能反应(反应的化学方程式为2NO2+2NaOH=NaNO3+NaNO2+H2O)。
备选药品:浓硝酸、3mol·L-1稀硝酸、蒸馏水、浓硫酸、NaOH溶液及CO2气体。回答下列问题。
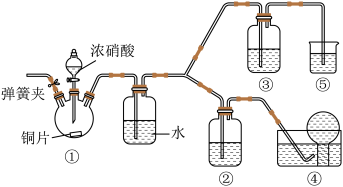
(1)连接好装置,滴加浓硝酸之前的操作依次是:____________ ,加入药品,打开装置①中的弹簧夹后通入CO2一段时间,关闭弹簧夹,将装置④中导管末端伸入倒置的烧瓶内。通入CO2的目的是____________ 。
(2)若用质量分数为70%浓硝酸(密度为1.42g·cm-3)配制250mL3mol·L-1的稀硝酸,除量筒、烧杯、胶头滴管外,还要用到的玻璃仪器有____________ 、____________ 。
(3)装置①中发生反应的化学方程式为____________ 。
(4)装置①中产生的气体通过盛有水的洗气瓶时发生反应的化学方程式为____________ 。
(5)根据实验设计,装置②中盛放的试剂是____________ 。
(6)做实验时应避免有害气体排放到空气中,装置⑤中盛放的药品是____________ 。
(7)验证浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO的实验现象是____________ 。
备选药品:浓硝酸、3mol·L-1稀硝酸、蒸馏水、浓硫酸、NaOH溶液及CO2气体。回答下列问题。

(1)连接好装置,滴加浓硝酸之前的操作依次是:
(2)若用质量分数为70%浓硝酸(密度为1.42g·cm-3)配制250mL3mol·L-1的稀硝酸,除量筒、烧杯、胶头滴管外,还要用到的玻璃仪器有
(3)装置①中发生反应的化学方程式为
(4)装置①中产生的气体通过盛有水的洗气瓶时发生反应的化学方程式为
(5)根据实验设计,装置②中盛放的试剂是
(6)做实验时应避免有害气体排放到空气中,装置⑤中盛放的药品是
(7)验证浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO的实验现象是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】1828年,德国化学家弗里德里希·维勒首次使用(NH4)2SO4与氰酸钾KCNO人工合成了尿素CO(NH2)2,打破了有机化合物的"生命力"学说。
(1) (NH4)2SO4与KCNO合成尿素反应的化学方程式为____________ 。
(2)某小组同学在实验室条件下,拟用CO2和NH3,在催化剂的作用下合成尿素。
①用CO2和NH3合成尿素CO(NH2)2反应的化学方程式为____________ 。
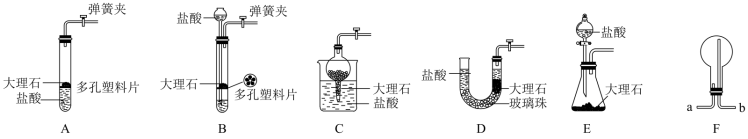
②实验所需的CO2可用多种装置来制备,要想达到“随开随用、随关随停”的目的,下列装置A、B、C、D、E中符和要求的有____________ (填字母)。
③若用F装置收集氨气,则气体应由导管口____________ (填“a”或“b”)进入。
(3)尿素样品中氮含量可以用甲醛法标定,其原理如下:首先用浓硫酸分解试样,使试液中的胺生成硫酸铵并放出二氧化碳;将过量的硫酸中和后得到中性铵盐,再用甲醛(HCHO)与硫酸铵作用生成六次甲基四铵盐离子(CH2)6N4 H+和硫酸;最后用标准氢氧化钠溶液滴定。
①甲醛与硫酸铵反应的离子方程式为____________ ;
②滴定选用的指示剂为____________ 。滴定终点的现象为____________ 。
③若称取样品m g,溶解后配成250mL溶液。取25.00mL样品溶液于250 mL锥形瓶中,加入10mL w%的甲醛溶液,充分反应后,加入1~2滴指示剂,用浓度为a mol/L的NaOH标准溶液滴定至终点(已知滴定时,1 mol六次甲基四铵盐离子(CH2)6N4H+消耗OH﹣的能力与1mol H+相当)。重复2次,消耗NaOH标准溶液的体积平均值为b mL。则该样品中氮的质量分数为____________ 。
(1) (NH4)2SO4与KCNO合成尿素反应的化学方程式为
(2)某小组同学在实验室条件下,拟用CO2和NH3,在催化剂的作用下合成尿素。
①用CO2和NH3合成尿素CO(NH2)2反应的化学方程式为
②实验所需的CO2可用多种装置来制备,要想达到“随开随用、随关随停”的目的,下列装置A、B、C、D、E中符和要求的有
③若用F装置收集氨气,则气体应由导管口

(3)尿素样品中氮含量可以用甲醛法标定,其原理如下:首先用浓硫酸分解试样,使试液中的胺生成硫酸铵并放出二氧化碳;将过量的硫酸中和后得到中性铵盐,再用甲醛(HCHO)与硫酸铵作用生成六次甲基四铵盐离子(CH2)6N4 H+和硫酸;最后用标准氢氧化钠溶液滴定。
①甲醛与硫酸铵反应的离子方程式为
②滴定选用的指示剂为
③若称取样品m g,溶解后配成250mL溶液。取25.00mL样品溶液于250 mL锥形瓶中,加入10mL w%的甲醛溶液,充分反应后,加入1~2滴指示剂,用浓度为a mol/L的NaOH标准溶液滴定至终点(已知滴定时,1 mol六次甲基四铵盐离子(CH2)6N4H+消耗OH﹣的能力与1mol H+相当)。重复2次,消耗NaOH标准溶液的体积平均值为b mL。则该样品中氮的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】CaCO3广泛存在于自然界,是一种重要的化工原料。实验室用大理石(主要成分为CaCO3,另外有少量的含硫化合物)和稀盐酸反应制备CO2气体。下列装置可用于CO2气体的提纯和干燥。
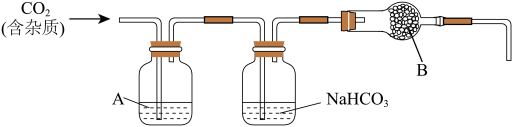
完成下列填空:
(1)用浓盐酸配制1:1(体积比)的稀盐酸(约6mol·L—1),应选用的仪器是____ 。
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶
上述装置中,A是___ 溶液,NaHCO3溶液可以吸收____ 。上述装置中,B物质是____ 。用这个实验得到的气体测定CO2的分子量,如果B物质失效,测定结果____ (填“偏高”、“偏低”或“不受影响”)。
(2)SiO2与CO2组成相似,但固体的熔点相差甚大,其原因是_____ 。
(3)饱和的Na2CO3溶液中通入过量CO2的离子方程式为_____ 。0.1mol/L的NaHCO3溶液中,c(Na+)+c(H+)=_____ ,其中有关碳微粒的关系为:____ =0.1mol/L。浓度相等的Na2CO3和NaHCO3溶液等体积混合后,溶液中离子浓度由大到小的关系为______ 。

完成下列填空:
(1)用浓盐酸配制1:1(体积比)的稀盐酸(约6mol·L—1),应选用的仪器是
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶
上述装置中,A是
(2)SiO2与CO2组成相似,但固体的熔点相差甚大,其原因是
(3)饱和的Na2CO3溶液中通入过量CO2的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐1】FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
实验需要90mL 0.1mol/L FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、胶头滴管外还需的玻璃仪器是_____ 、____
(2)下列有关配制过程中说法错误的是________ (填序号)。
A用电子天平称量质量为1.944g的FeBr2.
B将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
C洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
D.容量瓶贴签存放配好的FeBr2溶液
E.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II. 探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中; 假设2:Fe2+被Cl2氧化成Fe3+。
(1)请你完成下表,验证假设:
若假设1正确,从实验①中分离出Br2的实验操作名称是_____________________________ ;
(2)实验证明:还原性Fe2+> Br-,请用一个离子方程式来证明:___________________________ ;
(3)若在50mL上述FeBr2溶液中通入5×10-3molCl2,反应的离子方程式为___________________ 。
实验需要90mL 0.1mol/L FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、胶头滴管外还需的玻璃仪器是
(2)下列有关配制过程中说法错误的是
A用电子天平称量质量为1.944g的FeBr2.
B将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
C洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
D.容量瓶贴签存放配好的FeBr2溶液
E.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II. 探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中; 假设2:Fe2+被Cl2氧化成Fe3+。
(1)请你完成下表,验证假设:
| 实验步骤、预期现象 | 结论 |
| ①溶液中加入适量四氯化碳, | 假设1正确 |
| ②向溶液中加入 | 假设2正确 |
(2)实验证明:还原性Fe2+> Br-,请用一个离子方程式来证明:
(3)若在50mL上述FeBr2溶液中通入5×10-3molCl2,反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】已知化合物X是离子化合物,其离子具有相同的电子层结构。X遇水剧烈反应,产生的气体甲是天然气的主要成分。

(1)气体甲的电子式________________ ;写出反应①的化学方程式:________________________ ;
(2)向溶液乙中通入过量CO2的离子方程式:________________________________ ;
(3)利用以上原理,某同学为了探究气体甲的还原性并检验产物设计如图1的实验:


Ⅰ、请从图2装置中选择适合作为图1中A部分的装置,适合的是________ (填装置序号);
Ⅱ、正确选择发生装置后,连接装置进行实验。一段时间后,出现以下实验现象:
C硬质玻璃管里黑色粉末变成红色;
D干燥管里白色粉末变成蓝色;
E装置中澄清石灰水变浑浊;尾气燃烧产生蓝色火焰。
①图1中D干燥管里的试剂可能是________ ,其作用是________________ 。
②若C中红色固体是一种单质,氧化产物是平均相对分子质量为36的混合气体,写出硬质玻璃管中发生反应的化学方程式:________________________________ ;
Ⅲ、实验完毕后,要先后熄灭C和F处的酒精灯,应后熄灭的是________ 处酒精灯,理由是________________ 。

(1)气体甲的电子式
(2)向溶液乙中通入过量CO2的离子方程式:
(3)利用以上原理,某同学为了探究气体甲的还原性并检验产物设计如图1的实验:


Ⅰ、请从图2装置中选择适合作为图1中A部分的装置,适合的是
Ⅱ、正确选择发生装置后,连接装置进行实验。一段时间后,出现以下实验现象:
C硬质玻璃管里黑色粉末变成红色;
D干燥管里白色粉末变成蓝色;
E装置中澄清石灰水变浑浊;尾气燃烧产生蓝色火焰。
①图1中D干燥管里的试剂可能是
②若C中红色固体是一种单质,氧化产物是平均相对分子质量为36的混合气体,写出硬质玻璃管中发生反应的化学方程式:
Ⅲ、实验完毕后,要先后熄灭C和F处的酒精灯,应后熄灭的是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】久置的 固体会潮解、变质、颜色变黄,某小组欲探究
固体会潮解、变质、颜色变黄,某小组欲探究 变质的产物。
变质的产物。
资料:i. 能与S反应生成
能与S反应生成 (黄色),
(黄色), 与酸反应生成S和
与酸反应生成S和 ;
;
ii.BaS、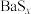 均易溶于水,
均易溶于水, 可溶于水,
可溶于水, (白色)微溶于水;
(白色)微溶于水;
iii.白色的 难溶于水,且易转化为黑色的
难溶于水,且易转化为黑色的 。
。
将久置的 固体溶于水,溶液呈黄色。取黄色溶液,滴加稀硫酸,产生白色沉淀(经检验该沉淀中含S)。
固体溶于水,溶液呈黄色。取黄色溶液,滴加稀硫酸,产生白色沉淀(经检验该沉淀中含S)。
(1)推测 变质的产物含有
变质的产物含有 ,实验证据是
,实验证据是_______ 。
(2)研究白色沉淀产生的途径,实验小组同学进行如下假设:
途径一:白色沉淀由 与稀硫酸反应产生。
与稀硫酸反应产生。
途径二: 变质的产物中可能含有
变质的产物中可能含有 ,白色沉淀由
,白色沉淀由 与稀硫酸反应产生。
与稀硫酸反应产生。
途径三: 变质的产物中可能含有
变质的产物中可能含有 ,白色沉淀由……
,白色沉淀由……
① 与稀硫酸反应的化学方程式是
与稀硫酸反应的化学方程式是_______ 。
②请将途径三补充完全:白色沉淀由_______ 。
(3)为检验 变质的产物中是否含有
变质的产物中是否含有 ,设计实验:
,设计实验:
①取黄色溶液,向其中滴加 溶液,产生黑色沉淀。由此得出结论:
溶液,产生黑色沉淀。由此得出结论: 变质的产物中含
变质的产物中含 。有同学认为得出该结论的理由不充分,原因是
。有同学认为得出该结论的理由不充分,原因是_______ 。
②改进实验,方案和现象如下:
实验一: 和
和 混合溶液
混合溶液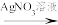 白色沉淀(放置颜色不变)
白色沉淀(放置颜色不变)
实验二:
a.实验一的目的是_______ 。
b.试剂1是_______ ,试剂2是_______ 。
(4)检验 变质的产物中是否含有
变质的产物中是否含有 :取黄色溶液,加入过量稀盐酸,产生白色沉淀。离心沉降(分离固体)后向溶液中滴加
:取黄色溶液,加入过量稀盐酸,产生白色沉淀。离心沉降(分离固体)后向溶液中滴加 溶液,产生白色沉淀。你认为能否根据实验现象得出结论?
溶液,产生白色沉淀。你认为能否根据实验现象得出结论?_______ 。说明理由:_______ 。
 固体会潮解、变质、颜色变黄,某小组欲探究
固体会潮解、变质、颜色变黄,某小组欲探究 变质的产物。
变质的产物。资料:i.
 能与S反应生成
能与S反应生成 (黄色),
(黄色), 与酸反应生成S和
与酸反应生成S和 ;
;ii.BaS、
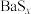 均易溶于水,
均易溶于水, 可溶于水,
可溶于水, (白色)微溶于水;
(白色)微溶于水;iii.白色的
 难溶于水,且易转化为黑色的
难溶于水,且易转化为黑色的 。
。将久置的
 固体溶于水,溶液呈黄色。取黄色溶液,滴加稀硫酸,产生白色沉淀(经检验该沉淀中含S)。
固体溶于水,溶液呈黄色。取黄色溶液,滴加稀硫酸,产生白色沉淀(经检验该沉淀中含S)。(1)推测
 变质的产物含有
变质的产物含有 ,实验证据是
,实验证据是(2)研究白色沉淀产生的途径,实验小组同学进行如下假设:
途径一:白色沉淀由
 与稀硫酸反应产生。
与稀硫酸反应产生。途径二:
 变质的产物中可能含有
变质的产物中可能含有 ,白色沉淀由
,白色沉淀由 与稀硫酸反应产生。
与稀硫酸反应产生。途径三:
 变质的产物中可能含有
变质的产物中可能含有 ,白色沉淀由……
,白色沉淀由……①
 与稀硫酸反应的化学方程式是
与稀硫酸反应的化学方程式是②请将途径三补充完全:白色沉淀由
(3)为检验
 变质的产物中是否含有
变质的产物中是否含有 ,设计实验:
,设计实验:①取黄色溶液,向其中滴加
 溶液,产生黑色沉淀。由此得出结论:
溶液,产生黑色沉淀。由此得出结论: 变质的产物中含
变质的产物中含 。有同学认为得出该结论的理由不充分,原因是
。有同学认为得出该结论的理由不充分,原因是②改进实验,方案和现象如下:
实验一:
 和
和 混合溶液
混合溶液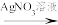 白色沉淀(放置颜色不变)
白色沉淀(放置颜色不变)实验二:

a.实验一的目的是
b.试剂1是
(4)检验
 变质的产物中是否含有
变质的产物中是否含有 :取黄色溶液,加入过量稀盐酸,产生白色沉淀。离心沉降(分离固体)后向溶液中滴加
:取黄色溶液,加入过量稀盐酸,产生白色沉淀。离心沉降(分离固体)后向溶液中滴加 溶液,产生白色沉淀。你认为能否根据实验现象得出结论?
溶液,产生白色沉淀。你认为能否根据实验现象得出结论?
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
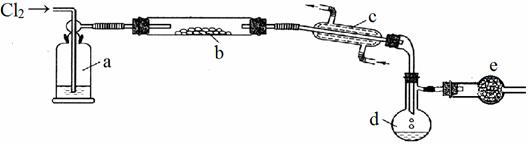
【推荐1】S2Cl2是一种重要的化工产品,常温时是一种有毒并有恶臭的金黄色液体,熔点-76℃,沸点138℃,易与水反应,进一步氯化可得SCl2。SCl2是樱桃红色液体,易挥发,熔点-122℃,沸点59℃。SCl2与S2Cl2相似,有毒并有恶臭,但更不稳定。S2Cl2可用下列装置制备。
请回答下列问题:
(1)写出S2Cl2的电子式_____________________ ;装置a中的试剂为________________ 。
(2)写出实验室制取Cl2的离子方程式___________________ 。
(3)装置b中的反应开始前,需进行的操作是_______________________ 。
(4)装置e的作用是______________________________ 。
(5)将d中获得的S2Cl2提纯,需要进行的操作是___________________ 。
(6) 若将S2Cl2放入水中同时产生沉淀和气体,写出S2Cl2与水反应的方程式______________________ 。
请回答下列问题:
(1)写出S2Cl2的电子式
(2)写出实验室制取Cl2的离子方程式
(3)装置b中的反应开始前,需进行的操作是
(4)装置e的作用是
(5)将d中获得的S2Cl2提纯,需要进行的操作是
(6) 若将S2Cl2放入水中同时产生沉淀和气体,写出S2Cl2与水反应的方程式
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】某化学小组为探究浓HNO3和NaCl固体的反应产物,进行实验:
实验I
资料:
①向AgNO3的95%的乙醇溶液中通入HCl产生白色沉淀,通入Cl2无此现象。
②王水中因含有NOCl呈橙色。NOCl(N元素为+3价)有刺鼻恶臭味,受热易分解为NO和Cl2。
(1)浓HNO3需保存在棕色试剂瓶中,用化学方程式表示原因:_______ 。
(2)探究注射器1中浅棕色气体的成分。甲同学用注射器2抽取注射器1中的浅棕色气体,然后吸取适量蒸馏水并振荡,气体颜色褪去,吸入氧气后又变为浅棕色。经检验,浅棕色气体中几乎不含NOCl。
①甲同学根据实验现象推断浅棕色气体中含有NO2,结合氧化还原反应规律分析一定还含有Cl2,用离子方程式表示甲同学的依据:_______ 。
②乙同学认为需设计实验证明存在Cl2.请结合资料,设计证实存在Cl2的实验方案:_______ 。
(3)探究注射器1内橙色溶液的成分。
实验II:取2mL橙色溶液于试管中,加热一段时间,观察到试管内有红棕色气体生成,溶液变为无色。接着向溶液中滴加AgNO3溶液,无明显现象。
①丙同学认为实验II中“接着向溶液中滴加AgNO3溶液,无明显现象”,是因为加热使溶液中的Cl-全部变为HCl气体放出。请设计实验证明丙同学的观点不成立:_______ 。
②丁同学通过与王水类比,并查阅资料,确认产生实验II中的现象的原因是:浓HNO3与NaCl固体反应生成了NOCl,继而溶液中的NOCl受热发生分解反应,使溶液中的Cl-反应完全,所以向溶液中滴加AgNO3溶液时无明显现象。浓HNO3与NaCl固体反应生成了NOCl,化学方程式是_______ 。
(4)综合上述实验,可以得出结论:_______ 。
实验I
| 实验装置 | 实验步骤及现象 |
| 室温下,按图连接实验装置并检查气密性。向注射器1中先加入1.17gNaCl固体,然后吸入5mL浓HNO3,关闭止水夹。一段时间后,注射器内溶液变为橙色,液面上方有浅棕色刺激性气味气体,溶液温度无明显变化。 |
①向AgNO3的95%的乙醇溶液中通入HCl产生白色沉淀,通入Cl2无此现象。
②王水中因含有NOCl呈橙色。NOCl(N元素为+3价)有刺鼻恶臭味,受热易分解为NO和Cl2。
(1)浓HNO3需保存在棕色试剂瓶中,用化学方程式表示原因:
(2)探究注射器1中浅棕色气体的成分。甲同学用注射器2抽取注射器1中的浅棕色气体,然后吸取适量蒸馏水并振荡,气体颜色褪去,吸入氧气后又变为浅棕色。经检验,浅棕色气体中几乎不含NOCl。
①甲同学根据实验现象推断浅棕色气体中含有NO2,结合氧化还原反应规律分析一定还含有Cl2,用离子方程式表示甲同学的依据:
②乙同学认为需设计实验证明存在Cl2.请结合资料,设计证实存在Cl2的实验方案:
(3)探究注射器1内橙色溶液的成分。
实验II:取2mL橙色溶液于试管中,加热一段时间,观察到试管内有红棕色气体生成,溶液变为无色。接着向溶液中滴加AgNO3溶液,无明显现象。
①丙同学认为实验II中“接着向溶液中滴加AgNO3溶液,无明显现象”,是因为加热使溶液中的Cl-全部变为HCl气体放出。请设计实验证明丙同学的观点不成立:
②丁同学通过与王水类比,并查阅资料,确认产生实验II中的现象的原因是:浓HNO3与NaCl固体反应生成了NOCl,继而溶液中的NOCl受热发生分解反应,使溶液中的Cl-反应完全,所以向溶液中滴加AgNO3溶液时无明显现象。浓HNO3与NaCl固体反应生成了NOCl,化学方程式是
(4)综合上述实验,可以得出结论:
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】某小组以FeCl3溶液为研究对象,探究物质之间反应的多样性,进行了如下实验。
Ⅰ.探究FeCl3溶液中的离子平衡和离子反应。
(1)配制50 mL 1.0 mol/L的FeCl3溶液,测其pH约为0.7,即c(H+) = 0.2 mol/L。
①用化学用语解释FeCl3溶液呈酸性的原因___________ 。
②下列实验方案中,能使FeCl3溶液pH升高的是___________ 。
a.加水稀释 b.加入FeCl3固体 c.滴加浓KSCN溶液 d.加入NaHCO3固体
(2)小组同学利用上述FeCl3溶液探究其与足量锌粉的反应。实验操作及现象如下:
已知:Zn的性质与Al相似,能发生反应:Zn+2NaOH=Na2ZnO2+H2↑。
①结合实验现象和平衡移动原理解释出现红褐色沉淀的原因___________ 。
②用离子方程式解释反应后溶液为浅绿色的原因___________ 。
(3)为进一步探究上述1.0 mol/L FeCl3溶液中Fe3+和H+氧化性的相对强弱,继续实验并观察到反应开始时现象如下:
小组同学得出结论:在1.0mol/L FeCl3溶液中,Fe3+的氧化性比H+更强。
Ⅱ.探究FeCl3溶液与碱性物质之间的反应。
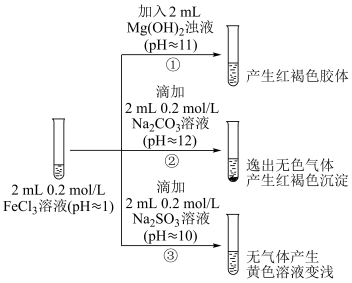
(4)②中逸出的无色气体是___________ (写化学式)。
(5)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
ⅰ.甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加BaCl2溶液,产生白色沉淀。得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是___________ 。
ⅱ.乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是___________ 。
(6)受上述实验启发,小组同学对pH≈8的1mol/L NaF溶液与FeCl3溶液混合时的现象产生了好奇并进行实验:
i.⑤的实验目的是___________ 。
ⅱ.为探究④中溶液变无色的原因,进行了如下实验:

资料显示: FeF3溶液为无色。
请用化学平衡移动原理解释红褐色沉淀产生的原因___________ 。
(7)根据以上实验,FeCl3溶液与碱性物质之间反应的多样性与___________ 有关。
Ⅰ.探究FeCl3溶液中的离子平衡和离子反应。
(1)配制50 mL 1.0 mol/L的FeCl3溶液,测其pH约为0.7,即c(H+) = 0.2 mol/L。
①用化学用语解释FeCl3溶液呈酸性的原因
②下列实验方案中,能使FeCl3溶液pH升高的是
a.加水稀释 b.加入FeCl3固体 c.滴加浓KSCN溶液 d.加入NaHCO3固体
(2)小组同学利用上述FeCl3溶液探究其与足量锌粉的反应。实验操作及现象如下:
| 操作 | 现象 |
| 向反应瓶中加入6.5g锌粉,然后加入50mL 1.0 mol/L的FeCl3溶液,搅拌 | 溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色 |
| 收集检验反应过程中产生的气体 | 集气管口靠近火焰,有爆鸣声 |
①结合实验现象和平衡移动原理解释出现红褐色沉淀的原因
②用离子方程式解释反应后溶液为浅绿色的原因
(3)为进一步探究上述1.0 mol/L FeCl3溶液中Fe3+和H+氧化性的相对强弱,继续实验并观察到反应开始时现象如下:
| 操作 | 现象 |
| 将5 mL 1.0 mol/L的FeCl3溶液与0.65 g锌粉混合 | 溶液温度迅速上升,开始时几乎没有气泡 |
| 将 | 溶液中立即产生大量气泡 |
Ⅱ.探究FeCl3溶液与碱性物质之间的反应。

(4)②中逸出的无色气体是
(5)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
ⅰ.甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加BaCl2溶液,产生白色沉淀。得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是
ⅱ.乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是
(6)受上述实验启发,小组同学对pH≈8的1mol/L NaF溶液与FeCl3溶液混合时的现象产生了好奇并进行实验:
| 实验操作 及现象 | ④向2 mL 0.2 mol/LFeCl3溶液中滴入2 mL 1 mol/LNaF溶液,溶液变无色 |
| ⑤向2 mL 0.2 mol/LFeCl3溶液中滴入2 mL蒸馏水,溶液颜色变浅 |
ⅱ.为探究④中溶液变无色的原因,进行了如下实验:

资料显示: FeF3溶液为无色。
请用化学平衡移动原理解释红褐色沉淀产生的原因
(7)根据以上实验,FeCl3溶液与碱性物质之间反应的多样性与
您最近一年使用:0次




