(1)已知:①Fe(s)+1/2O2(g)===FeO(s) ΔH1=-272.0 kJ·mol-1;
②2Al(s)+3/2O2(g)===Al2O3(s) ΔH2=-1 675.7 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是__________________________ 。某同学认为,铝热反应可用于工业炼铁,你的判断是________ (填“能”或“不能”),你的理由是_________________ 。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示。
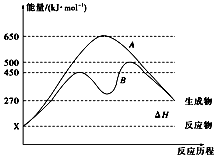
①据图判断该反应是________ (填“吸”或“放”)热反应
②其中B历程表明此反应采用的条件为_____ (填字母)。
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用催化剂
②2Al(s)+3/2O2(g)===Al2O3(s) ΔH2=-1 675.7 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示。

①据图判断该反应是
②其中B历程表明此反应采用的条件为
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用催化剂
17-18高二上·安徽安庆·期中 查看更多[6]
安徽省安庆市五校联盟2017-2018学年高二上学期期中联考化学试题(已下线)2017-2018学年上学期期末复习备考之精准复习模拟题高二化学选修4(B卷)人教版选修四2019-2020学年高二上学期期末复习化学综合训练人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 第二节 反应热的计算 课时2 反应热的计算(已下线)综合复习与测试(2)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)山西省长治市上党区一中2021-2022学年高二上学期10月月考化学试题
更新时间:2017-11-30 03:31:29
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】接触法制硫酸的三个阶段:煅烧、氧化、吸收。煅烧黄铁矿的化学方程式为:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2。
完成下列填空:
(1)煅烧黄铁矿在________ (填设备名称)中进行,此反应中被氧化的元素是___________ 。
(2)SO2的催化氧化:2SO2(g)+O2(g) 2SO3(g),该反应的平衡常数表达式为K=
2SO3(g),该反应的平衡常数表达式为K= ______ ;反应达到平衡,及时分离出SO3,则平衡向_________ 方向移动(选填“正反应”“逆反应”)。其他条件不变,降低温度平衡向正反应方向移动,则正反应为__________ 反应(选填“吸热”“放热”)。
(3)下图为二氧化硫与氧气反应的速率(ν)与时间(t)的关系,判断在t1时刻曲线发生变化的原因是______ (选填编号)。
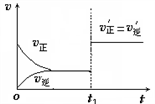
a. 增大O2的浓度
b. 扩大容器体积
c. 加入催化剂
d. 升高温度
改变条件后,平衡混合物中SO3的百分含量_______ (选填“增大”“减小”“不变”)。
(4)SO3的吸收:SO3 + H2O → H2SO4 。假定制备硫酸的整个过程中S元素共损失10%,则含1000 kg FeS2的黄铁矿可以制得98%的浓硫酸_____________ kg。
4FeS2 + 11O2 → 2Fe2O3 + 8SO2。
完成下列填空:
(1)煅烧黄铁矿在
(2)SO2的催化氧化:2SO2(g)+O2(g)
 2SO3(g),该反应的平衡常数表达式为K=
2SO3(g),该反应的平衡常数表达式为K= (3)下图为二氧化硫与氧气反应的速率(ν)与时间(t)的关系,判断在t1时刻曲线发生变化的原因是

a. 增大O2的浓度
b. 扩大容器体积
c. 加入催化剂
d. 升高温度
改变条件后,平衡混合物中SO3的百分含量
(4)SO3的吸收:SO3 + H2O → H2SO4 。假定制备硫酸的整个过程中S元素共损失10%,则含1000 kg FeS2的黄铁矿可以制得98%的浓硫酸
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】煤是我国重要的化石燃料,煤化工行业中产生的H2S也是一种重要的工业资源。
(1)煤液化是_______ (填“物理”或“化学”)变化过程。
(2)煤液化过程中产生的H2S可生产硫酸,部分过程如图所示:
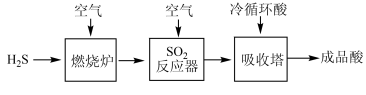
①SO2反应器中的化学方程式是_______ 。
②生产过程中的尾气需要测定SO2的含量符合标准才能排放。已知有V L(已换算成标准状况)尾气,通入足量H2O2吸收再加足量BaCl2溶液充分反应后(不考虑尾气中其他成分的反应),过滤、洗涤、干燥、称量得到b g沉淀。H2O2吸收SO2的化学方程式是_______ ;尾气中SO2的含量(体积分数)的计算式是_______ 。
(3)H2S还可用于回收单质硫。含有H2S和空气的尾气按一定流速通入酸性FeCl3溶液,可实现空气脱硫,得到单质硫。FeCl3溶液吸收H2S过程中,溶液中的n(Fe3+)、被吸收的n(H2S) 随时间t的变化如图:
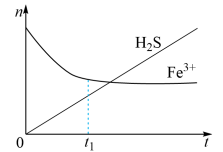
① 由图中信息可知,0 ~ t1时,一定发生的反应是_______ (用离子方程式表示)。
②t1以后,溶液中n (Fe3+ ) 保持基本不变,原因是_______ 。
(1)煤液化是
(2)煤液化过程中产生的H2S可生产硫酸,部分过程如图所示:

①SO2反应器中的化学方程式是
②生产过程中的尾气需要测定SO2的含量符合标准才能排放。已知有V L(已换算成标准状况)尾气,通入足量H2O2吸收再加足量BaCl2溶液充分反应后(不考虑尾气中其他成分的反应),过滤、洗涤、干燥、称量得到b g沉淀。H2O2吸收SO2的化学方程式是
(3)H2S还可用于回收单质硫。含有H2S和空气的尾气按一定流速通入酸性FeCl3溶液,可实现空气脱硫,得到单质硫。FeCl3溶液吸收H2S过程中,溶液中的n(Fe3+)、被吸收的n(H2S) 随时间t的变化如图:

① 由图中信息可知,0 ~ t1时,一定发生的反应是
②t1以后,溶液中n (Fe3+ ) 保持基本不变,原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品,工业上常用铝土矿(主要成分为Al2O3)来生产铵明矾NH4Al(SO4)2•12H2O,其工艺流程图如下:
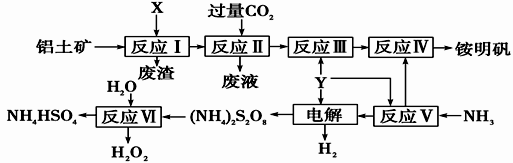
(1)流程图中X为_________ (填化学式),Y为______ (填名称)溶液,NH3的电子式________ ;
(2)流程中电解池阳极的电极反应式为______ ;
(3)反应II的离子方程式为____________________ 反应Ⅵ的化学方程式为_________________ ;
(4)对铵明矾NH4Al(SO4)2·12H2O高温分解的气体产物的预测不合理 的是______ ;
A.NH3、N2、SO2、H2O B.NH3、SO3、H2O
C.NH3、SO2、H2O D.NH3、N2、SO3、SO2、H2O

(1)流程图中X为
(2)流程中电解池阳极的电极反应式为
(3)反应II的离子方程式为
(4)对铵明矾NH4Al(SO4)2·12H2O高温分解的气体产物的预测
A.NH3、N2、SO2、H2O B.NH3、SO3、H2O
C.NH3、SO2、H2O D.NH3、N2、SO3、SO2、H2O
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】Ⅰ.在载人航天器中,可以利用 与
与 的反应,将航天员呼出的
的反应,将航天员呼出的 转化为
转化为 等,然后通过电解
等,然后通过电解 得到
得到 ,从而实现
,从而实现 的再生。已知:
的再生。已知:
①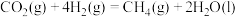

②
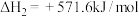
(1)请写出甲烷与氧气反应生成二氧化碳和液态水的热化学方程式___________ 。
Ⅱ.将 盐酸和
盐酸和 未知浓度的
未知浓度的 溶液混合均匀后测量并记录溶液的温度,实验结果如图所示,实验中始终保持
溶液混合均匀后测量并记录溶液的温度,实验结果如图所示,实验中始终保持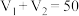 。
。
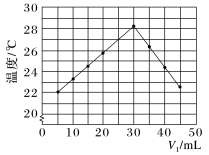
(2)下列叙述正确的是___________。
(3)中和反应的反应热的理论值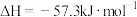 ,写出表示稀盐酸和
,写出表示稀盐酸和 溶液反应的中和热的热化学方程式
溶液反应的中和热的热化学方程式___________ 。下列操作可能使测得的 偏大的是
偏大的是___________ (填序号)。
①室温低于 时进行实验
时进行实验
②分多次把 溶液倒入盛有盐酸的小烧杯中
溶液倒入盛有盐酸的小烧杯中
③实验时用环形铜丝搅拌棒代替搅拌器
(4)在做测定中和反应的反应热实验时,应使用仪器的正确组合是___________。
①天平 ②量筒 ③烧杯 ④滴定管 ⑤温度计 ⑥试管 ⑦酒精灯
 与
与 的反应,将航天员呼出的
的反应,将航天员呼出的 转化为
转化为 等,然后通过电解
等,然后通过电解 得到
得到 ,从而实现
,从而实现 的再生。已知:
的再生。已知:①
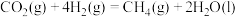

②

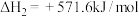
(1)请写出甲烷与氧气反应生成二氧化碳和液态水的热化学方程式
Ⅱ.将
 盐酸和
盐酸和 未知浓度的
未知浓度的 溶液混合均匀后测量并记录溶液的温度,实验结果如图所示,实验中始终保持
溶液混合均匀后测量并记录溶液的温度,实验结果如图所示,实验中始终保持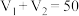 。
。
(2)下列叙述正确的是___________。
| A.该实验表明化学能可转化为热能 | B.做该实验时环境温度为 |
C. 溶液的浓度约为 溶液的浓度约为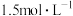 | D.该实验表明有水生成的反应都是放热反应 |
(3)中和反应的反应热的理论值
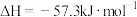 ,写出表示稀盐酸和
,写出表示稀盐酸和 溶液反应的中和热的热化学方程式
溶液反应的中和热的热化学方程式 偏大的是
偏大的是①室温低于
 时进行实验
时进行实验②分多次把
 溶液倒入盛有盐酸的小烧杯中
溶液倒入盛有盐酸的小烧杯中③实验时用环形铜丝搅拌棒代替搅拌器
(4)在做测定中和反应的反应热实验时,应使用仪器的正确组合是___________。
①天平 ②量筒 ③烧杯 ④滴定管 ⑤温度计 ⑥试管 ⑦酒精灯
| A.①②④ | B.②③⑤ | C.②③④⑦ | D.全部 |
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理:

通过计算,可知系统(I)和系统(II)制氢的热化学方程式分别为___________ 、_________________ ,制得等量H2所需能量较少的是________ 。
(2)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
已知反应①中相关的化学键键能数据如下:
由此计算△H1=________ kJ/mol;已知△H2=-58kJ/mol,则△H3=_______ kJ/mol。

通过计算,可知系统(I)和系统(II)制氢的热化学方程式分别为
(2)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)
 CH3OH(g) △H1
CH3OH(g) △H1②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2③CO2(g)+H2(g)
 CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3回答下列问题:
已知反应①中相关的化学键键能数据如下:
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】 和
和 是汽车尾气的主要成分,它们能缓慢地发生反应Ⅰ:
是汽车尾气的主要成分,它们能缓慢地发生反应Ⅰ: 。
。
(1)汽车行驶时, 和
和 在电火花作用下产生
在电火花作用下产生 ,各物质所含化学键键能数据如下表:
,各物质所含化学键键能数据如下表:
相同条件下, 、
、 、
、 三种物质中最稳定的是
三种物质中最稳定的是_______ ;
_______ 。
(2)工业上可通过 和
和 化合制备甲醇,反应的化学方程式为
化合制备甲醇,反应的化学方程式为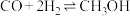 。
。
已知:①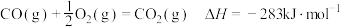
②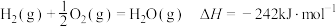
③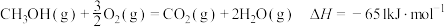
写出工业上用 和
和 合成
合成 的热化学方程式:
的热化学方程式:_______ 。
(3)反应I在常温下可以自发进行,则该反应的正反应为_______ (填“吸热”或“放热”)反应。
(4)为减少汽车尾气污染,下列措施合理的有_______(填字母)。
 和
和 是汽车尾气的主要成分,它们能缓慢地发生反应Ⅰ:
是汽车尾气的主要成分,它们能缓慢地发生反应Ⅰ: 。
。(1)汽车行驶时,
 和
和 在电火花作用下产生
在电火花作用下产生 ,各物质所含化学键键能数据如下表:
,各物质所含化学键键能数据如下表:| 物质 |  |  |  |
化学键键能 | 946 | 498 | 632 |
 、
、 、
、 三种物质中最稳定的是
三种物质中最稳定的是
(2)工业上可通过
 和
和 化合制备甲醇,反应的化学方程式为
化合制备甲醇,反应的化学方程式为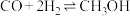 。
。已知:①
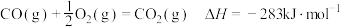
②
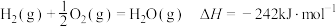
③
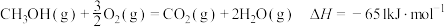
写出工业上用
 和
和 合成
合成 的热化学方程式:
的热化学方程式:(3)反应I在常温下可以自发进行,则该反应的正反应为
(4)为减少汽车尾气污染,下列措施合理的有_______(填字母)。
| A.开发氢能源 | B.寻找反应I的高效催化剂 |
| C.市民大量移居城市郊区 | D.戴上呼吸面具 |
您最近一年使用:0次



