下列方法中,可以使0.10 mol·L-1 CH3COOH溶液中CH3COOH电离程度增大的是
| A.加入少量冰醋酸 | B.加水稀释 |
| C.加入少量氯化钠固体 | D.加入少量醋酸钠固体 |
更新时间:2017-12-19 17:38:55
|
【知识点】 浓度对电离平衡的影响解读
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】下表是几种弱酸在常温下的电离平衡常数:
下列说法中错误的是
 |  |  |  |
 | 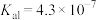  |  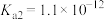 |  , ,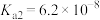 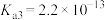 |
| A.碳酸的酸性强于氢硫酸 |
| B.多元弱酸的酸性主要由第一步电离决定 |
C.常温下,加水稀释醋酸, 减小 减小 |
| D.向弱酸溶液中加少量NaOH溶液,电离平衡常数不变 |
您最近半年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】下列叙述正确的是
| A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 |
| B.测得0.1mol·L-1的一元碱BOH溶液的pH=12,则BOH一定是一种弱电解质 |
| C.25℃时,pH=2的硫酸和pH=2的醋酸以体积比1:10混合后,溶液pH仍为2 |
D.室温下,向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中 减小 减小 |
您最近半年使用:0次

 )的值增大
)的值增大

