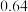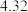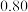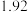某学习小组通过如右图所示装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。
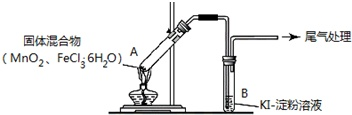
实验操作和现象:
(1)实验前要首先进行的操作是____________ .
(2)现象Ⅰ中白雾的成分是_________ (填名称),形成白雾的原因是________ .
(3)将现象Ⅰ中得到的黄色气体通入KSCN溶液,溶液变红。则现象Ⅱ中黄色气体除了Cl2还含有________ (填化学式);该物质能使B中KI-淀粉溶液变蓝,发生反应的离子方程式是______ .
(4)为了确认现象Ⅱ中黄色气体中含有Cl2,小组提出如下方案:
方案:将B中KI-淀粉溶液替换为NaBr溶液。
现象: B中溶液呈浅橙红色;未检出Fe2+。
a.写出用铁氰化钾溶液检验Fe2+原理的离子方程式:_________
b.方案中检验Fe2+的原因是____________ 。

实验操作和现象:
| 操作 | 现象 |
| 点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
(2)现象Ⅰ中白雾的成分是
(3)将现象Ⅰ中得到的黄色气体通入KSCN溶液,溶液变红。则现象Ⅱ中黄色气体除了Cl2还含有
(4)为了确认现象Ⅱ中黄色气体中含有Cl2,小组提出如下方案:
方案:将B中KI-淀粉溶液替换为NaBr溶液。
现象: B中溶液呈浅橙红色;未检出Fe2+。
a.写出用铁氰化钾溶液检验Fe2+原理的离子方程式:
b.方案中检验Fe2+的原因是
更新时间:2018-03-09 14:09:53
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐1】研究表明物质的颜色与吸收光的波长( )有关,而颜色的深浅与吸光度(A)有关。如
)有关,而颜色的深浅与吸光度(A)有关。如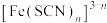 的吸光度随显色剂
的吸光度随显色剂 浓度的增大而增大(如图甲),随着n的增加,颜色由红色逐渐加深至血红色。某科研小组为了研究影响
浓度的增大而增大(如图甲),随着n的增加,颜色由红色逐渐加深至血红色。某科研小组为了研究影响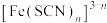 颜色的因素,设计了如下实验:
颜色的因素,设计了如下实验:

(1)配制500mL 的
的 溶液。用电子天平准确称取8.125g无水
溶液。用电子天平准确称取8.125g无水 晶体,溶解在约150mL
晶体,溶解在约150mL_______ 中,冷却后配制成500mL溶液待用,此过程应该用到的玻璃仪器有烧杯、玻璃棒、量筒、500mL容量瓶、_______ 。
(2)取配制好的 溶液5mL,加入(
溶液5mL,加入( KSCN溶液5mL,溶液呈红色,将此红色溶液平均分装在a、b、c三支试管中,进行分析:
KSCN溶液5mL,溶液呈红色,将此红色溶液平均分装在a、b、c三支试管中,进行分析:
①取a试管,加入抗坏血酸(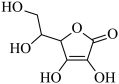 )发现溶液红色立即褪去,小组成员查阅资料确认脱氢抗坏血液(
)发现溶液红色立即褪去,小组成员查阅资料确认脱氢抗坏血液(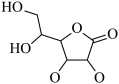 )的产生是褪色的主要原因,则此过程反应的离子方程式为
)的产生是褪色的主要原因,则此过程反应的离子方程式为_______ 。
②取b试管,加入 溶液,发现溶液红色缓慢褪去,同时产生大量无色、无味、无毒气体,经检验后确认气体有两种成分,其中一种是
溶液,发现溶液红色缓慢褪去,同时产生大量无色、无味、无毒气体,经检验后确认气体有两种成分,其中一种是 ,可用于检验另一种气体的试剂是
,可用于检验另一种气体的试剂是_______ 。
③取c试管,发现红色溶液放置一段时间颜色变浅,具体的原因可能是_______ 。
(3)研究小组在研究酸碱性对 与
与 显色反应的平衡体系的影响时,通过数据采集器得到pH及显色时间对吸光度(A)的影响如图乙:
显色反应的平衡体系的影响时,通过数据采集器得到pH及显色时间对吸光度(A)的影响如图乙:
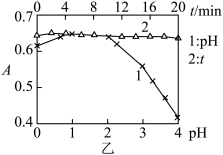
由图乙数据可以发现,进行该显色反应时需控制溶液pH为_______ ;pH太小或太大均不利于显色反应的研究,理由是_______ 。
(4) 与
与 反应可以生成配位数从1到6的配离子
反应可以生成配位数从1到6的配离子 ,其水溶液都是红色,而
,其水溶液都是红色,而 与
与 配位时,溶液接近无色。研究小组收集到了
配位时,溶液接近无色。研究小组收集到了 的逐级稳定常数(K)的数据(见表),并由此推算出累积稳定常数(
的逐级稳定常数(K)的数据(见表),并由此推算出累积稳定常数( ),已知
),已知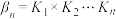 。
。
如:
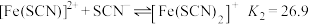
则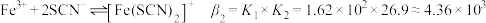 。
。
① 的平衡常数K=
的平衡常数K=_______ (保留3位有效数字)。
②某补血药片的主要成分是琥珀酸亚铁,现在已经部分变质(即铁元素被氧化),请根据表中数据设计实验证明该药片确实是部分变质:取部分变质的药片,剥去表面糖衣,研细成粉末,加水溶解,_______ ,则证明溶液中有 ,即药片部分变质(试剂可以任选)
,即药片部分变质(试剂可以任选)
 )有关,而颜色的深浅与吸光度(A)有关。如
)有关,而颜色的深浅与吸光度(A)有关。如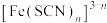 的吸光度随显色剂
的吸光度随显色剂 浓度的增大而增大(如图甲),随着n的增加,颜色由红色逐渐加深至血红色。某科研小组为了研究影响
浓度的增大而增大(如图甲),随着n的增加,颜色由红色逐渐加深至血红色。某科研小组为了研究影响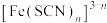 颜色的因素,设计了如下实验:
颜色的因素,设计了如下实验:
(1)配制500mL
 的
的 溶液。用电子天平准确称取8.125g无水
溶液。用电子天平准确称取8.125g无水 晶体,溶解在约150mL
晶体,溶解在约150mL(2)取配制好的
 溶液5mL,加入(
溶液5mL,加入( KSCN溶液5mL,溶液呈红色,将此红色溶液平均分装在a、b、c三支试管中,进行分析:
KSCN溶液5mL,溶液呈红色,将此红色溶液平均分装在a、b、c三支试管中,进行分析:①取a试管,加入抗坏血酸(
 )发现溶液红色立即褪去,小组成员查阅资料确认脱氢抗坏血液(
)发现溶液红色立即褪去,小组成员查阅资料确认脱氢抗坏血液( )的产生是褪色的主要原因,则此过程反应的离子方程式为
)的产生是褪色的主要原因,则此过程反应的离子方程式为②取b试管,加入
 溶液,发现溶液红色缓慢褪去,同时产生大量无色、无味、无毒气体,经检验后确认气体有两种成分,其中一种是
溶液,发现溶液红色缓慢褪去,同时产生大量无色、无味、无毒气体,经检验后确认气体有两种成分,其中一种是 ,可用于检验另一种气体的试剂是
,可用于检验另一种气体的试剂是③取c试管,发现红色溶液放置一段时间颜色变浅,具体的原因可能是
(3)研究小组在研究酸碱性对
 与
与 显色反应的平衡体系的影响时,通过数据采集器得到pH及显色时间对吸光度(A)的影响如图乙:
显色反应的平衡体系的影响时,通过数据采集器得到pH及显色时间对吸光度(A)的影响如图乙:
由图乙数据可以发现,进行该显色反应时需控制溶液pH为
(4)
 与
与 反应可以生成配位数从1到6的配离子
反应可以生成配位数从1到6的配离子 ,其水溶液都是红色,而
,其水溶液都是红色,而 与
与 配位时,溶液接近无色。研究小组收集到了
配位时,溶液接近无色。研究小组收集到了 的逐级稳定常数(K)的数据(见表),并由此推算出累积稳定常数(
的逐级稳定常数(K)的数据(见表),并由此推算出累积稳定常数( ),已知
),已知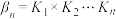 。
。| 配位体 | 金属离子 |  |  |  |  | 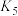 |  |
 |  | 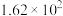 | 26.9 | 22.9 | 20.0 | 0.79 | 0.79 |
 |  | 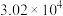 | 4.47 | 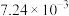 |  | — | — |
 |  |  | 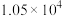 |  | — | — | — |
 |  |  | 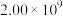 | 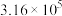 | — | — | — |

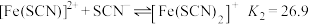
则
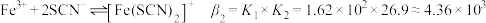 。
。①
 的平衡常数K=
的平衡常数K=②某补血药片的主要成分是琥珀酸亚铁,现在已经部分变质(即铁元素被氧化),请根据表中数据设计实验证明该药片确实是部分变质:取部分变质的药片,剥去表面糖衣,研细成粉末,加水溶解,
 ,即药片部分变质(试剂可以任选)
,即药片部分变质(试剂可以任选)
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】天津港“8.12”爆炸事故中,因爆炸冲击导致氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染.
资料:氰化钠化学式NaCN(C元素+2价,N元素﹣3价),白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢.
(1)NaCN水溶液呈碱性,其原因是_____ (用离子方程式解释).
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,写出该反应的化学方程式_____ .
某化学兴趣小组实验室制备硫代硫酸钠(Na2S2O3),并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【实验一】实验室通过下图装置制备Na2S2O3。
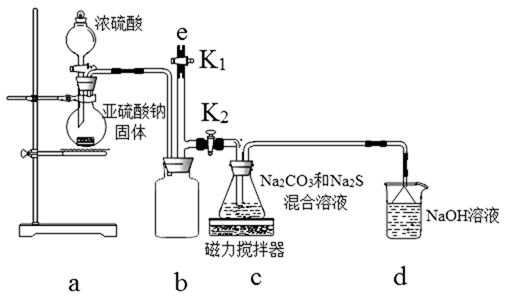
(3)a装置中盛Na2SO3固体的仪器名称是:__________ ;b装置的作用是_________
(4) c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2CO3,还可能有__________ 。
(5)实验结束后,在e处最好连接盛_____ (选填“NaOH溶液”、“水”、“CCl4”中任一种)的注射器,再关闭K2打开K1,防止拆除装置时污染空气。
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:Ag++2CN-=〔Ag(CN)2〕-,Ag++I-= AgI↓ AgI呈黄色且CN-优先与Ag+反应。
实验如下:
取25.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.000×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为2.5ml
(6)滴定终点的判断方法是_________________ 。
(7)处理后的废水氰化钠的含量为___________ mg/L
资料:氰化钠化学式NaCN(C元素+2价,N元素﹣3价),白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢.
(1)NaCN水溶液呈碱性,其原因是
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,写出该反应的化学方程式
某化学兴趣小组实验室制备硫代硫酸钠(Na2S2O3),并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【实验一】实验室通过下图装置制备Na2S2O3。

(3)a装置中盛Na2SO3固体的仪器名称是:
(4) c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2CO3,还可能有
(5)实验结束后,在e处最好连接盛
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:Ag++2CN-=〔Ag(CN)2〕-,Ag++I-= AgI↓ AgI呈黄色且CN-优先与Ag+反应。
实验如下:
取25.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.000×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为2.5ml
(6)滴定终点的判断方法是
(7)处理后的废水氰化钠的含量为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
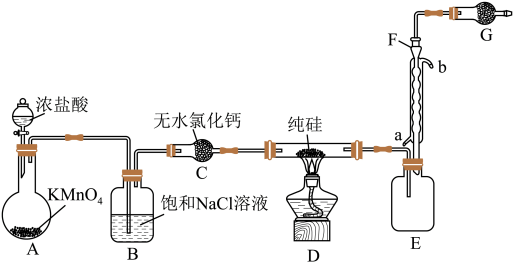
【推荐3】2023年9月华为推出了举世瞩目的“中国芯”——麒麟芯。“中国芯”的发展离不开单晶硅,四氯化硅是制备高纯硅的原料。某小组拟在实验室用下列装置模拟探究四氯化硅的制备和应用(夹持装置已省略)。
① ,
,
② 遇水剧烈水解,
遇水剧烈水解, 的熔点、沸点分别为―70.0℃、57.7℃。
的熔点、沸点分别为―70.0℃、57.7℃。
③电负性Cl>H>Si, 的沸点为31.8℃,熔点为―126.5℃,在空气中易自燃,遇水会剧烈反应。
的沸点为31.8℃,熔点为―126.5℃,在空气中易自燃,遇水会剧烈反应。
请回答下列问题:
(1)写出A中发生反应的离子方程式:______ 。
(2)装置B的作用是______ 。
(3)仪器F的名称是______ ,冷却水应从______ (填“a”或“b”)口通入。
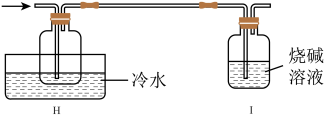
(4)有同学设计如图装置H、I替代上述E、G装置;______ 。
(5)测定产品纯度。取mg 产品溶于足量蒸馏水中(生成的HCl全部被水吸收),将混合物转入锥形瓶中,滴加甲基橙溶液,用
产品溶于足量蒸馏水中(生成的HCl全部被水吸收),将混合物转入锥形瓶中,滴加甲基橙溶液,用 标准NaOH溶液滴定至终点(终点时硅酸未参加反应),消耗滴定液VmL。则产品的纯度为
标准NaOH溶液滴定至终点(终点时硅酸未参加反应),消耗滴定液VmL。则产品的纯度为______ %(用含m、c和V的代数式表示)。若产品中溶有少量 ,则测定结果
,则测定结果______ (填“偏高”、“偏低”或“无影响”)
(6) 也是制备高纯硅的重要原料,将其通入浓NaOH溶液中,发生反应的化学方程式为
也是制备高纯硅的重要原料,将其通入浓NaOH溶液中,发生反应的化学方程式为______ 。
①
 ,
,
②
 遇水剧烈水解,
遇水剧烈水解, 的熔点、沸点分别为―70.0℃、57.7℃。
的熔点、沸点分别为―70.0℃、57.7℃。③电负性Cl>H>Si,
 的沸点为31.8℃,熔点为―126.5℃,在空气中易自燃,遇水会剧烈反应。
的沸点为31.8℃,熔点为―126.5℃,在空气中易自燃,遇水会剧烈反应。请回答下列问题:
(1)写出A中发生反应的离子方程式:
(2)装置B的作用是
(3)仪器F的名称是
(4)有同学设计如图装置H、I替代上述E、G装置;
(5)测定产品纯度。取mg
 产品溶于足量蒸馏水中(生成的HCl全部被水吸收),将混合物转入锥形瓶中,滴加甲基橙溶液,用
产品溶于足量蒸馏水中(生成的HCl全部被水吸收),将混合物转入锥形瓶中,滴加甲基橙溶液,用 标准NaOH溶液滴定至终点(终点时硅酸未参加反应),消耗滴定液VmL。则产品的纯度为
标准NaOH溶液滴定至终点(终点时硅酸未参加反应),消耗滴定液VmL。则产品的纯度为 ,则测定结果
,则测定结果(6)
 也是制备高纯硅的重要原料,将其通入浓NaOH溶液中,发生反应的化学方程式为
也是制备高纯硅的重要原料,将其通入浓NaOH溶液中,发生反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐1】某实验小组拟探究铁的化合物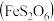 的分解产物,设计如下实验。已知几种物质的物理性质如下表所示。
的分解产物,设计如下实验。已知几种物质的物理性质如下表所示。
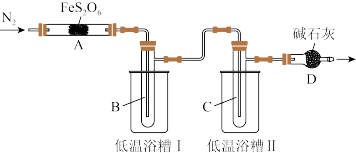
实验装置如图所示 加热和夹持装置省略
加热和夹持装置省略 。
。
回答下列问题:
(1)点燃酒精灯之前,通入一段时间 ,其目的是
,其目的是______________ 。
(2)低温浴槽II控制的温度范围为_____ 。
(3)甲、乙、丙三组分别进行实验,测得相关实验数据如下 不考虑损失且不考虑
不考虑损失且不考虑 的存在,固体已完全分解
的存在,固体已完全分解 :
:
 根据实验数据分析,甲组实验中
根据实验数据分析,甲组实验中 装置得到的纯净固体产物是
装置得到的纯净固体产物是________________  填化学式
填化学式 。
。
 经检测,乙组实验的固体产物为纯净物,写出
经检测,乙组实验的固体产物为纯净物,写出 中发生的化学反应方程式:
中发生的化学反应方程式:_________________ 。
(4)为了进一步分析丙组实验得到的固体纯净物成分,他们取少量固体溶于稀硫酸中,将溶液分成两份,进行如下实验 不考虑
不考虑 的存在
的存在 :
:
根据实验推知,丙组实验中 分解生成的固体产物、
分解生成的固体产物、 、
、 的物质的量之比为
的物质的量之比为_________ 。
(5)为了进一步探究气体产物成分,将 仪器导出的气体通入酸化的
仪器导出的气体通入酸化的 淀粉溶液中,一段时间后,若
淀粉溶液中,一段时间后,若________________________________  填实验现象
填实验现象 ,则说明有
,则说明有 生成。
生成。
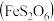 的分解产物,设计如下实验。已知几种物质的物理性质如下表所示。
的分解产物,设计如下实验。已知几种物质的物理性质如下表所示。| 物质 |
|
|
|
熔点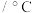 |
|
|
|
沸点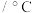 |
|
|
|
 加热和夹持装置省略
加热和夹持装置省略 。
。
回答下列问题:
(1)点燃酒精灯之前,通入一段时间
 ,其目的是
,其目的是(2)低温浴槽II控制的温度范围为
(3)甲、乙、丙三组分别进行实验,测得相关实验数据如下
 不考虑损失且不考虑
不考虑损失且不考虑 的存在,固体已完全分解
的存在,固体已完全分解 :
:
|
| 低温浴槽 | 低温浴槽 | |
甲 |
|
|
|
|
乙 |
|
|
|
|
丙 |
|
|
|
|
 根据实验数据分析,甲组实验中
根据实验数据分析,甲组实验中 装置得到的纯净固体产物是
装置得到的纯净固体产物是 填化学式
填化学式 。
。 经检测,乙组实验的固体产物为纯净物,写出
经检测,乙组实验的固体产物为纯净物,写出 中发生的化学反应方程式:
中发生的化学反应方程式:(4)为了进一步分析丙组实验得到的固体纯净物成分,他们取少量固体溶于稀硫酸中,将溶液分成两份,进行如下实验
 不考虑
不考虑 的存在
的存在 :
:| 实验 | 操作 | 现象 |
 | 在一份溶液中滴加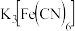 溶液 溶液 | 产生蓝色沉淀 |
 | 在另一份溶液中滴加 溶液 溶液 | 溶液变红色 |
 分解生成的固体产物、
分解生成的固体产物、 、
、 的物质的量之比为
的物质的量之比为(5)为了进一步探究气体产物成分,将
 仪器导出的气体通入酸化的
仪器导出的气体通入酸化的 淀粉溶液中,一段时间后,若
淀粉溶液中,一段时间后,若 填实验现象
填实验现象 ,则说明有
,则说明有 生成。
生成。
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】化合物X由四种元素组成,按如下流程进行实验。混合气体A由气体E和元素种类相同的另两种气体组成,且气体C的平均相对分子质量为8.5。混合物B中有两种固体。
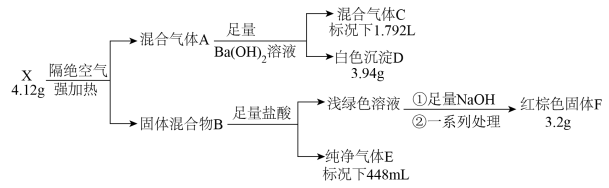
请回答:
(1)组成X的四种元素为_______ ;X的化学式为_______ 。
(2)写出由X到A的化学方程式_______ 。
(3)用盐酸溶解固体F,滴加一定量KSCN溶液,得到血红色溶液Y。往溶液Y中加入一定量KCl固体,溶液Y颜色变淡,请结合离子方程式说明原因_______ 。
(4)设计实验检验混合气体A中相对分子量较小的两种气体_______ 。

请回答:
(1)组成X的四种元素为
(2)写出由X到A的化学方程式
(3)用盐酸溶解固体F,滴加一定量KSCN溶液,得到血红色溶液Y。往溶液Y中加入一定量KCl固体,溶液Y颜色变淡,请结合离子方程式说明原因
(4)设计实验检验混合气体A中相对分子量较小的两种气体
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】已知硫酸亚铁铵[ ](俗称莫尔盐)可溶于水,在
](俗称莫尔盐)可溶于水,在 时分解,其探究其化学性质,甲、乙两同学设计了如下实验。
时分解,其探究其化学性质,甲、乙两同学设计了如下实验。
Ⅰ. 探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如图所示的装置进行实验。装置C中可观察到的现象是_______ ,由此可知分解产物中有_______ (填化学式)。
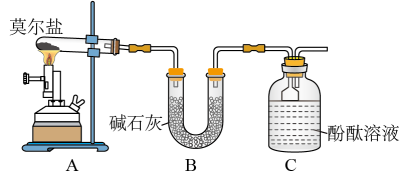
(2)乙同学认为莫尔盐晶体分解的产物中还可能含有 、
、 及
及 。为验证产物的存在,用下列装置进行实验。
。为验证产物的存在,用下列装置进行实验。
①乙同学的实验中,装置依次连按的合理顺序为:A→H→→→→G。_______
②证明含有 的实验现象是
的实验现象是_______ 。
Ⅱ. 为测定硫酸亚铁铵纯度,称取mg莫尔盐样品,配成 溶液。甲、乙两位同学设计了如下两个实验方案。
溶液。甲、乙两位同学设计了如下两个实验方案。
甲方案:取 样品溶液用
样品溶液用 的酸性
的酸性 溶液分三次进行测定。
溶液分三次进行测定。
乙方案(通过 测定):实验设计装置如图所示。取
测定):实验设计装置如图所示。取 样品溶液进行该实验。
样品溶液进行该实验。
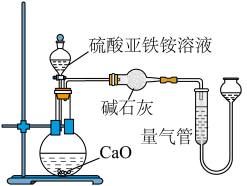
请回答:
(3)乙方案中量气管中最佳试剂是_______ 。
a. 水 b. 饱和 溶液 c.
溶液 c.  d. 饱和
d. 饱和 溶液
溶液
(4)乙方案中收集完气体并恢复至室温,为了减小实验误差,读数前应进行的操作是_______ 。
(5)若测得 为VL(已折算为标准状况下),则硫酸亚铁铵纯度为
为VL(已折算为标准状况下),则硫酸亚铁铵纯度为_______ (列出计算式)。
 ](俗称莫尔盐)可溶于水,在
](俗称莫尔盐)可溶于水,在 时分解,其探究其化学性质,甲、乙两同学设计了如下实验。
时分解,其探究其化学性质,甲、乙两同学设计了如下实验。Ⅰ. 探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如图所示的装置进行实验。装置C中可观察到的现象是

(2)乙同学认为莫尔盐晶体分解的产物中还可能含有
 、
、 及
及 。为验证产物的存在,用下列装置进行实验。
。为验证产物的存在,用下列装置进行实验。 |  |  |  |  |
| D. 品红溶液 | E.  溶液 溶液 | F.  溶液和足量盐酸 溶液和足量盐酸 | G. 排水集气法 | H.安全瓶 |
②证明含有
 的实验现象是
的实验现象是Ⅱ. 为测定硫酸亚铁铵纯度,称取mg莫尔盐样品,配成
 溶液。甲、乙两位同学设计了如下两个实验方案。
溶液。甲、乙两位同学设计了如下两个实验方案。甲方案:取
 样品溶液用
样品溶液用 的酸性
的酸性 溶液分三次进行测定。
溶液分三次进行测定。乙方案(通过
 测定):实验设计装置如图所示。取
测定):实验设计装置如图所示。取 样品溶液进行该实验。
样品溶液进行该实验。
请回答:
(3)乙方案中量气管中最佳试剂是
a. 水 b. 饱和
 溶液 c.
溶液 c.  d. 饱和
d. 饱和 溶液
溶液(4)乙方案中收集完气体并恢复至室温,为了减小实验误差,读数前应进行的操作是
(5)若测得
 为VL(已折算为标准状况下),则硫酸亚铁铵纯度为
为VL(已折算为标准状况下),则硫酸亚铁铵纯度为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】某校学生用如图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。请回答下列问题:
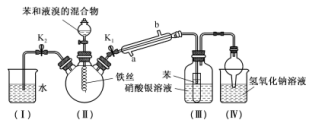
(1)装置(Ⅱ)中发生反应的化学方程式为 2Fe+3Br2 ═2FeBr3、___________ 。
(2)实验开始时,关闭 K2、开启 K1和分液漏斗活塞,滴加苯和液溴的混合液, Ⅲ中小试管内苯的作用是__________ 。
(3)能说明苯与液溴发生了取代反应的现象是___________ 。
(4)反应结束后,要让装置I中的水倒吸入装置Ⅱ中,这样操作的目的是_____ 。简述这一操作的方法:_____ 。
(5)四个实验装置中能起到防倒吸作用的装置有___________ 。
(6)将装置(Ⅱ)反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。
①用蒸馏水洗涤,振荡,分液; ②用5%的NaOH溶液洗涤,振荡,分液;
③用蒸馏水洗涤,振荡,分液; ④加入无水CaCl2粉末干燥;⑤________ (填操作名称)。

(1)装置(Ⅱ)中发生反应的化学方程式为 2Fe+3Br2 ═2FeBr3、
(2)实验开始时,关闭 K2、开启 K1和分液漏斗活塞,滴加苯和液溴的混合液, Ⅲ中小试管内苯的作用是
(3)能说明苯与液溴发生了取代反应的现象是
(4)反应结束后,要让装置I中的水倒吸入装置Ⅱ中,这样操作的目的是
(5)四个实验装置中能起到防倒吸作用的装置有
(6)将装置(Ⅱ)反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。
①用蒸馏水洗涤,振荡,分液; ②用5%的NaOH溶液洗涤,振荡,分液;
③用蒸馏水洗涤,振荡,分液; ④加入无水CaCl2粉末干燥;⑤
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】Ⅰ.化合物Mg5Al3(OH)19(H2O)4可做环保型阻燃材料,受热时按如下化学方程式分解:2Mg5Al3(OH)19(H2O)4  27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
Ⅱ.磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:

(1)A的组成元素为_________ (用元素符号表示),化学式为______ 。
(2)溶液C可溶解铜片,列举该反应的一个实际应用____________ 。
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),该气体分子的电子式为____ 。写出该反应的离子方程式__________ 。
(4)写出F→G反应的化学方程式_____________ 。设计实验方案探究溶液G中的主要微粒(不考虑H2O、H+、K+、I-)______________ 。
 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3Ⅱ.磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:

(1)A的组成元素为
(2)溶液C可溶解铜片,列举该反应的一个实际应用
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),该气体分子的电子式为
(4)写出F→G反应的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】化学小组用双液原电池原理研究酸碱性对物质氧化性、还原性强弱的影响。通过改溶液酸碱性,观察电压表读数的变化,读数越大,则对应物质的氧化性(或还原性)越强。
已知:①电压高低主要与电极反应有关,还与溶液的温度、离子的浓度、pH值等因素有关。
② 的还原产物与溶液酸碱性有关,在强酸性溶液中,被还原为
的还原产物与溶液酸碱性有关,在强酸性溶液中,被还原为 ;在中性和弱碱性溶液中,被还原为
;在中性和弱碱性溶液中,被还原为 ;在强碱性溶液中,被还原为
;在强碱性溶液中,被还原为 。
。

(1)连接电压表,形成闭合回路,测得初始电压为 。实验装置要置于水浴内的原因:
。实验装置要置于水浴内的原因:_____ 。
实验操作和读数记录如下:
(2)同学甲根据实验③推导出酸性增强, 的氧化性增强,实验②可以得出:
的氧化性增强,实验②可以得出:_______ 。
(3)同学乙认为实验①中,加入酸后,还原剂转化成了_______ (填化学式)。
(4)同学丙认为实验设计不够严谨,以实验①②为例,应该往左边烧杯中加入_______ ,测得电压为 ,以此作为实验①②的初始电压。
,以此作为实验①②的初始电压。
(5)同学丁认为,实验③加入5mL 溶液后,右边烧杯内的电极反应为:
溶液后,右边烧杯内的电极反应为:_______ 。实验④加入5mLNaOH溶液后,右边烧杯内的电极反应为:_______ 。
已知:①电压高低主要与电极反应有关,还与溶液的温度、离子的浓度、pH值等因素有关。
②
 的还原产物与溶液酸碱性有关,在强酸性溶液中,被还原为
的还原产物与溶液酸碱性有关,在强酸性溶液中,被还原为 ;在中性和弱碱性溶液中,被还原为
;在中性和弱碱性溶液中,被还原为 ;在强碱性溶液中,被还原为
;在强碱性溶液中,被还原为 。
。
(1)连接电压表,形成闭合回路,测得初始电压为
 。实验装置要置于水浴内的原因:
。实验装置要置于水浴内的原因:实验操作和读数记录如下:
左烧杯( / / ) ) | 右烧杯( ,调pH=4) ,调pH=4) | 电压表读数变化 | |
| ① | 逐滴加入5mL0.05mol/L | 由 逐渐降低 逐渐降低 | |
| ② | 逐滴加入5mL0.1mol/LNaOH | 由 逐渐升高 逐渐升高 | |
| ③ | 逐滴加入5mL0.05mol/L | 由 逐渐升高 逐渐升高 | |
| ④ | 加入少量0.1mol/LNaOH | 由 略微下降 略微下降 | |
| 继续逐滴加入NaOH至5mL | 再迅速下降 |
(2)同学甲根据实验③推导出酸性增强,
 的氧化性增强,实验②可以得出:
的氧化性增强,实验②可以得出:(3)同学乙认为实验①中,加入酸后,还原剂转化成了
(4)同学丙认为实验设计不够严谨,以实验①②为例,应该往左边烧杯中加入
 ,以此作为实验①②的初始电压。
,以此作为实验①②的初始电压。(5)同学丁认为,实验③加入5mL
 溶液后,右边烧杯内的电极反应为:
溶液后,右边烧杯内的电极反应为:
您最近一年使用:0次

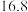

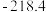

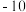
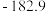
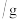
 净增质量
净增质量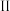 净增质量
净增质量