(1)1mol NH4+质量为_____ ,其中含质子、电子的数目分别为_____ 、_____ 。
(2)标准状态下,672mL某气体质量为0.84g,该气体摩尔质量为_____ 。
CO 和CO2 混合气体的密度相对氢气为19,则CO 和CO2体积比为_________ ,若某原子的摩尔质量是M g /mol,则一个该原子的真实质量是____________ g;将标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg/mL,则该盐酸的物质的量浓度是___________ 。
(2)标准状态下,672mL某气体质量为0.84g,该气体摩尔质量为
CO 和CO2 混合气体的密度相对氢气为19,则CO 和CO2体积比为
更新时间:2018-03-21 17:27:43
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。
(1)实验前:①配制500mL 0.1 mol•L-1H2SO4,所需的定量仪器有______ ,②再用0.1 mol•L-1H2SO4洗涤Fe粉,其目的是______ ,然后用蒸馏水洗涤至中性;③将KNO3溶液的pH调至2.5;④为防止空气中的O2对脱氮的影响,对KNO3溶液的处理方法为______ 。
(2)下图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式______ 。
(3)研究表明铁粉和活性炭粉混合使用可提高脱氮的效率,其可能的原因是______ 。
(4)根据图说明,地下水中的CO32-会使脱氮效率偏低可能的原因______ 。
(5)处理后的废液经过一定的加工步骤,可以转化为硝酸铁,用作媒染剂、铜着色剂、医药等,若0.56吨经稀H2SO4、蒸馏水洗涤并干燥后的铁粉,处理废液后,最后可以转化为硝酸铁固体______ 吨。
(1)实验前:①配制500mL 0.1 mol•L-1H2SO4,所需的定量仪器有
(2)下图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式

(3)研究表明铁粉和活性炭粉混合使用可提高脱氮的效率,其可能的原因是
(4)根据图说明,地下水中的CO32-会使脱氮效率偏低可能的原因
(5)处理后的废液经过一定的加工步骤,可以转化为硝酸铁,用作媒染剂、铜着色剂、医药等,若0.56吨经稀H2SO4、蒸馏水洗涤并干燥后的铁粉,处理废液后,最后可以转化为硝酸铁固体
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】钠是一种非常活泼、具有广泛应用的金属。
(1)钠的原子结构示意图为___________ ,钠在反应中容易___________ 电子(填“得到”或“失去”)。
(2)汽车安全气囊的气体发生剂 可由金属钠生产。某汽车安全气囊内含
可由金属钠生产。某汽车安全气囊内含 、
、 和
和 等物质。
等物质。
ⅰ.当汽车发生较严重的碰撞时,引发 分解
分解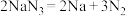 ,从而为气囊充气。产生的Na立即与
,从而为气囊充气。产生的Na立即与 发生置换反应生成
发生置换反应生成 ,化学方程式是
,化学方程式是___________ 。
ⅱ. 是冷却剂,吸收产气过程释放的热量。
是冷却剂,吸收产气过程释放的热量。 起冷却作用时发生反应的化学方程式为
起冷却作用时发生反应的化学方程式为___________ 。
ⅲ.一个安全气囊通常装有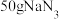 ,其完全分解所释放的
,其完全分解所释放的 为
为___________ mol。(保留两位小数)
(3)工业通过电解NaCl生产金属钠: ,过程如下:
,过程如下:
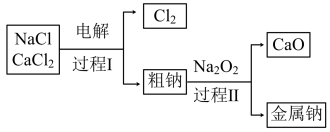
已知:电解时需要将NaCl加热至熔融状态。NaCl的熔点为801℃,为降低能耗,通常加入 从而把熔点降至约580℃。
从而把熔点降至约580℃。
①把NaCl固体加热至熔融状态,目的是___________ 。
②粗钠中含有少量杂质Ca,过程Ⅱ除去Ca的化学方程式是___________ 。
(1)钠的原子结构示意图为
(2)汽车安全气囊的气体发生剂
 可由金属钠生产。某汽车安全气囊内含
可由金属钠生产。某汽车安全气囊内含 、
、 和
和 等物质。
等物质。ⅰ.当汽车发生较严重的碰撞时,引发
 分解
分解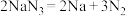 ,从而为气囊充气。产生的Na立即与
,从而为气囊充气。产生的Na立即与 发生置换反应生成
发生置换反应生成 ,化学方程式是
,化学方程式是ⅱ.
 是冷却剂,吸收产气过程释放的热量。
是冷却剂,吸收产气过程释放的热量。 起冷却作用时发生反应的化学方程式为
起冷却作用时发生反应的化学方程式为ⅲ.一个安全气囊通常装有
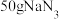 ,其完全分解所释放的
,其完全分解所释放的 为
为(3)工业通过电解NaCl生产金属钠:
 ,过程如下:
,过程如下:
已知:电解时需要将NaCl加热至熔融状态。NaCl的熔点为801℃,为降低能耗,通常加入
 从而把熔点降至约580℃。
从而把熔点降至约580℃。①把NaCl固体加热至熔融状态,目的是
②粗钠中含有少量杂质Ca,过程Ⅱ除去Ca的化学方程式是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】填空。
(1)常温常压条件下,相同体积的NH3和H2S所含N、S质量之比为___________ 。
(2)40.5 g某金属氯化物MCl2中含有0.6 molC1-,则M的相对原子质量为___________ 。
(3)a mLAl2(SO4)3溶液中含 b g,则溶液中A13+的物质的量浓度
b g,则溶液中A13+的物质的量浓度___________ 。
(4)用化学方法测量一个容器A的体积:把47.5 g MgC12放入500 mL烧杯中,加入150 mL蒸馏水;待MgCl2完全溶解后,将溶液全部转移到容器A中,用蒸馏水稀释至完全充满容器A;从中取出溶液50 mL,该溶液恰好与20 mL0.20 mol·L-1AgNO3溶液完全反应。通过计算可知该容器A的体积为___________ L。
(5)把V L含有MgSO4与K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为Mg(OH)2;另一份加入含b mol BaCl2的溶液,恰好使 完全沉淀为BaSO4,则原混合溶液中钾离子的物质的量浓度为
完全沉淀为BaSO4,则原混合溶液中钾离子的物质的量浓度为___________ 。
(1)常温常压条件下,相同体积的NH3和H2S所含N、S质量之比为
(2)40.5 g某金属氯化物MCl2中含有0.6 molC1-,则M的相对原子质量为
(3)a mLAl2(SO4)3溶液中含
 b g,则溶液中A13+的物质的量浓度
b g,则溶液中A13+的物质的量浓度(4)用化学方法测量一个容器A的体积:把47.5 g MgC12放入500 mL烧杯中,加入150 mL蒸馏水;待MgCl2完全溶解后,将溶液全部转移到容器A中,用蒸馏水稀释至完全充满容器A;从中取出溶液50 mL,该溶液恰好与20 mL0.20 mol·L-1AgNO3溶液完全反应。通过计算可知该容器A的体积为
(5)把V L含有MgSO4与K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为Mg(OH)2;另一份加入含b mol BaCl2的溶液,恰好使
 完全沉淀为BaSO4,则原混合溶液中钾离子的物质的量浓度为
完全沉淀为BaSO4,则原混合溶液中钾离子的物质的量浓度为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】(1)已知8 g A能与32 g B恰好完全反应,生成22 g C和一定量的D;现将16 g A与70 g B混合,充分反应后,生成2 mol D和一定量的C,则D的摩尔质量为__________ 。
(2)6.02×1023个钠离子的物质的量为____ 。
(3)阿伏伽德罗常数个粒子的物质的量是__________ 。
(4)将4gNaOH溶于__ g水中,可使溶液中H2O与Na+的物质的量之比等于20:1,此溶液中溶质的质量分数为__ % ;若测得该溶液的密度为1.1g/cm3,则该溶液体积为__________ ,溶液中c(Na+)为__________ 。
(2)6.02×1023个钠离子的物质的量为
(3)阿伏伽德罗常数个粒子的物质的量是
(4)将4gNaOH溶于
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】设NA表示阿伏加德罗常数的值。回答下列问题:
(1)0.3mol NH3分子中所含原子数与___ 个H2O分子中所含原子数相等。
(2)一定条件下,16g A和20g B恰好完全反应生成0.04mol C和31.76g D,则C的摩尔质量是___ 。
(3)标况下,相同质量的O2、O3的体积之比为___ ,氧原子的个数之比为___ 。
(4)标况下,已知CO和CO2的混合气体共22.4L,质量为36g,则其中CO2为___ mol。
(5)在NaCl和AlCl3的混合溶液中,Na+和Al3+的物质的量浓度之比为2:1,则2L含1mol Cl-的该溶液中,阳离子的总物质的量浓度为___ 。
(1)0.3mol NH3分子中所含原子数与
(2)一定条件下,16g A和20g B恰好完全反应生成0.04mol C和31.76g D,则C的摩尔质量是
(3)标况下,相同质量的O2、O3的体积之比为
(4)标况下,已知CO和CO2的混合气体共22.4L,质量为36g,则其中CO2为
(5)在NaCl和AlCl3的混合溶液中,Na+和Al3+的物质的量浓度之比为2:1,则2L含1mol Cl-的该溶液中,阳离子的总物质的量浓度为
您最近一年使用:0次

 =_____Fe3++_____NO↑+_____H2O
=_____Fe3++_____NO↑+_____H2O


