某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000 mol•L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且半分钟不变色,测得所耗盐酸的体积为V1mL。
④重复以上过程两次,但在重复第一次时滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)锥形瓶中的溶液从_________ 色变为______ 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察____________
A.滴定管内液面的变化B.锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是______________________ ,由此造成的测定结果_________________ (偏高、偏低或无影响)
(4)步骤②缺少的操作是________________________________
(5)下图,是某次滴定时的滴定管中的液面,其读数为_____________ mL

(6)V1______ V2(填大于、小于、或等于)
(7)纠正错误以后实验测出下列数据:
请计算待测烧碱溶液的浓度:____________________ mol•L-1
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000 mol•L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且半分钟不变色,测得所耗盐酸的体积为V1mL。
④重复以上过程两次,但在重复第一次时滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)锥形瓶中的溶液从
(2)滴定时边滴边摇动锥形瓶,眼睛应观察
A.滴定管内液面的变化B.锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是
(4)步骤②缺少的操作是
(5)下图,是某次滴定时的滴定管中的液面,其读数为

(6)V1
(7)纠正错误以后实验测出下列数据:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
| 第三次 | 25.00 | 0.50 | 23.40 |
更新时间:2018-04-05 19:41:38
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】室温下,用0.1000 mol⋅L NaOH溶液滴定20.00 mL 0.1000 mol⋅L
NaOH溶液滴定20.00 mL 0.1000 mol⋅L HCl溶液过程中,溶液的pH随NaOH溶液体积的变化如图所示:
HCl溶液过程中,溶液的pH随NaOH溶液体积的变化如图所示:
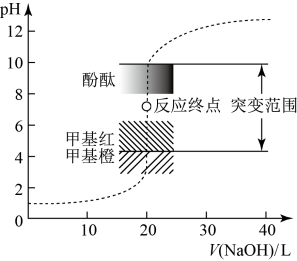
(1)滴定管在加溶液滴定前,需要进行的操作是____________ 和____________ 。
当 mL时,溶液中所有离子的浓度存在的关系是
mL时,溶液中所有离子的浓度存在的关系是____________ 。
(2)已知 。当加入的
。当加入的 mL时,溶液中
mL时,溶液中
_____
(3)下列说法不正确 的是___
(4)在化学分析中,以 标准溶液滴定溶液中的
标准溶液滴定溶液中的 时,采用
时,采用 为指示剂,利用
为指示剂,利用 和
和 反应生成砖红色沉淀表示滴定终点。当溶液中的
反应生成砖红色沉淀表示滴定终点。当溶液中的 恰好完全沉淀时,溶液中的
恰好完全沉淀时,溶液中的
______ mol/L;
______ mol/L。
已知:①25℃时, ,
,
②当溶液中某种离子的浓度等于或小于 mol/L时,可认为已完全沉淀。
mol/L时,可认为已完全沉淀。
 NaOH溶液滴定20.00 mL 0.1000 mol⋅L
NaOH溶液滴定20.00 mL 0.1000 mol⋅L HCl溶液过程中,溶液的pH随NaOH溶液体积的变化如图所示:
HCl溶液过程中,溶液的pH随NaOH溶液体积的变化如图所示:
(1)滴定管在加溶液滴定前,需要进行的操作是
当
 mL时,溶液中所有离子的浓度存在的关系是
mL时,溶液中所有离子的浓度存在的关系是(2)已知
 。当加入的
。当加入的 mL时,溶液中
mL时,溶液中
(3)下列说法
A.NaOH与盐酸恰好完全反应时, |
| B.选择甲基红指示反应终点,误差比甲基橙的大 |
| C.当接近滴定终点时,极少量的碱就会引起溶液的pH突变 |
| D.选择变色范围在pH突变范围内的指示剂,可减小实验误差 |
 标准溶液滴定溶液中的
标准溶液滴定溶液中的 时,采用
时,采用 为指示剂,利用
为指示剂,利用 和
和 反应生成砖红色沉淀表示滴定终点。当溶液中的
反应生成砖红色沉淀表示滴定终点。当溶液中的 恰好完全沉淀时,溶液中的
恰好完全沉淀时,溶液中的

已知:①25℃时,
 ,
,
②当溶液中某种离子的浓度等于或小于
 mol/L时,可认为已完全沉淀。
mol/L时,可认为已完全沉淀。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒b.容量瓶c.滴定管d.托盘天平e.温度计
(1)无“0”刻度的是___________ (填字母)。
(2)下列操作合理的是___________(填字母)。
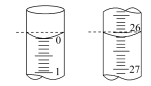
(3)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,滴加2滴酚酞作指示剂,边滴边摇动锥形瓶,直到___________ ,这表示已经到达滴定终点。记录盐酸的终读数,重复滴定3次。若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸的体积为___________ mL。
(4)某学生根据三次实验分别记录有关数据如下表:
请选用其中合理数据求出该氢氧化钠溶液物质的量浓度(计算结果保留4位有效数字):c(NaOH)=___ 。
(5)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是___________(填字母)。
a.量筒b.容量瓶c.滴定管d.托盘天平e.温度计
(1)无“0”刻度的是
(2)下列操作合理的是___________(填字母)。
| A.用25mL碱式滴定管量取20.00mLNaHCO3溶液 |
| B.用托盘天平准确称量10.20g碳酸钠固体 |
| C.用100mL量筒量取3.2mL浓硫酸 |
| D.用500mL容量瓶配制1mol·L-1的氢氧化钠溶液495.5mL |

(4)某学生根据三次实验分别记录有关数据如下表:
| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol·L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积 | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(5)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是___________(填字母)。
| A.中和滴定到达终点时俯视滴定管内液面读数 |
| B.碱式滴定管用蒸馏水洗净后立即取用25.00mL待测碱溶液注入锥形瓶进行滴定 |
| C.酸式滴定管用蒸馏水洗净后立即装标准溶液来滴定 |
| D.把配好的标准溶液倒入刚用蒸馏水洗净的试剂瓶中然后装入滴定管进行滴定 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】充有HCl气体(标准状况)的烧瓶做完喷泉实验后得到的稀盐酸溶液,用标准氢氧化钠溶液滴定,以确定该稀盐酸的准确物质的量浓度。回答下列问题:
(1)若酸式滴定管的量程为25mL,调液面为5,将该仪器中所有液体放出,则放出的溶液体积_______ 20mL(填“>”、“<”或“=”)。
(2)配制三种不同浓度的标准氢氧化钠溶液,你认为最合适的是______ (填序号)。
①5.000 mol/L ②0.5000 mol/L ③0.0500 mol/L
(3)润洗装有稀盐酸溶液的滴定管的操作为:从滴定管上口加入3~5mL稀盐酸,_____________ ,然后将液体从滴定管下部放入烧杯中。
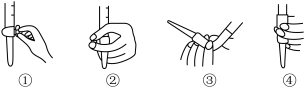
(4)滴定前排气泡时,应选择下图中的________ (填序号)。
(5)若该滴定实验用酚酞做指示剂,达到滴定终点时的现象为:当最后一滴标准NaOH溶液滴入,_____________________________________________________ 。
(6)下列操作导致所测盐酸浓度偏小的是__________ (填字母)。
A.不小心将标准液滴至锥形瓶外 B.滴定前,碱式滴定管有气泡,滴定后消失
C.刚变色后则立即记下数据 D.若用含有Na2O杂质的氢氧化钠固体配制标准溶液
(7)若采用上述合适的标准氢氧化钠溶液滴定稀盐酸,操作步骤合理,滴定后的实验数据如下:
求测得的稀盐酸的物质的量浓度为_______________ 。
(1)若酸式滴定管的量程为25mL,调液面为5,将该仪器中所有液体放出,则放出的溶液体积
(2)配制三种不同浓度的标准氢氧化钠溶液,你认为最合适的是
①5.000 mol/L ②0.5000 mol/L ③0.0500 mol/L
(3)润洗装有稀盐酸溶液的滴定管的操作为:从滴定管上口加入3~5mL稀盐酸,
(4)滴定前排气泡时,应选择下图中的

(5)若该滴定实验用酚酞做指示剂,达到滴定终点时的现象为:当最后一滴标准NaOH溶液滴入,
(6)下列操作导致所测盐酸浓度偏小的是
A.不小心将标准液滴至锥形瓶外 B.滴定前,碱式滴定管有气泡,滴定后消失
C.刚变色后则立即记下数据 D.若用含有Na2O杂质的氢氧化钠固体配制标准溶液
(7)若采用上述合适的标准氢氧化钠溶液滴定稀盐酸,操作步骤合理,滴定后的实验数据如下:
实验编号 | 待测盐酸的体积(mL) | 滴氢氧化钠溶液前刻度 | 滴氢氧化钠溶液后刻度 |
1 | 20.00 | 5.00 | 22.40 |
2 | 20.00 | 4.50 | 21.52 |
3 | 20.00 | 5.20 | 22.18 |
您最近一年使用:0次
【推荐1】羟基乙酸是一种很好的清洗剂,某兴趣小组利用羟基乙腈水解制取纯净的羟基乙酸溶液,按如图流程开展实验:

已知:①羟基乙腈水解的离子方程式:HOCH2CN(aq)+H+(aq)+2H2O(l)→HOCH2COOH(aq)+ (aq) △H<0。
(aq) △H<0。
②羟基乙酸易溶于甲醇、乙醇、乙酸乙酯等有机溶剂,易溶于水,沸点265℃,水溶液加热至沸腾时分解。高浓度羟基乙酸会形成酯类聚合物。
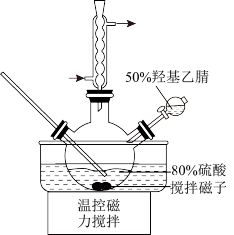
请回答:
(1)下列说法正确的是____ 。
(2)步骤Ⅲ:试剂X是____ 。
(3)步骤Ⅴ:控制70℃左右、____ 条件下浓缩,目的是____ 。
(4)为了测定羟基乙酸溶液的纯度,可采用酸碱中和滴定法。从下列选项中选出合理的操作并排序:准确称取0.6000g样品于锥形瓶中→_____→_____→_____→_____→平行滴定2~3次,计算结果。____
a.向锥形瓶中滴加2~3滴酚酞;
b.向锥形瓶中滴加2~3滴甲基橙;
c.用移液管准确移取25.00mLNaOH溶液于锥形瓶中,溶解样品;
d.向锥形瓶中加入约25mL水,溶解样品便于滴定;
e.用NaOH标准溶液滴定至终点,记录读数;
f.用HCl标准溶液滴定至终点,记录读数;
g.洗涤滴定管、装液、排气泡、调液面,记录读数。
(5)该小组用上述滴定法测得产品中羟基乙酸的质量分数为42.80%,测得结果明显偏低。分析其原因,决定在上述测定中增加一步操作,测得羟基乙酸的质量分数为60.10%,该操作是____ 。

已知:①羟基乙腈水解的离子方程式:HOCH2CN(aq)+H+(aq)+2H2O(l)→HOCH2COOH(aq)+
 (aq) △H<0。
(aq) △H<0。②羟基乙酸易溶于甲醇、乙醇、乙酸乙酯等有机溶剂,易溶于水,沸点265℃,水溶液加热至沸腾时分解。高浓度羟基乙酸会形成酯类聚合物。

请回答:
(1)下列说法正确的是
| A.步骤Ⅰ:50%羟基乙腈需分批逐步加入 |
| B.步骤Ⅱ:加大萃取剂用量,一次完成萃取以提高萃取效率 |
| C.步骤Ⅳ:用NaOH调节pH后蒸发浓缩、冷却结晶、抽滤、洗涤得到(NH4)2SO4 |
| D.步骤Ⅳ:将浓缩后的溶液放入冷水浴,可获得较大颗粒的晶体 |
(3)步骤Ⅴ:控制70℃左右、
(4)为了测定羟基乙酸溶液的纯度,可采用酸碱中和滴定法。从下列选项中选出合理的操作并排序:准确称取0.6000g样品于锥形瓶中→_____→_____→_____→_____→平行滴定2~3次,计算结果。
a.向锥形瓶中滴加2~3滴酚酞;
b.向锥形瓶中滴加2~3滴甲基橙;
c.用移液管准确移取25.00mLNaOH溶液于锥形瓶中,溶解样品;
d.向锥形瓶中加入约25mL水,溶解样品便于滴定;
e.用NaOH标准溶液滴定至终点,记录读数;
f.用HCl标准溶液滴定至终点,记录读数;
g.洗涤滴定管、装液、排气泡、调液面,记录读数。
(5)该小组用上述滴定法测得产品中羟基乙酸的质量分数为42.80%,测得结果明显偏低。分析其原因,决定在上述测定中增加一步操作,测得羟基乙酸的质量分数为60.10%,该操作是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】滴定法是重要的化学定量分析方法,包括酸碱滴定,氧化还原滴定,沉淀滴定等等,实验过程包括配制标准溶液和滴定待测溶液。现使用酸碱中和滴定法测定市售白醋的总酸量(总酸量单位:g/100mL)
(1)配制250mL 0.1000mol/L NaOH标准溶液,下列仪器不需要的是___________ (填写代号)。
(2)准备与滴定
a.待测液的准备:将10mL食用白醋稀释至100mL,用___________ (填仪器名称)量取稀释后的溶液20.00mL于锥形瓶中;
b.标准溶液的准备:用碱式滴定管盛装25.00mL NaOH标准溶液;
c.滴定:向盛有白醋样品的锥形瓶中加入2滴酚酞作为指示剂,把锥形瓶放在碱式滴定管的下方,瓶下垫一张白纸,小心地滴入碱。边滴边摇动锥形瓶(接近终点时,改为滴加半滴碱),直到因加入半滴碱后,溶液颜色从___________ 。表示已经到达滴定终点。
d.重复上述操作三次。四次测定数据如表:
(3)数据处理与计算
①所消耗NaOH溶液的平均体积为___________ mL。
②计算得出白醋的总酸量为___________ g/100mL。
③实验测定白醋的总酸量比理论值偏大,可能与下列操作有关___________ 。
A.用蒸馏水洗净碱式滴定管后,注入NaOH标准溶液进行滴定
B.用蒸馏水洗涤锥形瓶后装入一定体积的待测白醋进行滴定
C.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
D.使用碱式滴定管加液,读取体积时,开始平视读数,后来俯视读数
(4)曲线分析:以NaOH溶液的体积为横坐标,pH为纵坐标得到的滴定曲线如图所示。

①实验测得c点溶液的 ,则溶液中由水电离出来的
,则溶液中由水电离出来的
___________ mol/L;
②当溶液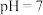 时,
时,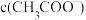 和
和 的大小关系是
的大小关系是___________ 。
(1)配制250mL 0.1000mol/L NaOH标准溶液,下列仪器不需要的是
 |  |  |  |
| A | B | C | D |
a.待测液的准备:将10mL食用白醋稀释至100mL,用
b.标准溶液的准备:用碱式滴定管盛装25.00mL NaOH标准溶液;
c.滴定:向盛有白醋样品的锥形瓶中加入2滴酚酞作为指示剂,把锥形瓶放在碱式滴定管的下方,瓶下垫一张白纸,小心地滴入碱。边滴边摇动锥形瓶(接近终点时,改为滴加半滴碱),直到因加入半滴碱后,溶液颜色从
d.重复上述操作三次。四次测定数据如表:
| 序号 | 1 | 2 | 3 | 4 |
| 标准溶液体积/mL | 20.05 | 20.00 | 18.40 | 19.95 |
①所消耗NaOH溶液的平均体积为
②计算得出白醋的总酸量为
③实验测定白醋的总酸量比理论值偏大,可能与下列操作有关
A.用蒸馏水洗净碱式滴定管后,注入NaOH标准溶液进行滴定
B.用蒸馏水洗涤锥形瓶后装入一定体积的待测白醋进行滴定
C.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
D.使用碱式滴定管加液,读取体积时,开始平视读数,后来俯视读数
(4)曲线分析:以NaOH溶液的体积为横坐标,pH为纵坐标得到的滴定曲线如图所示。

①实验测得c点溶液的
 ,则溶液中由水电离出来的
,则溶液中由水电离出来的
②当溶液
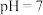 时,
时,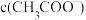 和
和 的大小关系是
的大小关系是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某化学兴趣小组欲用一定浓度的NaOH溶液测定未知浓度的盐酸,并测定该反应的反应热。试回答下列问题:
(1)用一定浓度的NaOH溶液来测定未知浓度的盐酸。
准确量取0.55mol·L-1NaOH溶液20.00mL注入锥形瓶,并加入2滴酚酞指示剂,用未知浓度的盐酸溶液进行滴定。
①当滴加最后一滴溶液时,锥形瓶内溶液恰好由___ 色突变为___ 色且在半分钟内不复色,表明达到滴定终点。
②该小组先后做了二次滴定实验,所耗盐酸的体积分别如图1和2所示,则该盐酸的物质的量浓度为___ 。

③下列操作会引起测定盐酸浓度偏高的是___ 。
A.滴定时,装NaOH溶液溶液的锥形瓶有少量水
B.酸式滴定管用蒸馏水洗后,未用待装溶液润洗
C.滴定终点读数时,俯视刻度线
D.滴定开始时酸式滴定管尖嘴部分有气泡,滴定结束后气泡消失
(2)中和反应的反应热测定。
取上述100mL盐酸与100mL0.55mol·L-1NaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算该反应的反应热。如果该实验中测得放出的热量为2.865kJ,则上述反应的热化学方程式为____ 。
(3)该小组做完实验后,某同学提出一个大胆的设想:将实验(1)和(2)结合在同一套装置中进行,即用氢氧化钠溶液测定未知浓度的盐酸,同时测定二者反应放出的热量。从实验原理的角度分析是否可行?___ 。其原因为___ 。
(1)用一定浓度的NaOH溶液来测定未知浓度的盐酸。
准确量取0.55mol·L-1NaOH溶液20.00mL注入锥形瓶,并加入2滴酚酞指示剂,用未知浓度的盐酸溶液进行滴定。
①当滴加最后一滴溶液时,锥形瓶内溶液恰好由
②该小组先后做了二次滴定实验,所耗盐酸的体积分别如图1和2所示,则该盐酸的物质的量浓度为

③下列操作会引起测定盐酸浓度偏高的是
A.滴定时,装NaOH溶液溶液的锥形瓶有少量水
B.酸式滴定管用蒸馏水洗后,未用待装溶液润洗
C.滴定终点读数时,俯视刻度线
D.滴定开始时酸式滴定管尖嘴部分有气泡,滴定结束后气泡消失
(2)中和反应的反应热测定。
取上述100mL盐酸与100mL0.55mol·L-1NaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算该反应的反应热。如果该实验中测得放出的热量为2.865kJ,则上述反应的热化学方程式为
(3)该小组做完实验后,某同学提出一个大胆的设想:将实验(1)和(2)结合在同一套装置中进行,即用氢氧化钠溶液测定未知浓度的盐酸,同时测定二者反应放出的热量。从实验原理的角度分析是否可行?
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】已知某烧碱样品中含有NaCl杂质,为测定该样品中NaOH的质量分数,进行如下实验:
①称量1. 00g样品溶于水,配成250 mL溶液;
② 用碱式滴定管准确量取25.00 mL所配溶液于锥形瓶中,滴加2 - 3滴作为指示剂;
③用0. 100 0 mol • L-1的标准盐酸滴定并重复三次,每次实验数据记录如下:
请回答下列问题:
(1)配制该溶液所需要的主要玻璃仪器为烧杯、玻璃棒_____ 。
(2)实验步骤②中,横线上填的指示剂是______ 。
(3)判断达到滴定终点时的现象为__________ 。
(4)若出现下列情况,导致测定结果偏高的是_____ (填序号)。
a.滴定前用蒸馏水冲洗锥形瓶
b.滴定过程中振荡锥形瓶时不慎使瓶内溶液溅出
c.滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管中在滴定前有气泡,滴定后气泡消失
e.滴定前仰视读数,滴定后俯视读数
f.酸式滴定管在使用前没有用标准液润洗
(5)通过计算可知该烧碱样品的纯度为__________ 。
①称量1. 00g样品溶于水,配成250 mL溶液;
② 用碱式滴定管准确量取25.00 mL所配溶液于锥形瓶中,滴加2 - 3滴作为指示剂;
③用0. 100 0 mol • L-1的标准盐酸滴定并重复三次,每次实验数据记录如下:
滴定序号 | 待测液体积/mL | 消耗盐酸的体积/mL | |
滴定前 | 滴定后 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 6.00 | 26.00 |
3 | 25.00 | 2.10 | 21.00 |
4 | 25.00 | 1.10 | 21.00 |
(1)配制该溶液所需要的主要玻璃仪器为烧杯、玻璃棒
(2)实验步骤②中,横线上填的指示剂是
(3)判断达到滴定终点时的现象为
(4)若出现下列情况,导致测定结果偏高的是
a.滴定前用蒸馏水冲洗锥形瓶
b.滴定过程中振荡锥形瓶时不慎使瓶内溶液溅出
c.滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管中在滴定前有气泡,滴定后气泡消失
e.滴定前仰视读数,滴定后俯视读数
f.酸式滴定管在使用前没有用标准液润洗
(5)通过计算可知该烧碱样品的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】(一)某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)下列操作中可能使所测NaOH溶液的浓度数值偏低的是____________ 。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
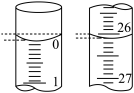
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示,所用盐酸溶液的体积为_______ mL。
(3)某学生根据3次实验分别记录有关数据如下表:
依据上表数据列式计算该NaOH溶液的物质的量浓度______________ 。
(二)已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下向20 mL 0.01 mol/L CH3COOH溶液中逐滴加入0.01 mol/L KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
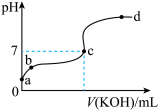
(1)c点溶液中的离子浓度大小顺序为________________ 。
(2)a、b、c三点中水的电离程度最大的是________ 。
(1)下列操作中可能使所测NaOH溶液的浓度数值偏低的是
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示,所用盐酸溶液的体积为

(3)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.50 | |
| 第二次 | 25.00 | 1.56 | 30.30 | |
| 第三次 | 25.00 | 0.22 | 26.76 | |
(二)已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下向20 mL 0.01 mol/L CH3COOH溶液中逐滴加入0.01 mol/L KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:

(1)c点溶液中的离子浓度大小顺序为
(2)a、b、c三点中水的电离程度最大的是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某同学用0.1000mol·L-1的NaOH溶液滴定待测醋酸的浓度。
(1)选用图一中仪器_______ (填“A”或“B”)取待测醋酸25.00mL于锥形瓶中,滴加2滴_______ 作指示剂。

(2)滴定中,滴定管液面的位置如图二表示,其读数为_______ mL。

(3)排除碱式滴定管中气泡的方法应采用如图三所示操作中的_______ (选填序号),然后小心操作使尖嘴部分充满碱液。

(4)滴定到达终点的现象是_______ 。
(5)该同学三次实验数据如下表所示。根据表中数据计算待测醋酸的浓度是_______ mol·L-1。
(6)以下操作会导致测定结果偏低的是_______ (填序号)。
①配制标准溶液的固体NaOH中含有KOH杂质
②滴定前盛放醋酸溶液的锥形瓶用蒸馏水洗净后没有干燥
③滴定前读数时仰视,滴定后俯视
④滴定前未排出滴定管尖嘴的气泡,滴定后气泡消失
⑤酸式滴定管使用前,水洗后未用待测醋酸润洗
(1)选用图一中仪器

(2)滴定中,滴定管液面的位置如图二表示,其读数为

(3)排除碱式滴定管中气泡的方法应采用如图三所示操作中的

(4)滴定到达终点的现象是
(5)该同学三次实验数据如下表所示。根据表中数据计算待测醋酸的浓度是
| 实验编号 | 待测醋酸的体积/mL | 滴定前NaOH溶液的体积读数/mL | 滴定后NaOH溶液的体积读数/mL |
| 1 | 25.00 | 0.98 | 27.70 |
| 2 | 25.00 | 0.71 | 28.02 |
| 3 | 25.00 | 0.64 | 27.42 |
(6)以下操作会导致测定结果偏低的是
①配制标准溶液的固体NaOH中含有KOH杂质
②滴定前盛放醋酸溶液的锥形瓶用蒸馏水洗净后没有干燥
③滴定前读数时仰视,滴定后俯视
④滴定前未排出滴定管尖嘴的气泡,滴定后气泡消失
⑤酸式滴定管使用前,水洗后未用待测醋酸润洗
您最近一年使用:0次



