在1×105Pa和298K时,将1mol气态AB分子分离成气态A原子和B原子所需要的能量称为键能(kJ/mol)。下面是一些共价键的键能: (已知氨分子中有三个等价的氮氢共价键)
工业合成氨的化学方程式: N2+3H2 2NH3
2NH3
(1) 断开1mol N2中的化学键需_______ (填“吸收”或“放出”)_____ kJ 能量;
(2) 形成2mol NH3中的化学键需_______ (填“吸收”或“放出”)__ kJ 能量;
(3) 在298 K时,取1mol N2和3 mol H2放入一密闭容器中,在催化剂存在下进行反应。理论上放出或吸收的热量为Q1,则Q1为_____ kJ。根据上表中的数据判断工业合成氨的反应是_______ (填“吸热”或“放热”)反应。
| 共价键 | H-H 键 | N三N键 | N-H 键 |
| 键能(kJ/mol) | 436 | 945 | 391 |
工业合成氨的化学方程式: N2+3H2
 2NH3
2NH3(1) 断开1mol N2中的化学键需
(2) 形成2mol NH3中的化学键需
(3) 在298 K时,取1mol N2和3 mol H2放入一密闭容器中,在催化剂存在下进行反应。理论上放出或吸收的热量为Q1,则Q1为
更新时间:2018-04-21 09:29:50
|
相似题推荐
计算题
|
较易
(0.85)
解题方法
【推荐1】下表列出了3种化学键的键能:
请根据以上信息写出氢气在氯气中燃烧生成氯化氢气体的热化学方程式_________ 。
| 化学键 | H—H | Cl—Cl | H—Cl |
键能/( ) ) | 436 | 243 | 431 |
您最近一年使用:0次
计算题
|
较易
(0.85)
解题方法
【推荐2】甲烷和二氧化碳都是温室气体。随着石油资源日益枯竭,储量丰富的甲烷(天然气、页岩气、可燃冰的主要成分)及二氧化碳的高效利用已成为科学研究的热点。回答下列问题:
(1)在催化剂作用下,将甲烷部分氧化制备合成气(CO和H2)的反应为CH4(g)+ O2(g)=CO(g)+2H2(g)。
O2(g)=CO(g)+2H2(g)。
①已知:25℃,101kPa,由稳定单质生成1mol化合物的焓变称为该化合物的标准摩尔生成焓。化学反应的反应热ΔH=生成物的标准摩尔生成焓总和-反应物的标准摩尔生成焓总和。相关数据如下表:
由此计算CH4(g)+ O2(g)=CO(g)+2H2(g)的∆H=
O2(g)=CO(g)+2H2(g)的∆H=_______ kJ·mol-1。
(1)在催化剂作用下,将甲烷部分氧化制备合成气(CO和H2)的反应为CH4(g)+
 O2(g)=CO(g)+2H2(g)。
O2(g)=CO(g)+2H2(g)。①已知:25℃,101kPa,由稳定单质生成1mol化合物的焓变称为该化合物的标准摩尔生成焓。化学反应的反应热ΔH=生成物的标准摩尔生成焓总和-反应物的标准摩尔生成焓总和。相关数据如下表:
| 物质 | CH4 | O2 | CO | H2 |
| 标准摩尔生成焓/kJ∙mol-1 | -74.8 | 0 | -110.5 | 0 |
由此计算CH4(g)+
 O2(g)=CO(g)+2H2(g)的∆H=
O2(g)=CO(g)+2H2(g)的∆H=
您最近一年使用:0次
【推荐3】(1)若适量的N2和O2完全反应,每生成23g NO2需要吸收16.95kJ热量。其热化学方程式为_ 。
(2)甲醇(CH3OH)的燃烧热为725.8kJ/mol,写出甲醇的燃烧热的热化学方程式_____ 。
(3)已知H-H键的键能为436kJ·mol-1,Cl-Cl键的键能为243 kJ·mol-1,H-Cl键的键能为431kJ·mol-1,则H2(g)+Cl2(g)=2HCl(g)的反应热(ΔH)等于_____ kJ·mol-1
(4)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)⇌NaNO3(s)+ClNO(g) K1 ΔH1
2NO(g)+Cl2(g)⇌2ClNO(g) K2 ΔH2
则4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=___ (用含有K1、K2的式子表示);其反应热为______ (用含有ΔH1、ΔH2的式子表示)。
(2)甲醇(CH3OH)的燃烧热为725.8kJ/mol,写出甲醇的燃烧热的热化学方程式
(3)已知H-H键的键能为436kJ·mol-1,Cl-Cl键的键能为243 kJ·mol-1,H-Cl键的键能为431kJ·mol-1,则H2(g)+Cl2(g)=2HCl(g)的反应热(ΔH)等于
(4)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)⇌NaNO3(s)+ClNO(g) K1 ΔH1
2NO(g)+Cl2(g)⇌2ClNO(g) K2 ΔH2
则4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=
您最近一年使用:0次
计算题
|
较易
(0.85)
【推荐1】(1)键能可以简单地理解为断开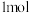 化学键时所需吸收的能量。下表是部分化学键的键能数据:
化学键时所需吸收的能量。下表是部分化学键的键能数据:
已知白磷的燃烧热为2378.0kJ·mol-1,白磷及白磷完全燃烧所得产物的结构分别如图(a)、(b)所示,则上表中x=______ 。

(2)硅晶体的结构如图所示,请根据表中化学键的键能计算反应SiCl4(g)+2H2(g)═Si(s)+4HCl(g)的反应热ΔH为______ 。

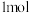 化学键时所需吸收的能量。下表是部分化学键的键能数据:
化学键时所需吸收的能量。下表是部分化学键的键能数据:| 化学键 | P-P | P-O | O=O | P=O |
| 键能/( kJ·mol-1) | 197 | 360 | 499 | x |
已知白磷的燃烧热为2378.0kJ·mol-1,白磷及白磷完全燃烧所得产物的结构分别如图(a)、(b)所示,则上表中x=

(2)硅晶体的结构如图所示,请根据表中化学键的键能计算反应SiCl4(g)+2H2(g)═Si(s)+4HCl(g)的反应热ΔH为
| 化学键 | Si-Cl | H-H | H-Cl | Si-Si |
| 键能/( kJ·mol-1) | 360 | 436 | 431 | 176 |

您最近一年使用:0次
计算题
|
较易
(0.85)
【推荐2】SF6是一种优良的绝缘气体,分子结构中只存在S‒F键。已知:1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF‒F、S‒F键需要吸收的能量分别为160kJ、330kJ。则S(s)+3F2(g)=SF6(g)的反应热ΔH为_______ 。
您最近一年使用:0次
计算题
|
较易
(0.85)
名校
【推荐3】在25℃、101kPa的条件下,断裂1molH—H键吸收436kJ能量,断裂1molCl—Cl键吸收243kJ能量,形成1molH-Cl键放出431 kJ能量。H2+Cl2=2HCl的化学反应可用如图表示:
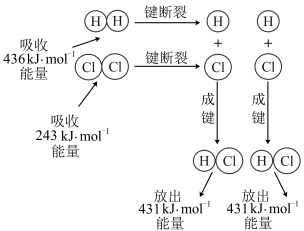
请回答下列有关问题:
(1)反应物断键吸收的总能量为___________________ 。
(2)生成物成键放出的总能量为______________ 。
(3)判断H2+Cl2=2HCl反应_____________ (填“吸收”或“放出”)能量。
(4)反应物的总能量________ (填“>”、“=”或“<”)生成物的总能量。

请回答下列有关问题:
(1)反应物断键吸收的总能量为
(2)生成物成键放出的总能量为
(3)判断H2+Cl2=2HCl反应
(4)反应物的总能量
您最近一年使用:0次
计算题
|
较易
(0.85)
【推荐1】到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源。
请回答下列问题:
⑴2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2599kJ·mol-1,
则乙炔的燃烧热为_______ 。
⑵有些反应进行得很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难,此时可利用盖斯定律,就可以间接地把它们的反应热计算出来。已知
①CO(g)+1/2O2(g)=== CO2(g) ΔH1=-283.0kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH2=-393.5kJ·mol-1
则C(s)+1/2O2(g)=CO(g) ΔH =__________ 。
⑶从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。已知键能数据如下表。
反应N2+3H2 2NH3△H=akJ·mol-1。试根据表中所列键能数据估算a的数值
2NH3△H=akJ·mol-1。试根据表中所列键能数据估算a的数值__________ 。
⑷最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。该方法既有液氢燃料电池的优点,又克服了液氢不易保存的不足。其装置为用铂黑作为电极,插入强碱溶液中,一个电极通入空气,另一电极通入氨气。其电池总反应为4NH3+3O2═2N2+6H2O。试写出负极电极反应式______________ 。
请回答下列问题:
⑴2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2599kJ·mol-1,
则乙炔的燃烧热为
⑵有些反应进行得很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难,此时可利用盖斯定律,就可以间接地把它们的反应热计算出来。已知
①CO(g)+1/2O2(g)=== CO2(g) ΔH1=-283.0kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH2=-393.5kJ·mol-1
则C(s)+1/2O2(g)=CO(g) ΔH =
⑶从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。已知键能数据如下表。
| 化学键 | 键能(kJ/mol) | 化学键 | 键能(kJ/mol) |
| N≡N | 942 | H-O | 460 |
| N-H | 391 | O=O | 499 |
| H-H | 437 |
反应N2+3H2
 2NH3△H=akJ·mol-1。试根据表中所列键能数据估算a的数值
2NH3△H=akJ·mol-1。试根据表中所列键能数据估算a的数值⑷最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。该方法既有液氢燃料电池的优点,又克服了液氢不易保存的不足。其装置为用铂黑作为电极,插入强碱溶液中,一个电极通入空气,另一电极通入氨气。其电池总反应为4NH3+3O2═2N2+6H2O。试写出负极电极反应式
您最近一年使用:0次
计算题
|
较易
(0.85)
解题方法
【推荐2】(1)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为____________________ 。
(2)已知: 2Fe(s)+O2(g)=2FeO(s) ΔH=-544.0kJ·mol-1
4Al(s)+3O2(g)=2Al2O3(s) ΔH=-3351.4kJ·mol-1
则Al和FeO发生铝热反应的热化学方程式为:_______________________ 。
(2)已知: 2Fe(s)+O2(g)=2FeO(s) ΔH=-544.0kJ·mol-1
4Al(s)+3O2(g)=2Al2O3(s) ΔH=-3351.4kJ·mol-1
则Al和FeO发生铝热反应的热化学方程式为:
您最近一年使用:0次


 共价键所吸收的能量。已知
共价键所吸收的能量。已知 键的键能为
键的键能为 ,
, 键的键能为
键的键能为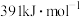 ,根据热化学方程式:
,根据热化学方程式: ,则
,则 键的键能是
键的键能是

