CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为______ (写离子符号);若所得溶液c(HCO3−)∶c(CO32−)=2∶1,溶液pH=___________ 。(室温下,H2CO3的K1=4×10−7;K2=5×10−11)
(2)CO2与CH4经催化重整,制得合成气:
CH4(g)+ CO2(g)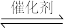 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)
①已知上述反应中相关的化学键键能数据如下:
则该反应的ΔH=_________ 。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是_______ (填“A” 或“B ”)。
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图3所示。此反应优选温度为900℃的原因是________ 。
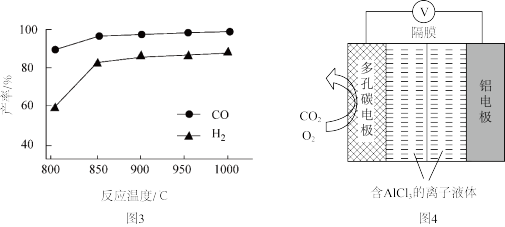
(3)O2辅助的Al~CO2电池工作原理如图4所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的负极反应式:________ 。
电池的正极反应式:6O2+6e− 6O2−
6O2−
6CO2+6O2− 3C2O42−+6O2
3C2O42−+6O2
反应过程中O2的作用是________ 。
该电池的总反应式:________ 。
(1)CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为
(2)CO2与CH4经催化重整,制得合成气:
CH4(g)+ CO2(g)
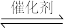 2CO (g)+ 2H2(g)
2CO (g)+ 2H2(g)①已知上述反应中相关的化学键键能数据如下:
| 化学键 | C—H | C=O | H—H | C O(CO) O(CO) |
| 键能/kJ·mol−1 | 413 | 745 | 436 | 1075 |
则该反应的ΔH=
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如图3所示。此反应优选温度为900℃的原因是

(3)O2辅助的Al~CO2电池工作原理如图4所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的负极反应式:
电池的正极反应式:6O2+6e−
 6O2−
6O2−6CO2+6O2−
 3C2O42−+6O2
3C2O42−+6O2反应过程中O2的作用是
该电池的总反应式:
2018·天津·高考真题 查看更多[11]
10-2023新东方高二上期中考化学浙江省杭州第十四中学2023-2024学年高二上学期 期中考试化学试卷天津市宁河区芦台第一中学2022-2023学年高三上学期1月期末考试化学试题(已下线)化学(上海A卷)-学易金卷:2023年高考第一次模拟考试卷四川省蓬安中学校2020届高三上学期入学考试化学试题(已下线)专题14 化学反应原理综合-备战2021届高考化学二轮复习题型专练贵州省惠水县第一高级中学2019-2020学年高三上学期期末考试化学试题云南省玉溪元江民中2020届高三开学考试化学试题【全国百强校】黑龙江省哈尔滨市第六中学2019届高三上学期12月月考化学试题(已下线)2018年高考题及模拟题汇编 专题14 化学反应原理综合2018年全国普通高等学校招生统一考试化学(天津卷)
更新时间:2018-06-09 09:11:57
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】我国提出争取在2030年前实现碳达峰、2060年实现碳中和,这对于改善环境、实现绿色发展至关重要。回答下列问题:
Ⅰ.甲烷作为一种新能源在化学领域应用广泛,现利用 甲烷化反应:
甲烷化反应:
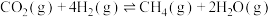 将
将 转化为
转化为 。
。
(1)已知: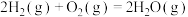
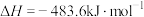


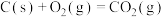
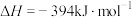
写出 甲烷化反应的热化学方程式
甲烷化反应的热化学方程式______ 。
(2)下列能 说明上述 甲烷化反应达到平衡状态的是______(填字母)。
甲烷化反应达到平衡状态的是______(填字母)。
(3)已知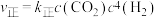 、
、 、
、 、
、 分别是正、逆反应速率常数,则
分别是正、逆反应速率常数,则 甲烷化反应的平衡常数
甲烷化反应的平衡常数
______ (用 、
、 表示)。温度升高,
表示)。温度升高, 的转化率
的转化率______ 。(填“增大”或“减小”)
(4)画出在其他条件不变时,随着容器体积增大对 的转化率的影响坐标图。
的转化率的影响坐标图。______ 。
Ⅱ.如图所示电解装置可将 转化为甲烷,该装置中的电解质溶液为稀硫酸,电极材料均为惰性电极。
转化为甲烷,该装置中的电解质溶液为稀硫酸,电极材料均为惰性电极。
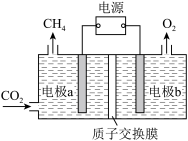
(5)电极a是______ (填“阴极”或“阳极”),电极b上发生的电极反应式是______ 。
Ⅰ.甲烷作为一种新能源在化学领域应用广泛,现利用
 甲烷化反应:
甲烷化反应: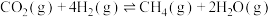 将
将 转化为
转化为 。
。(1)已知:
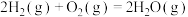
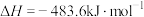


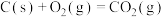
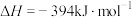
写出
 甲烷化反应的热化学方程式
甲烷化反应的热化学方程式(2)下列
 甲烷化反应达到平衡状态的是______(填字母)。
甲烷化反应达到平衡状态的是______(填字母)。A.反应中 和 和 的物质的量浓度之比为1∶1 的物质的量浓度之比为1∶1 |
| B.混合气体的平均相对分子质量不随时间变化而变化 |
C.单位时间内消耗4n mol  ,同时生成n mol ,同时生成n mol  |
D. 和水蒸气的物质的量之和不再改变 和水蒸气的物质的量之和不再改变 |
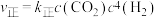 、
、 、
、 、
、 分别是正、逆反应速率常数,则
分别是正、逆反应速率常数,则 甲烷化反应的平衡常数
甲烷化反应的平衡常数
 、
、 表示)。温度升高,
表示)。温度升高, 的转化率
的转化率(4)画出在其他条件不变时,随着容器体积增大对
 的转化率的影响坐标图。
的转化率的影响坐标图。Ⅱ.如图所示电解装置可将
 转化为甲烷,该装置中的电解质溶液为稀硫酸,电极材料均为惰性电极。
转化为甲烷,该装置中的电解质溶液为稀硫酸,电极材料均为惰性电极。
(5)电极a是
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】I.亚硝酸氯(ClNO)是有机合成中的重要试剂,亚硝酸氯可由NO与 在通常条件下反应得到,化学方程式为
在通常条件下反应得到,化学方程式为 。
。
(1)氨氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①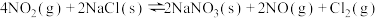

②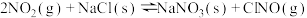

③

则 、
、 、
、 之间的关系为
之间的关系为
_______ 。
(2)在一定温度下,向2L的恒容密闭容器中充入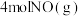 和
和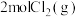 ,能作为该反应达到平衡的标志的有
,能作为该反应达到平衡的标志的有_______ (填字母)
a.气体体积保持不变 b.容器压强保持不变 c.气体颜色保持不变
d. e.混合气体的平均相对分子质量不变
e.混合气体的平均相对分子质量不变
II.我国科学家研制出一种新型催化剂,实现了温和条件下“人工固氮”。在催化剂表面和常温常压下发生反应: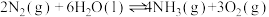

(3)改变下列一个条件,能提高活化分子百分数的是_______(填字母)。
(4)在一定的压强和温度下,向某密闭容器中充入足量液态水,再充入 和
和 的混合气体(Ar不参与反应),发生上述反应。保持总压强和温度不变,充入
的混合气体(Ar不参与反应),发生上述反应。保持总压强和温度不变,充入 与不充入相比,N2的平衡转化率
与不充入相比,N2的平衡转化率___ (填“增大”、“减小”或“不变”)。
(5)在某恒温恒容密闭容器中充入足量液态水和一定量的N2,达到平衡后,再充入少量N2,N2的平衡转化率_______ (填“增大”、“减小”或“不变”)。为提高平衡时N2的转化率,除适当控制反应温度和调节压强外,还可以采取的措施是_______ 。
 在通常条件下反应得到,化学方程式为
在通常条件下反应得到,化学方程式为 。
。(1)氨氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①
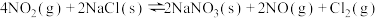

②
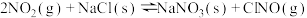

③


则
 、
、 、
、 之间的关系为
之间的关系为
(2)在一定温度下,向2L的恒容密闭容器中充入
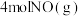 和
和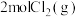 ,能作为该反应达到平衡的标志的有
,能作为该反应达到平衡的标志的有a.气体体积保持不变 b.容器压强保持不变 c.气体颜色保持不变
d.
 e.混合气体的平均相对分子质量不变
e.混合气体的平均相对分子质量不变II.我国科学家研制出一种新型催化剂,实现了温和条件下“人工固氮”。在催化剂表面和常温常压下发生反应:
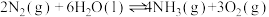

(3)改变下列一个条件,能提高活化分子百分数的是_______(填字母)。
| A.增大反应物浓度 | B.加入高效催化剂 | C.适当升温 | D.增大压强 |
 和
和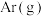 的混合气体(Ar不参与反应),发生上述反应。保持总压强和温度不变,充入
的混合气体(Ar不参与反应),发生上述反应。保持总压强和温度不变,充入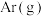 与不充入相比,N2的平衡转化率
与不充入相比,N2的平衡转化率(5)在某恒温恒容密闭容器中充入足量液态水和一定量的N2,达到平衡后,再充入少量N2,N2的平衡转化率
您最近半年使用:0次
【推荐3】多晶硅是制作光伏电池的关键材料。以下是由粗硅制备多晶硅的简易过程。

回答下列问题:
(1)硅粉与HCl在300℃时反应生成1molSiHCl3气体和H2,放出225kJ热量,该反应的热化学方程式为_______ 。SiHCl3的电子式为_______ 。
(2)将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g)⇌SiHCl3(g)+HCl(g) ΔH1˃0
②3SiCl4(g)+2H2(g)+Si(s)⇌4SiHCl3(g) ΔH2<0
③2SiCl4(g)+H2(g)+Si(s)+HCl(g)⇌3SiHCl3(g) ΔH3
ΔH3=_______ (用ΔH1,ΔH2表示)。温度升高,反应③的平衡常数K_______ (填“增大”、“减小”或“不变”)。氢化过程中所需的高纯度H2,可用惰性电极电解KOH溶液制备,写出产生H2的电极反应方程式_______ 。
(3)已知体系自由能变ΔG=ΔH-TΔS,ΔG<0时反应自发进行。三个氢化反应的ΔG与温度的关系如图1所示,可知:反应①能自发进行的最低温度是_______ ;相同温度下,反应②比反应①的ΔG小,主要原因是_______ 。
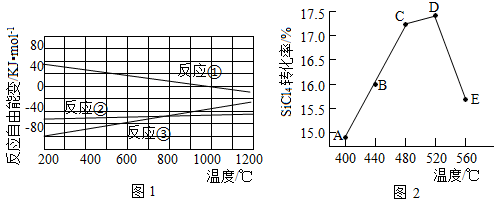
(4)不同温度下反应②中SiCl4转化率如图2所示。下列叙述正确的是_______ (填序号)。
a.B点:υ正>υ逆 b.υ正:A点˃E点 c.反应适宜温度:480~520℃

回答下列问题:
(1)硅粉与HCl在300℃时反应生成1molSiHCl3气体和H2,放出225kJ热量,该反应的热化学方程式为
(2)将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g)⇌SiHCl3(g)+HCl(g) ΔH1˃0
②3SiCl4(g)+2H2(g)+Si(s)⇌4SiHCl3(g) ΔH2<0
③2SiCl4(g)+H2(g)+Si(s)+HCl(g)⇌3SiHCl3(g) ΔH3
ΔH3=
(3)已知体系自由能变ΔG=ΔH-TΔS,ΔG<0时反应自发进行。三个氢化反应的ΔG与温度的关系如图1所示,可知:反应①能自发进行的最低温度是

(4)不同温度下反应②中SiCl4转化率如图2所示。下列叙述正确的是
a.B点:υ正>υ逆 b.υ正:A点˃E点 c.反应适宜温度:480~520℃
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】(1)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:_________________
(2)已知:AgCl+Br-=AgBr↓+Cl-,2AgI+S2-=Ag2S↓+2I-,AgBr+I-=AgI↓+Br-。由以上实验事实可知4种难溶银盐溶解度减小的顺序是_______________________________ 。
(3)用碳棒作电极,电解下列水溶液:
①Na2SO4溶液 ②AgNO3溶液 ③KCl溶液 ④CuCl2溶液。(填编号)
A、通过相同电量时,阴极产生的气体的物质的量相同的是_______________________ 。
B、通过相同电量时,产生的气体总的物质的量由多到少排列顺序是___________ 。
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
(2)已知:AgCl+Br-=AgBr↓+Cl-,2AgI+S2-=Ag2S↓+2I-,AgBr+I-=AgI↓+Br-。由以上实验事实可知4种难溶银盐溶解度减小的顺序是
(3)用碳棒作电极,电解下列水溶液:
①Na2SO4溶液 ②AgNO3溶液 ③KCl溶液 ④CuCl2溶液。(填编号)
A、通过相同电量时,阴极产生的气体的物质的量相同的是
B、通过相同电量时,产生的气体总的物质的量由多到少排列顺序是
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】利用磷石膏废渣(主要成分为 )生产硫酸可实现硫资源的循环利用.回答下列问题:
)生产硫酸可实现硫资源的循环利用.回答下列问题:
硫黄分解磷石膏工艺涉及的主要反应为:
(I)

(II)

(1)对于反应(I),下列化学反应速率最大的是______
A. B.
B.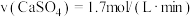
C.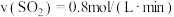 D.
D.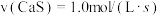
(2)反应 =
=  的
的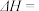
______  ;
;
(3)在恒温恒容密闭容器中只进行反应(I),能说明其已达到平衡状态的是______ (填字母).
A.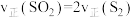 B.气体中含硫原子总数不随时间变化
B.气体中含硫原子总数不随时间变化
C.容器内固体总质量不再随时间变化 D.容器内气体总压强不再随时间变化
(4)在恒温恒容密闭容器中进行的反应(II)达到平衡时,向容器中( 、
、 、
、 均足量)再充入少量
均足量)再充入少量 ,达到新平衡后,与原平衡相比
,达到新平衡后,与原平衡相比
____ (填“增大”“减小”或“不变”),原因为_____ .
 )生产硫酸可实现硫资源的循环利用.回答下列问题:
)生产硫酸可实现硫资源的循环利用.回答下列问题:硫黄分解磷石膏工艺涉及的主要反应为:
(I)


(II)


(1)对于反应(I),下列化学反应速率最大的是
A.
 B.
B.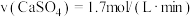
C.
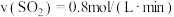 D.
D.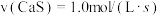
(2)反应
 =
=  的
的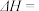
 ;
;(3)在恒温恒容密闭容器中只进行反应(I),能说明其已达到平衡状态的是
A.
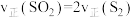 B.气体中含硫原子总数不随时间变化
B.气体中含硫原子总数不随时间变化C.容器内固体总质量不再随时间变化 D.容器内气体总压强不再随时间变化
(4)在恒温恒容密闭容器中进行的反应(II)达到平衡时,向容器中(
 、
、 、
、 均足量)再充入少量
均足量)再充入少量 ,达到新平衡后,与原平衡相比
,达到新平衡后,与原平衡相比
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】在一固定体积的密闭容器中,充入2 mol CO2和1 mol H2发生如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数与温度(T)的关系如下表:
CO(g)+H2O(g),其化学平衡常数与温度(T)的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_________________ 。
(2)若反应在830 ℃下达到平衡,则CO2气体的转化率为________ 。
(3)若绝热时(容器内外没有热量交换),平衡发生移动的结果是使容器内CO的浓度增大,则容器内气体温度________ (填“升高”、“降低”或“不能确定”)。
(4)能判断该反应是否达到化学平衡状态的依据是____________ 。
A 容器内压强不变 B 混合气体中c(CO)不变
C v正(H2)=v逆(H2O) D c(CO2)=c(CO)
E c(CO2 )·c(H2)=c(CO)·c(H2O)
(5)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染。
已知:CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g) △H3=-867 kJ·mol-1
△H2=_____________ 。
 CO(g)+H2O(g),其化学平衡常数与温度(T)的关系如下表:
CO(g)+H2O(g),其化学平衡常数与温度(T)的关系如下表:| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=
(2)若反应在830 ℃下达到平衡,则CO2气体的转化率为
(3)若绝热时(容器内外没有热量交换),平衡发生移动的结果是使容器内CO的浓度增大,则容器内气体温度
(4)能判断该反应是否达到化学平衡状态的依据是
A 容器内压强不变 B 混合气体中c(CO)不变
C v正(H2)=v逆(H2O) D c(CO2)=c(CO)
E c(CO2 )·c(H2)=c(CO)·c(H2O)
(5)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染。
已知:CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g) △H3=-867 kJ·mol-1
△H2=
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】氨气及其相关产品在化工领域中具有重要作用。回答下列问题:
(1)以NH3和CO2为原料生产尿素[CO(NH2)2],发生反应的化学方程式为2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) △H。
CO(NH2)2(s)+H2O(g) △H。
①该反应每消耗1 mol NH3,放出174kJ热量,则△H=___________ kJ·mol-1。
②为了提高尿素的产率,下列措施可行的是___________ (填标号)。
A.升高温度 B.增大压强 C.加入合适的催化剂 D.及时移除部分H2O(g)
(2)某温度下,向恒容密闭容器中通入1 mol NH3、0.5 mol CO2两种原料气,使之发生上述反应。5 min后,反应达到平衡,此时得到的尿素质量为15 g,容器内的压强(p)随时间(t)的变化如图1所示。
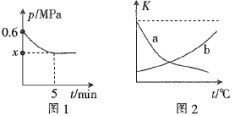
①保持其他条件不变,图2中能正确反映平衡常数K随温度的变化关系的曲线是___________ (填标号)。
②反应达到平衡后,CO2的转化率为___________ ,x=___________ ,平衡常数Kp=___________ (kPa)-2(以分压表示,分压=总压×物质的量分数)。
(3)NH3-O2燃料电池的结构如图所示。
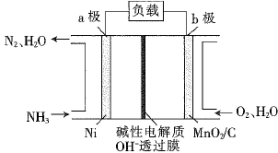
①a极的电极反应式为___________ 。
②每消耗标准状况下5.6 L O2,电路中转移的电子数为___________ NA。
(1)以NH3和CO2为原料生产尿素[CO(NH2)2],发生反应的化学方程式为2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) △H。
CO(NH2)2(s)+H2O(g) △H。①该反应每消耗1 mol NH3,放出174kJ热量,则△H=
②为了提高尿素的产率,下列措施可行的是
A.升高温度 B.增大压强 C.加入合适的催化剂 D.及时移除部分H2O(g)
(2)某温度下,向恒容密闭容器中通入1 mol NH3、0.5 mol CO2两种原料气,使之发生上述反应。5 min后,反应达到平衡,此时得到的尿素质量为15 g,容器内的压强(p)随时间(t)的变化如图1所示。

①保持其他条件不变,图2中能正确反映平衡常数K随温度的变化关系的曲线是
②反应达到平衡后,CO2的转化率为
(3)NH3-O2燃料电池的结构如图所示。

①a极的电极反应式为
②每消耗标准状况下5.6 L O2,电路中转移的电子数为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】燃煤及工业废气中的SO2是形成酸雨的主要原因,消除SO2是减少酸雨形成的有效方法。完成下列问题:
(1)已知:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) △H1= - Q kJ·mol-1。若标准状况下产生112LSO2(g),则该反应放出热量为______________ 。(用Q表示)
(2)燃料细菌脱硫法
①含FeS2的燃煤可用氧化亚铁硫杆菌(T.f)、氧化亚铁微螺菌(L.f)、氧化硫硫杆菌(T.t)进行脱硫,其脱硫过程如图所示:
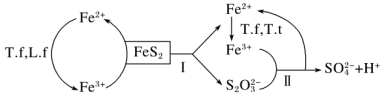
已知:脱硫总反应为:FeS2+14Fe3++8H2O=SO +15Fe2++16H+,
+15Fe2++16H+,
Ⅰ反应的化学方程式为:FeS2+6Fe3++3H2O=S2O +7Fe2++6H+;
+7Fe2++6H+;
写出Ⅱ反应的化学方程式_____________ 。
②在上述脱硫反应中,氧化亚铁硫杆菌(T.f)与Fe3+的形成过程可视为图所示的原电池: 该细胞膜为________ (填“阳离子交换膜”或“阴离子交换膜”)。该电池的正极电极反应式为___________ 。该方法在高温下脱硫效率大大降低,原因是_______ 。
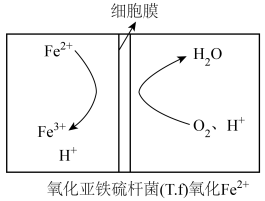
(1)已知:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) △H1= - Q kJ·mol-1。若标准状况下产生112LSO2(g),则该反应放出热量为
(2)燃料细菌脱硫法
①含FeS2的燃煤可用氧化亚铁硫杆菌(T.f)、氧化亚铁微螺菌(L.f)、氧化硫硫杆菌(T.t)进行脱硫,其脱硫过程如图所示:

已知:脱硫总反应为:FeS2+14Fe3++8H2O=SO
 +15Fe2++16H+,
+15Fe2++16H+,Ⅰ反应的化学方程式为:FeS2+6Fe3++3H2O=S2O
 +7Fe2++6H+;
+7Fe2++6H+;写出Ⅱ反应的化学方程式
②在上述脱硫反应中,氧化亚铁硫杆菌(T.f)与Fe3+的形成过程可视为图所示的原电池: 该细胞膜为

您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】二氯化钒(VCl2)有强还原性和吸湿性,熔点为425℃、沸点为900℃,是制备多种医药、催化剂、含钒化合物的中间体。某学习小组在了解VCl2的相关性质后,在实验室制备VCl2并进行相关探究。回答下列问题:
(1)画出基态V原子的价电子的轨道表示式:_____ 。
(2)小组同学通过VCl3分解制备VCl2。

①按气流方向,图中装置合理的连接顺序为_____ (用小写字母填空)。
②A中盛放NaNO2的仪器名称为_____ ,其中发生反应的离子方程式为_____ 。
(3)测定产品纯度:实验后产品中混有少量VCl3杂质。称量1.3775g样品,溶于水充分水解,调pH后滴加Na2CrO4作指示剂,用0.5000mol•L-1AgNO3标准溶液滴定Cl-,达到滴定终点时消耗标准液体积为46.00mL(Ag2CrO4为砖红色沉淀)。
①滴定终点的现象为_____ 。
②产品中VCl3与VCl2的物质的量之比为_____ 。
(4)小组同学进一步用如图所示装置比较含钒离子的还原性。接通电路后,观察到右侧锥形瓶中溶液蓝色逐渐变深,发生的电极反应式为_____ ,则VO2+、V2+的还原性较强的是_____ (填化学式)。
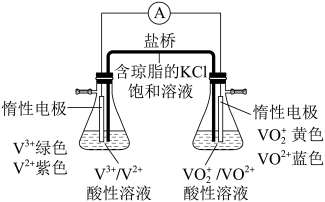
(1)画出基态V原子的价电子的轨道表示式:
(2)小组同学通过VCl3分解制备VCl2。

①按气流方向,图中装置合理的连接顺序为
②A中盛放NaNO2的仪器名称为
(3)测定产品纯度:实验后产品中混有少量VCl3杂质。称量1.3775g样品,溶于水充分水解,调pH后滴加Na2CrO4作指示剂,用0.5000mol•L-1AgNO3标准溶液滴定Cl-,达到滴定终点时消耗标准液体积为46.00mL(Ag2CrO4为砖红色沉淀)。
①滴定终点的现象为
②产品中VCl3与VCl2的物质的量之比为
(4)小组同学进一步用如图所示装置比较含钒离子的还原性。接通电路后,观察到右侧锥形瓶中溶液蓝色逐渐变深,发生的电极反应式为

您最近半年使用:0次



