25℃时, 在pH都等于5的NH4Cl和CH3COOH两种溶液中,设由水电离产生的H+ 离子浓度分别为Amol/L与Bmol/L,则A和B关系为
| A.A < B | B.A = 10-4 B | C.B = 10-4 A | D.A = B |
更新时间:2018-11-02 21:11:35
|
【知识点】 水溶液中水的电离程度及的计算解读
相似题推荐
单选题
|
较易
(0.85)
【推荐1】下列说法正确的是
| A.常温下,pH=1的稀硫酸中c(OH-)=10-13mol/L |
B.常温下,pH=5的NH4Cl溶液、NH4HSO4溶液中,c(NH )后者大 )后者大 |
| C.常温下,向水中加少量醋酸铵固体,pH保持7不变,说明水的电离平衡没有移动 |
D.常温下,将0.1mol/L醋酸溶液稀释, 的比值增大 的比值增大 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.0.1mol 原子含有的中子数是 原子含有的中子数是 |
B.1molFe与水蒸气在高温下充分反应,转移的电子数为 |
C.35℃时,1L 的 的 溶液中,水电离出的 溶液中,水电离出的 数为 数为 |
D.标准状况下,22.4LNO和11.2L 和混合,生成物中含有的分子数为 和混合,生成物中含有的分子数为 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐3】设NA为阿伏加德罗常数的值.下列说法正确的是
A. 和 和 于密闭容器中充分反应后,其分子总数为0.2NA 于密闭容器中充分反应后,其分子总数为0.2NA |
B.常温下, 的 的 溶液中,水电离出的 溶液中,水电离出的 数为 数为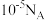 |
C.在标准状况下, 中含有的电子的数目为NA 中含有的电子的数目为NA |
D. 溶液中含有的 溶液中含有的 数为0.1NA 数为0.1NA |
您最近一年使用:0次



