现有几组物质的熔点(℃)的数据:

据此回答下列问题:
(1)A组属于___________ 晶体,其熔化时克服的微粒间的作用力是__________________ 。
(2)B组晶体共同的物理性质是___________________ (填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于_______________________________________ 。
(4)D组晶体可能具有的性质是_________________ (填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因解释为_______________________________ 。

据此回答下列问题:
(1)A组属于
(2)B组晶体共同的物理性质是
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于
(4)D组晶体可能具有的性质是
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因解释为
16-17高一·全国·课时练习 查看更多[6]
更新时间:2018-12-09 14:37:23
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】下列数据是对应物质的熔点,有关的判断错误的是( )
A.只要含有金属阳离子的晶体就一定是离子晶体
B.在共价化合物中各原子都形成8电子结构
C.同族元素的氧化物可形成不同类型的晶体
D.金属晶体的熔点不一定比分子晶体的高
19-II如图为几种晶体或晶胞的构型示意图。
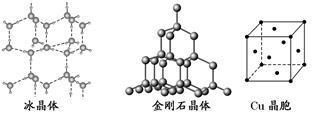

请回答下列问题:
(1)这些晶体中,粒子之间以共价键结合形成的晶体是____________ 。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为_________________ 。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能________ (填“大于”或“小于”)MgO晶体的晶格能,原因是_______________ 。
(4)每个铜晶胞中实际占有________ 个铜原子,CaCl2晶体中Ca2+的配位数为________ 。
(5)冰的熔点远高于干冰,除因为H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是_________ 。
| Na2O | Na | AlF3 | AlCl3 | Al2O3 | BCl3 | CO2 | SiO2 |
| 920 ℃ | 97.8 ℃ | 1291 ℃ | 190 ℃ | 2073 ℃ | -107 ℃ | -57 ℃ | 1723 ℃ |
A.只要含有金属阳离子的晶体就一定是离子晶体
B.在共价化合物中各原子都形成8电子结构
C.同族元素的氧化物可形成不同类型的晶体
D.金属晶体的熔点不一定比分子晶体的高
19-II如图为几种晶体或晶胞的构型示意图。


请回答下列问题:
(1)这些晶体中,粒子之间以共价键结合形成的晶体是
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能
(4)每个铜晶胞中实际占有
(5)冰的熔点远高于干冰,除因为H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】(1)氯酸钾熔化,粒子间克服了________ 的作用力;二氧化硅熔化,粒子间克服了________ 的作用力;碘的升华,粒子间克服了________ 的作用力。三种晶体的熔点由高到低的顺序是____________ (填化学式)。
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为________ (填序号)。
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子是________ ,由非极性键形成的非极性分子是________ ,能形成分子晶体的物质是________ ,含有氢键的晶体的化学式是________________________ ,属于离子晶体的是____________________ ,属于原子晶体的是____________________ ,五种物质的熔点由高到低的顺序是________________ 。
(4)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:
A.________________ ;B.________________ ;C.________________ ;D.________________ 。
(5)相同压强下,部分元素氟化物的熔点见下表:
试解释上表中氟化物熔点差异的原因:_________________
(6)镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。150 ℃时,Ni(CO)4分解为Ni和CO。Ni(CO)是________ 晶体,Ni(CO)4易溶于下列________ (填序号)
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子是
(4)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:
A.
(5)相同压强下,部分元素氟化物的熔点见下表:
氟化物 | NaF | MgF2 | SiF4 |
熔点/℃ | 1266 | 1534 | 183 |
试解释上表中氟化物熔点差异的原因:
(6)镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。150 ℃时,Ni(CO)4分解为Ni和CO。Ni(CO)是
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】
1.Ⅰ.(1)分析下列物质的物理性质,判断其晶体类型:
A.碳化铝,黄色晶体,熔点2200OC,熔融态不导电________________________ ;
B.溴化铝,无色晶体,熔点98OC,熔融态不导电__________________________ ;
C. 五氟化钒,无色晶体,熔点19.5OC,易溶于乙醇、氯仿、丙酮中____________ ;
D.溴化钾,无色晶体,熔融时或溶于水中都能导电_________________________ 。
(2)具有双核10个电子的共价化合物的化学式是______________ ,三核10个电子的共价化合物的化学式是__________ ,四核10个电子的共价化合物的化学式是__________ ,五核10个电子的共价化合物的化学式是___________
(3)A元素的氯化物的化学式为ACly,分子中各原子最外层电子数之和为26,则y的值为
_______________________
2.Ⅱ.根据要求回答下列问题:
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧I2 ⑨He ⑩Al
(1)只含有离子键的是(用序号回答)______ .
(2)含有共价键的离子化合物是(用序号回答)______ .
(3)含有共价键的共价化合物是(用序号回答)______ .
(4)常温时为固体,当其熔化时,不破坏化学键的是(用序号回答)______ .
(5)熔融状态时和固态时,都能导电的有(用序号回答)______ .
(6)晶体中只存在分子间作用力,没有共价键的是(用序号回答)______ .
1.Ⅰ.(1)分析下列物质的物理性质,判断其晶体类型:
A.碳化铝,黄色晶体,熔点2200OC,熔融态不导电
B.溴化铝,无色晶体,熔点98OC,熔融态不导电
C. 五氟化钒,无色晶体,熔点19.5OC,易溶于乙醇、氯仿、丙酮中
D.溴化钾,无色晶体,熔融时或溶于水中都能导电
(2)具有双核10个电子的共价化合物的化学式是
(3)A元素的氯化物的化学式为ACly,分子中各原子最外层电子数之和为26,则y的值为
2.Ⅱ.根据要求回答下列问题:
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧I2 ⑨He ⑩Al
(1)只含有离子键的是(用序号回答)
(2)含有共价键的离子化合物是(用序号回答)
(3)含有共价键的共价化合物是(用序号回答)
(4)常温时为固体,当其熔化时,不破坏化学键的是(用序号回答)
(5)熔融状态时和固态时,都能导电的有(用序号回答)
(6)晶体中只存在分子间作用力,没有共价键的是(用序号回答)
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐1】①MgCl2②干冰③冰 ④NaCl ⑤白磷(P4)⑥SiO2⑦Na2CO3⑧金刚石 ⑨NaOH (填序号)
(1)属于离子晶体的是_____________ (2)属于分子晶体的是___________
(3)属于原子晶体的是_____________ (4)熔化时只破坏共价键的是______
(1)属于离子晶体的是
(3)属于原子晶体的是
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】回答下列问题
(1)按要求填空:
①CO2的电子式为:____________________
②基态N原子的轨道表示为________________________________________ ;
③基态Ga原子价电子层的电子排布式为_____________________________ ;
(2)对于A.MgO B.He C.NH3 D.CaO E.干冰 F.Ar五种物质:
①熔沸点最低的是________ ;液态时能导电的是________ (填字母编号)。
②上述物质所含的元素中,基态原子含单电子最多的元素是______ (填元素符号)。
③上述物质的晶体中,属于离子晶体且熔点最高的是____________ (填字母编号)。
④上述物质的晶体熔化时,所克服的微粒间的作用力与冰熔化时所克服的作用力类型完全相同的是______ (填字母编号)。
(3)已知熔融的BeCl2不导电,则BeCl2属于_______ 晶体,中心原子的杂化类型为______ 。
(1)按要求填空:
①CO2的电子式为:
②基态N原子的轨道表示为
③基态Ga原子价电子层的电子排布式为
(2)对于A.MgO B.He C.NH3 D.CaO E.干冰 F.Ar五种物质:
①熔沸点最低的是
②上述物质所含的元素中,基态原子含单电子最多的元素是
③上述物质的晶体中,属于离子晶体且熔点最高的是
④上述物质的晶体熔化时,所克服的微粒间的作用力与冰熔化时所克服的作用力类型完全相同的是
(3)已知熔融的BeCl2不导电,则BeCl2属于
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐1】某元素原子的电子排布式为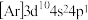 ,根据原子核外电子排布与元素在元素周期表中的位置关系,完成下列各题:
,根据原子核外电子排布与元素在元素周期表中的位置关系,完成下列各题:
(1)该元素处于元素周期表的第___ 周期第____ 族,处于元素周期表的____ 区。
(2)比较下列离子结合氢离子的能力:
___  (填“>”、“<”、“=”),并用离子方程式说明
(填“>”、“<”、“=”),并用离子方程式说明___ 。
(3)比较沸点高低:正丁烷__ 异丁烷(填“>”、“<”、“=”),请从结构角度分析原因____ 。
(4)写出 电子式
电子式___ ,该分子的空间构型__ (填“是”或“否”)为平面形。
(5) 的空间构型为
的空间构型为____ ; 的空间构型为
的空间构型为____ ,硫原子的杂化方式为____ 。
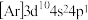 ,根据原子核外电子排布与元素在元素周期表中的位置关系,完成下列各题:
,根据原子核外电子排布与元素在元素周期表中的位置关系,完成下列各题:(1)该元素处于元素周期表的第
(2)比较下列离子结合氢离子的能力:

 (填“>”、“<”、“=”),并用离子方程式说明
(填“>”、“<”、“=”),并用离子方程式说明(3)比较沸点高低:正丁烷
(4)写出
 电子式
电子式(5)
 的空间构型为
的空间构型为 的空间构型为
的空间构型为
您最近半年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】现有两组物质的熔点数据如表所示:
根据表中数据回答下列问题。
(1)A组属于________ 晶体,其熔化时克服的微粒间的作用力是____________ 。
(2)B组中HF熔点反常是由于__________ 。
(3)B组晶体不可能具有的性质是________________ 。
①硬度小 ②水溶液能导电 ③固体能导电 ④液体状态能导电
| A组 | B组 |
| 金刚石:3550℃ | HF:-83℃ |
| 晶体硅:1410℃ | HCl:-115℃ |
| 晶体硅:2300℃ | HBr:-89℃ |
| 二氧化硅:1710℃ | HI:-51℃ |
根据表中数据回答下列问题。
(1)A组属于
(2)B组中HF熔点反常是由于
(3)B组晶体不可能具有的性质是
①硬度小 ②水溶液能导电 ③固体能导电 ④液体状态能导电
您最近半年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】氯化汞(HgCl2)可用于木材和解剖标本的保存、皮革鞣制和钢铁镂蚀,是分析化学的重要试剂,还可做消毒剂和防腐剂。HgCl2在水中稍有水解:HgCl2+H2O Hg(OH)Cl+HCl
Hg(OH)Cl+HCl
(1)为了抑制上述反应中HgCl2的水解,可以采取的措施是_________ 。(选填编号)
a.加水稀释 b. 增加HCl的浓度 c.及时移走产物 d.降温
(2)HgCl2与稀氨水反应则生成难溶解的氨基氯化汞,化学方程式为HgCl2+2NH3→Hg(NH2)Cl↓+NH4Cl,上述反应的短周期元素中,非金属性最强元素原子的最外层轨道排布式为__________ ,该原子核外电子云有_________ 种不同的伸展方向。
(3)已知PCl3与NH3分子结构相似,PCl3的电子式是_______________ ;PCl3与NH3的沸点比较,______ 高,其原因是_______________________ 。
(4)氮的一种氢化物HN3可用于有机合成,其酸性与醋酸相似,若HN3与氨水混合,此反应的化学方程式是_______________________ 。
(5)若将0.4mol/LNH4Cl与0.2mol/LNaOH溶液等体积混合后,PH=10,下列关系正确的是( )
A.c(NH4+)>c(OH-)>c(Na+)>c(NH3•H2O) >c(H+)
B.c(NH4+)>c(Na+)>c(OH-)>c(NH3•H2O) >c(H+)
C.c(NH4+)>c(Na+)>c(OH-)>c(H+)>c(NH3•H2O)
D.c(NH4+)>c(Na+)>c(NH3•H2O) >c(OH-)>c(H+)
 Hg(OH)Cl+HCl
Hg(OH)Cl+HCl(1)为了抑制上述反应中HgCl2的水解,可以采取的措施是
a.加水稀释 b. 增加HCl的浓度 c.及时移走产物 d.降温
(2)HgCl2与稀氨水反应则生成难溶解的氨基氯化汞,化学方程式为HgCl2+2NH3→Hg(NH2)Cl↓+NH4Cl,上述反应的短周期元素中,非金属性最强元素原子的最外层轨道排布式为
(3)已知PCl3与NH3分子结构相似,PCl3的电子式是
(4)氮的一种氢化物HN3可用于有机合成,其酸性与醋酸相似,若HN3与氨水混合,此反应的化学方程式是
(5)若将0.4mol/LNH4Cl与0.2mol/LNaOH溶液等体积混合后,PH=10,下列关系正确的是
A.c(NH4+)>c(OH-)>c(Na+)>c(NH3•H2O) >c(H+)
B.c(NH4+)>c(Na+)>c(OH-)>c(NH3•H2O) >c(H+)
C.c(NH4+)>c(Na+)>c(OH-)>c(H+)>c(NH3•H2O)
D.c(NH4+)>c(Na+)>c(NH3•H2O) >c(OH-)>c(H+)
您最近半年使用:0次

 氟化氢气体的体积明显小于
氟化氢气体的体积明显小于 ,其原因是
,其原因是 )硬度小,是制作高级润滑剂的重要原料。两种碳单质性能差异明显的原因是
)硬度小,是制作高级润滑剂的重要原料。两种碳单质性能差异明显的原因是

