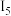部分中学化学常见元素的原子结构及性质如下表所示:
(1)E 元素在周期表中的位置为_____ 。
(2)B 与 C 形成的化合物的化学式为_____ ,它属于_____ (填“离子”或“共价”)化合物。
(3)C 与 E 都是较活泼的非金属元素,两者的非金属性较强的是:_____ (用化学符号回答), 请写出一个可以判断二者非金属性强弱的化学方程式__________________ 。
(4)B~F 各元素原子半径由小到大的顺序是___________________________ (用元素符号表示)。
(5)有人认为 B、D 的单质用导线连接后插入 NaOH 溶液中可以形成原电池,你认为是否可以,若可以,试写出负极的电极方程式_________
| 元素 | 结构及性质 |
| A | A 单质是生活中的常见金属,它有两种氯化物,相对分子质量相差 35.5 |
| B | B 原子最外层电子数是内层电子总数的 1/5 |
| C | C 是常见化肥的主要元素,单质常温下呈气态 |
| D | D 是地壳中含量最丰富的金属元素,工业上可通过电解法获取其单质 |
| E | 通常情况下,E 没有最高正价,A、B、C、D、F 都能与 E 形成化合物 |
| F | F 在周期表中可以排在 IA 族,也有人提出可以排在 VIIA 族 |
(1)E 元素在周期表中的位置为
(2)B 与 C 形成的化合物的化学式为
(3)C 与 E 都是较活泼的非金属元素,两者的非金属性较强的是:
(4)B~F 各元素原子半径由小到大的顺序是
(5)有人认为 B、D 的单质用导线连接后插入 NaOH 溶液中可以形成原电池,你认为是否可以,若可以,试写出负极的电极方程式
更新时间:2018-12-20 10:06:46
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某兴趣小组为研究原电池原理,设计如图甲乙两个原电池装置。
(1)如图甲,a和b用导线连接,Cu电极的电极反应式为:________ ,溶液中SO42-移向______ (填“Cu”或“Fe”)极。
(2)如图乙所示的原电池装置中,负极材料是_____ 。正极上能够观察到的现象是_______________ 。 负极的电极反应式是_________________ 。原电池工作一段时间后,若消耗负极5.4g,则放出气体______ mol。
(3)将反应Cu + Fe2(SO4)3=2FeSO4 + CuSO4设计成盐桥电池并画图____________

(4)依据Ba(OH)2·8H2O与NH4Cl晶体的反应原理设计原电池,你认为是否可行并说明理由______ 。

(1)如图甲,a和b用导线连接,Cu电极的电极反应式为:
(2)如图乙所示的原电池装置中,负极材料是
(3)将反应Cu + Fe2(SO4)3=2FeSO4 + CuSO4设计成盐桥电池并画图

(4)依据Ba(OH)2·8H2O与NH4Cl晶体的反应原理设计原电池,你认为是否可行并说明理由
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
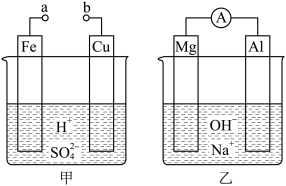
【推荐2】科研小组利用钛钒磁铁矿的矿渣(V2O3、FeO、SiO2、Al2O3及一些稳定杂质)制备钠离子电池电极材料磷酸钒钠[Na3V2(PO4)3]。
已知:①NH4VO3难溶于水
②+5价钒在溶液中的主要存在形式和pH的关系如表:
回答下列问题:
(1)球磨的作用_____ 。
(2)实验室焙烧时使用酒精喷灯、三脚架、_____ 、铁坩埚、玻璃棒和坩埚钳。焙烧时V2O3转化为可溶的Na3VO4的反应方程式为_____ 。
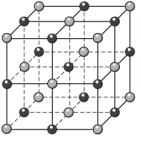
(3)如图是某氧化物的晶胞,则该氧化物是_____ 。(填字母序号)
a.V2O3 b.FeO c.SiO2 d.Al2O3
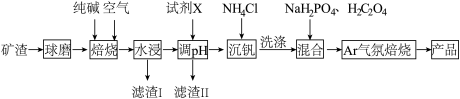
(4)滤渣Ⅱ主要成分是_____ (填化学式),试剂X可以使用流程中的某种产物,其电子式为_____ 。
(5)Ar气氛焙烧制产品时的化学方程式为_____ 。
(6)某种钠离子电池充电时总反应为Na3V2(PO4)3+C6=NaxCs6+Na3-xV2(PO4)3,该电池放电时正极的电极方程式为_____ 。

已知:①NH4VO3难溶于水
②+5价钒在溶液中的主要存在形式和pH的关系如表:
| pH | <6 | 6~8 | 8~10 | 10~12 |
| 主要离子 | VO | VO | V2O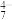 | VO |
(1)球磨的作用
(2)实验室焙烧时使用酒精喷灯、三脚架、
(3)如图是某氧化物的晶胞,则该氧化物是
a.V2O3 b.FeO c.SiO2 d.Al2O3

(4)滤渣Ⅱ主要成分是
(5)Ar气氛焙烧制产品时的化学方程式为
(6)某种钠离子电池充电时总反应为Na3V2(PO4)3+C6=NaxCs6+Na3-xV2(PO4)3,该电池放电时正极的电极方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】回答下列问题:
(1)通过活性炭对汽车尾气进行处理,相关原理为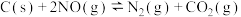 。下列情况能说明该反应达到平衡状态的是
。下列情况能说明该反应达到平衡状态的是___________ 。
A.
B.气体的总物质的量保持不变
C.恒温、恒压条件下,混合气体的平均摩尔质量保持不变
D.恒温、恒容条件下,混合气体的密度保持不变
E.单位时间内断裂1mol 同时生成1mol C=O
同时生成1mol C=O
(2)在催化转化器中,汽车尾气中的CO和NO可发生反应 ,若在容积为10L的密闭容器中进行该反应,起始时充入0.4mol CO、0.2mol NO,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
,若在容积为10L的密闭容器中进行该反应,起始时充入0.4mol CO、0.2mol NO,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
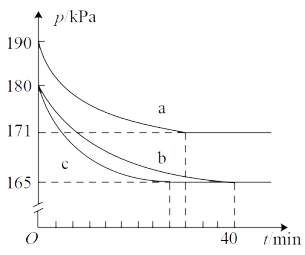
在 温度下,实验b从开始至40min达到平衡时的反应速率
温度下,实验b从开始至40min达到平衡时的反应速率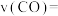
___________ ;NO的平衡转化率为___________ 。
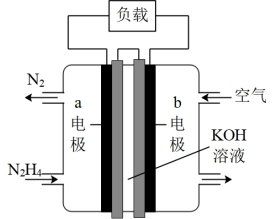
(3)为减少汽车尾气的污染,逐步向着新能源汽车发展。肼—空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景,其工作原理如图所示,负极发生的反应式为___________ ,当电池放电转移10mol电子时,至少消耗___________ g。
(1)通过活性炭对汽车尾气进行处理,相关原理为
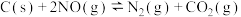 。下列情况能说明该反应达到平衡状态的是
。下列情况能说明该反应达到平衡状态的是A.

B.气体的总物质的量保持不变
C.恒温、恒压条件下,混合气体的平均摩尔质量保持不变
D.恒温、恒容条件下,混合气体的密度保持不变
E.单位时间内断裂1mol
 同时生成1mol C=O
同时生成1mol C=O(2)在催化转化器中,汽车尾气中的CO和NO可发生反应
 ,若在容积为10L的密闭容器中进行该反应,起始时充入0.4mol CO、0.2mol NO,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
,若在容积为10L的密闭容器中进行该反应,起始时充入0.4mol CO、0.2mol NO,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
在
 温度下,实验b从开始至40min达到平衡时的反应速率
温度下,实验b从开始至40min达到平衡时的反应速率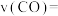
(3)为减少汽车尾气的污染,逐步向着新能源汽车发展。肼—空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景,其工作原理如图所示,负极发生的反应式为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】A、B、C为短周期元素,在周期表中所处的位置如右图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
(1)写出A、B、C三种元素的名称________ 、________ 、________ 。
(2)B位于元素周期表中第________ 周期________ 族。
(3)C的原子结构示意图为________ 。

(1)写出A、B、C三种元素的名称
(2)B位于元素周期表中第
(3)C的原子结构示意图为
您最近一年使用:0次
【推荐2】W、X、Y、Z、M、Q是原子序数依次增大的前四周期元素,其元素性质或原子结构如下表所示。
(1)W、Z、Q的元素符号分别为_______ 、_______ 、_______ 。
(2)X的基态原子有_______ 种空间运动状态不同的电子,其中能量最高的电子所占据的原子轨道呈_______ 形。
(3)与Y处于同一周期的所有元素中,第一电离能比Y大的元素有_______ 种。
(4)M位于元素周期表的_______ 区, 简化的电子排布式为
简化的电子排布式为_______ 。
(5)Q位于元素周期表的第_______ 周期_______ 族,其价层电子排布图为_______
(6)W、X、Y、Z的电负性由大到小的顺序为_______ (填元素符号)。
| 元素 | 元素性质或原子结构 | ||||||||||||||||||
| W | 电子只有一种自旋取向 | ||||||||||||||||||
| X | 最外层电子排布式为 | ||||||||||||||||||
| Y | 非金属元素,且s能级上的电子总数与p能级上的电子总数相等 | ||||||||||||||||||
| Z |
| ||||||||||||||||||
| M | 前四周期元素中原子核外未成对电子数最多 | ||||||||||||||||||
| Q | 与X同主族 | ||||||||||||||||||
(2)X的基态原子有
(3)与Y处于同一周期的所有元素中,第一电离能比Y大的元素有
(4)M位于元素周期表的
 简化的电子排布式为
简化的电子排布式为(5)Q位于元素周期表的第
(6)W、X、Y、Z的电负性由大到小的顺序为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】现有部分短周期元素的性质或原子结构如表:
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是_____ 。W离子的结构示意图为______________
(2)Y原子与氢原子形成的粒子中,与H2O具有相同电子数的阳离子为__________ (填化学式),如何检验该离子___________________________________ 。
(3)T、X两元素形成的化合物属于_________ (填“离子”或“共价”)化合物;写出T的最高价氧化物的水化物和X单质反应的化学方程式:______________ 。
(4)元素Z在周期表中的位置____________________ ,元素Z与元素T相比,非金属性较强的是_____ (用元素符号表示),下列表述中能证明这一事实的是_____ (填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下,Z和T的单质都能与氢氧化钠溶液反应
(5)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、硅酸钠溶液)。
装置如下图所示:
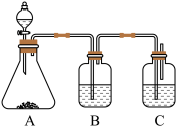
①锥形瓶中为CaCO3固体,分液漏斗所盛试剂应为________ 。
②装置B所盛的试剂是_____________ ,其作用是__________________ 。
③装置C中的现象是__________________ 则结论:非金属性C>Si
| 元素编号 | 元素性质或原子结构 |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| W | 其单质既能跟酸反应,又能跟强碱反应,都产生H2 |
(2)Y原子与氢原子形成的粒子中,与H2O具有相同电子数的阳离子为
(3)T、X两元素形成的化合物属于
(4)元素Z在周期表中的位置
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下,Z和T的单质都能与氢氧化钠溶液反应
(5)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、硅酸钠溶液)。
装置如下图所示:

①锥形瓶中为CaCO3固体,分液漏斗所盛试剂应为
②装置B所盛的试剂是
③装置C中的现象是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
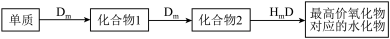
【推荐1】A、B、C、D、E是位于短周期的主族元素。已知:①热稳定性:HmD>HmC;②Cm-、E(m-1)-具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语 回答下列问题:
(1)HmDm的电子式___________ 。
(2)Cm-、E(m-1)-的还原性强弱顺序为:___________ ,能证明其还原性强弱的离子方程式为___________ 。
(3)将E的单质通入A与D形成的化合物的水溶液中,其离子方程式为:___________ 。
(4)在B、C、E单质中,符合下列转化关系的是___________ (填元素符号)。
(1)HmDm的电子式
(2)Cm-、E(m-1)-的还原性强弱顺序为:
(3)将E的单质通入A与D形成的化合物的水溶液中,其离子方程式为:
(4)在B、C、E单质中,符合下列转化关系的是

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】W、X、Y、Z是原子序数依次增大的四种短周期元素。W的气态氢化物能使紫色石蕊溶液变蓝,W、X和Y三种元素的最高价氧化物对应的水化物两两之间可以发生反应,W、X、Y、Z的最外层电子数之和为16。回答下列问题(涉及元素均用化学符号表达):
(1)X与氧的化合物中呈淡黄色的物质,其阳离子与阴离子的个数比为___________ ,其电子式是___________ 。
(2)W、X、Y、Z的简单离子半径由大到小的顺序是:___________ 。
(3)以上四种元素最高价氧化物对应水化物中,酸性最强的酸化学式是___________ 。
(4)X最高价氧化物对应的水化物与Y单质反应的离子方程式为___________ 。
(5)Z和氧元素、硫元素组成的SOZ2,遇水能剧烈水解,有白雾和带有刺激性气味的气体逸出。请据此写出化合物SOZ2和水反应的化学方程式___________ 。
(1)X与氧的化合物中呈淡黄色的物质,其阳离子与阴离子的个数比为
(2)W、X、Y、Z的简单离子半径由大到小的顺序是:
(3)以上四种元素最高价氧化物对应水化物中,酸性最强的酸化学式是
(4)X最高价氧化物对应的水化物与Y单质反应的离子方程式为
(5)Z和氧元素、硫元素组成的SOZ2,遇水能剧烈水解,有白雾和带有刺激性气味的气体逸出。请据此写出化合物SOZ2和水反应的化学方程式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】(一)W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为_______ 。
(2)W与Y可形成化合物W2Y,该化合物的电子式为____ 。
(二)A、B、C、D均为中学化学常见的纯净物,A是单质。
它们之间有如下的反应关系:
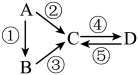
(3)若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质。则C与另一种淡黄色物质反应的化学方程式_____ 。
(4)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置是_____ 。
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写该反应的离子方程式_____ 。
(1)W、X的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为
(2)W与Y可形成化合物W2Y,该化合物的电子式为
(二)A、B、C、D均为中学化学常见的纯净物,A是单质。
它们之间有如下的反应关系:

(3)若A是淡黄色固体,C、D是氧化物,且C是造成酸雨的主要物质。则C与另一种淡黄色物质反应的化学方程式
(4)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置是
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写该反应的离子方程式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】X、Y、Z三种主族元素的单质在常温下都是常见的无色气体,在适当条件下,三者之间可以两两发生反应生成分别是双核、三核和四核的甲、乙、丙三种分子,且乙、丙分子中含有X元素的原子个数比为 。请回答下列问题:
。请回答下列问题:
(1)元素X的名称是___________ ,丙分子的电子式为___________ 。
(2)乙在常温下为无色液体,则乙的化学式为___________ 。
(3)化合物丁含X、Y、Z三种元素,丁是一种常见的强酸,将丁与丙按物质的量之比1:1混合后所得物质戊的晶体结构中含有的化学键为___________ (选填序号)。
a.只含共价键 b.只含离子键 c.既含离子键,又含共价键
 。请回答下列问题:
。请回答下列问题:(1)元素X的名称是
(2)乙在常温下为无色液体,则乙的化学式为
(3)化合物丁含X、Y、Z三种元素,丁是一种常见的强酸,将丁与丙按物质的量之比1:1混合后所得物质戊的晶体结构中含有的化学键为
a.只含共价键 b.只含离子键 c.既含离子键,又含共价键
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外最外层共有24个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同
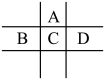
回答下列问题:
(1) A与E形成的化合物的化学式是__________ .B的最高价氧化物化学式为_____________ ,
(2)D的单质与水反应的方程式为__________________________________________________ .
(3) 向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是___________________ :有关反应的离子方程式为:_____________________________________ .
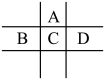
回答下列问题:
(1) A与E形成的化合物的化学式是
(2)D的单质与水反应的方程式为
(3) 向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】元素B是第三周期的主族元素,B在周期表中与邻近的元素A、C、D、E的位置如图所示,已知该五种元素的核电荷数之和为85,回答下列问题:
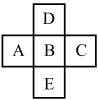
(1)B元素的原子序数是_____ ,原子结构示意图是_____ 。
(2)A、B、C三种元素的非金属性由强到弱的顺序是_____ ,它们的最高价氧化物的水化物的酸性由弱到强的顺序是_____ 。(用化学式表示)
(3)B、D、E三种元素的非金属性由强到弱的顺序是_____ ,它们的氢化物的还原性由弱到强的顺序是_____ (用化学式表示)

(1)B元素的原子序数是
(2)A、B、C三种元素的非金属性由强到弱的顺序是
(3)B、D、E三种元素的非金属性由强到弱的顺序是
您最近一年使用:0次